অক্সিজেনের রূপভেদ
অক্সিজেনের বেশ কয়েকটি পরিচিত রূপভেদ রয়েছে।সর্বাধিক পরিচিত হল আণবিক অক্সিজেন (O2), পৃথিবীর বায়ুমণ্ডল স্তরে এর উল্লেখযোগ্য উপস্থিতি রয়েছে এবং এটি ডাই অক্সিজেন বা ট্রিপলেট অক্সিজেন নামেও পরিচিত। অন্যটি হ'ল অত্যন্ত প্রতিক্রিয়াশীল ওজোন (O3)। বাকিগুলি হল:
- পারমাণবিক অক্সিজেন (O1) — একটি মুক্ত আয়ন।
- একক অক্সিজেন (O2*) — দুটি মেটাস্টেবল অবস্থা এর আণবিক অক্সিজেনের মধ্যে একটি।
- টেট্রক্সাইজেন (O4) — অন্য আর একটি মেটাস্টেবল ফর্ম।
- সলিড অক্সিজেন — ছয়টি বিভিন্ন বর্ণের ধাপে বিদ্যমান যার মধ্যে একটি O
8 এবং অন্য একটি ধাতবজাতীয়।
পারমাণবিক অক্সিজেন
পারমাণবিক অক্সিজেন চিহ্নিত হয় O(3P) বা O(3P) দ্বরা।[১] পারমাণবিক অক্সিজেন খুবই সক্রিয়। কারণ অক্সিজেনের একক পরমাণুর নিকটবর্তী অণুর সাথে দ্রুত বন্ধনের প্রবণতা থাকে। পৃথিবীর উপরিভাগে এটি খুব দীর্ঘকাল প্রাকৃতিকভাবে বিদ্যমান থাকতে পারে না। তবে বহিরাগত মহাশূণ্য স্থান থেকে প্রচুর অতিবেগুনি বিকিরণ এর উপস্থিতির ফলে পৃথিবীর নিম্ন কক্ষপথ এ বায়ুমণ্ডলে ৯৯% অক্সিজেন পরমাণু আকারে অবস্থান করে।[১][২]
পারমাণবিক অক্সিজেনের উপস্থিতি মেরিনার, ভাইকিং এবং সোফিয়া (SOFIA) পর্যবেক্ষণকেন্দ্র দ্বারা মঙ্গল এ শনাক্ত করা হয়েছে।[৩]
ডাইঅক্সিজেন
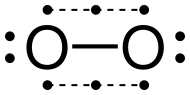
পৃথিবীতে প্রাথমিক অক্সিজেনের সাধারণ রূপভেদ O
2 সাধারণত অক্সিজেন হিসাবে পরিচিত মৌলিক পদার্থ। তবে একে ত্রিপরমাণুক রূপভেদ ওজোন O
3 থেকে আলাদা করতে ডাইঅক্সিজেন, দ্বিপরমাণুক অক্সিজেন, আণবিক অক্সিজেন বা অক্সিজেন গ্যাস নামেও ডাকা হয়। পৃথিবীর বায়ুমণ্ডল এর একটি প্রধান উপাদান হিসাবে (আয়তনে প্রায় ২১%) সর্বাধিক মৌল অক্সিজেন দ্বিপরমাণুক আকারে পাওয়া যায়। বায়বীয় জীবকুল কোষীয় শ্বসন এর প্রান্তীয় অক্সিড্যান্ট হিসাবে বায়ুমণ্ডলীয় ডাই অক্সিজেনের দুর্বল সিগমা বন্ধনে সঞ্চিত রাসায়নিক শক্তি উন্মুক্ত করে। [৪] দুটি অবিচ্ছিন্ন ইলেকট্রন রয়েছে বলে ডাই অক্সিজেনের গ্রাউন্ড স্টেট ট্রিপল অক্সিজেন 3O2 হিসাবে পরিচিত। প্রথম উত্তেজিত অবস্থার একক অক্সিজেন 1O2 তে কোনও অবিচ্ছিন্ন ইলেকট্রন নেই এবং এটি মেটাস্টেবল হয়। ডাবলেট অবস্থার জন্য একটি বিজোড় সংখ্যক ইলেক্ট্রন প্রয়োজন। তাই ইলেক্ট্রন অর্জন বা হ্রাস না করে ডাইঅক্সিজেন ঘটতে পারে না। যেমন সুপার অক্সাইড আয়ন (O−
2) বা ডাইঅক্সিজেনাইল আয়ন (O+
2)।
O
2 এর গ্রাউন্ড স্টেটের এর বন্ধন দৈর্ঘ্য ১২১ pm এবং বন্ধন শক্তি ৪৯৮ kJ/mol। [৫] এটি একটি বর্ণহীন গ্যাস যার স্ফুটনাঙ্ক −১৮৩ °সে (৯০ K; −২৯৭ °ফা)।[৬] এটিকে তরল নাইট্রোজেন দ্বারা শীতল করে বাতাস থেকে ঘনীভূত করা যেতে পরে যার স্ফুটনাঙ্ক −১৯৬ °সে (৭৭ K; −৩২১ °ফা)। তরল অক্সিজেন ফ্যাকাশে নীল বর্ণের এবং অবিচ্ছিন্ন ইলেকট্রনের কারণে বেশ স্পষ্টরূপে প্যারাম্যাগনেটিক। তাই ফ্লাস্কে থাকা তরল অক্সিজেনে সুতো দিয়ে ঝোলানো কোনও চুম্বককে আকৃষ্ট করে।
একক অক্সিজেন
একক অক্সিজেন হ'ল আণবিক অক্সিজেন (O2) এর দুটি মেটাস্টেবল অবস্থার ব্যবহৃত সাধারণ নাম। এতে গ্রাউন্ড অবস্থার চেয়ে উচ্চ শক্তির ট্রিপল অক্সিজেন থাকে। এদের ইলেকট্রন কক্ষের পার্থক্যের কারণে একক অক্সিজেনের ট্রিপলেট অক্সিজেনের চেয়ে আলাদা রাসায়নিক এবং ভৌত ধর্ম হয়। এদের তরঙ্গদৈর্ঘ্যের আলোক শোষণ এবং নির্গমনও ভিন্ন হয়। এটি শক্তির স্থানান্তর দ্বারা ডাই (রঙের) অণুর আলোক সংশ্লেষিত প্রক্রিয়ায় সাধিত হতে পারে। এই ডাই অণুগুলি হতে পারে রোজ বেঙ্গল, মিথাইলিন ব্লু বা প্রোফাইরিন অথবা জলে হাইড্রোজেন ট্রাইঅক্সাইড এর স্বতস্ফূর্ত ভাঙ্গনের মতো রাসায়নিক প্রক্রিয়া অথবা হাইপোক্লোরাইট এর সাথে হাইড্রোজেন পারক্সাইড এর বিক্রিয়াজাত উপাদান।
ওজোন
তিনপরমাণুক অক্সিজেন (ওজোন, O3) হল অক্সিজেনের একটি অত্যন্ত সক্রিয় রূপভেদ যা রাবার এবং ফ্যাব্রিক এর মতো উপাদানের জন্য ধ্বংসাত্মক এবং ফুসফুস কলার জন্য ক্ষতিকারক। [৭] বৈদ্যুতিক মোটর, লেজার প্রিন্টার এবং ফটোকপিয়ার এর থেকে আগত তীব্র ক্লোরিন জাতীয় গন্ধ দিয়ে এর অস্তিত্বের চিহ্ন শনাক্ত করা যেতে পারে। [৬] ১৮৪০ সালে এটির নাম "ওজোন" রাখেন খ্রিস্টান ফ্রেড্রিখ শোনবাইন। [৮] প্রাচীন গ্রিক ὄζειν (ওজিন: "গন্ধে") এবং -ওন (ইংরেজিতে -one) প্রত্যয়টি যোগ করে শব্দটি উদ্ভাবিত যৌগ বোঝাতে সাধারণত ব্যবহার করা হত। [৯]
ওজোন তাপগতীয়বিদ্যায় অস্থিতিশীল। তাই উপরের বায়ুমণ্ডল এ অতি বেগুনী বিকিরণ দ্বারা আরও সাধারণ ডাই অক্সিজেন গঠনের দিকে যেতে পারমাণবিক অক্সিজেনের সঙ্গে O2 বিক্রিয়া করে বিশ্লিষ্ট হয়ে গঠিত হয় O2। [১০] ওজোন অতিবেগুনী দ্বারা দৃঢ়ভাবে শোষিত হয় এবং সৌর ইউভি বিকিরণ দ্বারা বায়োস্ফিয়ার এর মিউটাজেন ও আরও অন্যান্য ক্ষতিকারক প্রভাবগুলির বিরুদ্ধে একটি রক্ষাকবচ হিসাবে কাজ করে (দেখুন ওজোন স্তর] )। [১০]
ওজোন একটি ফ্যাকাশে নীল গ্যাস এবং তরল সংশ্লেষযোগ্য হলে গাঢ় নীল দেখতে হয়। যখনই বাতাস বৈদ্যুতিক নির্গমনের মুখোমুখি হয় তখন এটি তৈরি হয় এবং এতে নতুন-কাঁচা খড়ের বৈশিষ্ট্যযুক্ত তীব্র গন্ধ থাকে যা তথাকথিত 'বৈদ্যুতিক গন্ধ' বলে পরিচিত।