Komplexy přechodných kovů s didusíkem
Komplexy přechodných kovů s didusíkem jsou komplexní sloučeniny obsahující vazby mezi atomy přechodných kovů a molekulami didusíku, které jsou zde ligandy.[2]


Historie
Komplexy přechodných kovů a N2 jsou zkoumány od roku 1965, kdy byla popsána první taková sloučenina,[3] diamagnetický komplex [Ru(NH3)5(N2)]2+, připravený z hydrátu hydrazinu reakcí s chloridem ruthenitým. [Ru(NH3)5]2+ centrum tohoto komplexu je navázáno na jeden konec molekuly N2.[4][5] Existence N2 ligandu byla potvrzena infračervenou spektroskopií, kde se objevil výrazný pás kolem 2170–2100 cm−1.[4] V roce 1966 byla pomocí rentgenové krystalografie určena struktura [Ru(NH3)5(N2)]Cl2.[6]
Sloučenina trans-[IrCl(N2)(PPh3)2] se připravuje reakcí Vaskova komplexu s aromatickým acylazidy. Jeho molekulová geometrie je rovinná.[7]
První příprava didusíkového komplexu pomocí molekulárního dusíku byla provedena v roce 1967; šlo o [Co(H)(N2)(PPh3)3], získaný redukcí Co(acac)3 pomocí AlEt2OEt v dusíkové atmosféře. Protože obsahuje hydrido- i N2 ligandy, tak má tento komplex možné využití při fixaci dusíku.[8]
Od konce 60. let 20. století byly připraveny didusíkové komplexy železa,[9] molybdenu[10] a vanadu.[11]
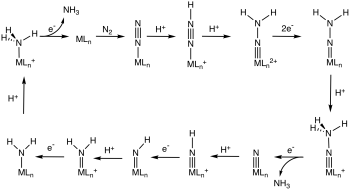
Výzkum těchto komplexních sloučenin se rozvíjí z těch důvodů, že N2 tvoří většinu atmosféry Země a že dusík je obsažen v mnoha významných sloučeninách. Biologická fixace dusíku probíhá pravděpodobně skrze navazování N2 na kovová centra nitrogenázových enzymů, po kterých následuje několik dalších kroků, jako jsou přenos elektronů a protonace.[12]
Vazby
Vazby v komplexech N2 jsou podobné jako u komplexů CO a acetylenu, protože všechny tyto molekuly obsahují trojné vazby; bylo nalezeno několik variant těchto vazeb. V závislosti na tom, zda molekuly N2 jsou nebo nejsou sdíleny dalšími dvěma kovovými centry, lze komplexy rozdělit na jednojaderné a můstkové. Podle geometrie mezi molekulami N2 a kovem se dají dělit na dvě skupiny, kde jedna má vektor N-N rovnoběžný s vazbami kov-ligand, zatímco u druhé je na ně kolmý.[13]
Jednojaderné s rovnoběžným vektorem N-N
Jako ligand se N2 obvykle na kovy, například v [Ru(NH3)5N2]2+, váže tak, že vektor N-N je rovnoběžný se směrem kov-ligand. Takové komplexy jsou často analogy karbonylů. Podobnost lze ukázat na Vaskově komplexu (IrCl(CO)(PPh3)2) a IrCl(N2)(PPh3)2.[14]
N2 u těchto komplexů funguje jako σ-donor i π-akceptor. Úhly vazeb M-N-N bývají blízko 180°.[2] N2 je slabším π-akceptorem než CO, což je způsobeno vlastnostmi π* orbitalů CO a N2. Z tohoto důvodu je znám jen malý počet sloučenin majících současně CO i N2 ligandy.
Komplexy přechodných kovů mohou obsahovat více didusíkových ligandů tohoto typu, jedním z takových je mer-[Mo(N2)3(PPrn2Ph)3], mající oktaedrickou geometrii.[15]
Didusíkový ligand u Mo(N2)2(Ph2PCH2CH2PPh2)2 je možné redukovat za vzniku amoniaku.[16] Řada nitrogenáz obsahuje atomy Mo a tak jsou častými předměty výzkumu Mo-N2 komplexy.
Můstkové s rovnoběžným vektorem N-N
N2 může také propojovat dva atomy kovu, například ve sloučenině {[Ru(NH3)5]2(μ-N2)}4+; tato a podobné koordinační sloučeniny se často označují jako vícejaderné komplexy didusíku. Na rozdíl od jednojaderných protějšků je lze připravit s rannými i pozdními přechodnými kovy.[2]
V roce 2006 byla vydána studie Fe-N2 komplexů ukazující, že vazby N–N jsou po komplexaci s atomy železa s nižšími koordinačními čísly významně zeslabené. Zkoumaný komplex obsahoval bidentátní chelatující ligandy napojené na atomy železa v Fe–N–N–Fe jádru, kde N2 tvoří můstek mezi dvojicí atomů železa. Navýšení koordinačního čísla železa úpravou chelatujících ligandů a přidáním jednoho ligandu na každý atom železa vedlo ke zvýšení síly vazeb N–N. Fe s nízkými koordinačními čísly má velký význam při fixaci dusíku nitrogenázami, protože jejich Fe–Mo kofaktory také obsahují Fe s nízkými koordinačními čísly.[17]
Průměrná délka vazeb těchto komplexů je okolo 120 pm., někdy však může činit až 140 pm, což je hodnota podobná běžným jednoduchým vazbám N-N.[18]
Jednojaderné s kolmým vektorem N-N
Tako skupina komplexů se oproti těm s rovnoběžnými vektory N-N vyznačuje vyšší energií a také je vzácnější. Didusík je zde π-donorem. Byl připraven komplex tohoto druhu s N2 navázaným na jedno kovové centrum ve fotoindukovaném metastabilním stavu. Po vystavení ultrafialovému záření lze komplex [Os(NH3)5(N2)]2+, v pevném skupenství převést na metastabilní [Os(NH3)5(η2-N2)]2+, u kterého jsou vibrace didusíku posunuty z 2025 na 1831 cm−1.
Několik dalších takových komplexů existuje v podobě přechodných stavů při vnitromolekulárních izomerizacích. John N. Armor a Henry Taube objevili tyto izomerizace prostřednictvím didusíkových ligandů značkovaných 15N.[19]
Můstkové s kolmým vektorem N-N
Jsou také známé můstkové komplexy, ve kterých je vektor N-N kolmý na vektor kov-ligand, například [(η5-C5Me4H)2Zr]2(μ2,η2,η2-N2).[20] Tento komplex může reagovat s vodíkem a lze s ním dosáhnou fixace dusíku redukcí N2;[21] ten lze redukovat také obdobným ditantalovým tetrahydridovým komplexem.[22]
Reakce
Štěpení na nitridy
Tvorba nitridokomplexů z dusíku probíhá přes didusíkové komplexy. Štěpit dusík mohou i některé molybdenité komplexy:[23]
- 2 Mo(NR2)3 + N2 → (R2N)3Mo-N2-Mo(NR2)3
- (R2N)3Mo-N2-Mo(NR2)3 → 2 N≡Mo(NR2)3
Elektrofilní ataky
Některé didusíkové komplexy bohaté na elektrony mohou být, na atomech dusíku, atakovány elektrofily. Reakce, kde je elektrofilem proton, se zkoumají pro možné využití k nebiologické fixaci dusíku.
Některé komplexy N2 jsou dokonce schopny katalyzovat jeho hydrogenaci na amoniak skrz N-protonaci redukovaného komplexu M-N2.[24][25]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Transition metal dinitrogen complex na anglické Wikipedii.
Související články
- Nebiologická fixace dusíku
- Nitridokomplexy kovů