MALDI
Matricí asistovaná laserová desorpce/ionizace (zkráceně MALDI) je metoda ionizace, při které se využívá matrice absorbující energii laseru k tvorbě iontů z velkých molekul za minimální fragmentace.[1] Používá se na analýzu biomolekul, například DNA, bílkovin, peptidů a sacharidů) a velkých organických molekul, jako jsou polymery a dendrimery, které jsou nestabilní a při použití jiných způsobů ionizace u nich dochází k fragmentaci. Podobá se elektrosprejové ionizaci (ESI) tím, že u obou metod je nízká míra fragmentace, a také způsobem tvorby iontů z velkých molekul v plynné fázi, u MALDI obvykle vzniká méně iontů s vícenásobnými náboji.

Provedení MALDI se skládá ze tří kroků. Nejprve se vzorek smíchá s vhodnou látkou nebo směsí tvořící matrici a aplikuje na kovovou destičku. Poté se vzorek ozáří pulzním laserem, čímž se vyvolá ablaci a desorpci vzorku a matrice. Nakonec se molekuly analytu ionizují protonací nebo deprotonací v proudu horkých ablatovaných plynů a analyzují hmotnostním spektrometrem.[2]
Historie
Označení matricí asistovaná laserová desorpce/ionizace (MALDI) se začalo používat v roce 1985.[3] Franz Hillenkamp, Michael Karas a další zjistili, že aminokyselina alanin může být snadněji ionizována, jestliže je smíchána s tryptofanem a ozářena pulzním 266nm laserem. Tryptofan pohlcuje energii laseru a usnadňuje ionizaci neabsorbujícího alaninu. Tímto způsobem lze ionizovat peptidy s molekulovou hmotností až 2843 Da, jako je například melitin.[4] V roce 1987 Kóiči Tanaka se svými spolupracovníky použil metodu „ultratenkého kovu a kapalné matrice“ kombinující 30nm částice kobaltu v glycerolu s 337nm dusíkovým laserem.[5] Touto metodou mohou být ionizovány biomolekuly s molekulovými hmotnostmi až 34 472 Da, což je například karboxypeptidáza A. Tanaka se v roce 2002 stal spoludržitelem Nobelovy ceny za chemii díky tomu, že ukázal, že vhodnou kombinací vlnové délky laseru a složení matrice lze ionizovat bílkoviny.[6] Karas a Hillenkamp následně dokázali ionizovat 67kDa bílkovinu albumin pomocí matrice z kyseliny nikotinové a 266nm laseru.[7]
Dalších pokroků bylo dosaženo pomocí 355nm laseru a matric obsahujících deriváty kyseliny skořicové, kterými byly kyselina ferulová, kyselina kávová a kyselina sinapová.[8] Dostupnost malých a nepříliš nákladných dusíkových laserů poskytujících záření s vlnovou délkou 337 nm a první přístroje uvedené na trh začátkem 90. let 20. století umožnily větší využití MALDI ve výzkumu.[9] V současnosti se nejčastěji používají organické matrice.
Matrice
| Sloučenina | Ostatní názvy | Rozpouštědlo | Vlnová délka (nm) | Použití |
|---|---|---|---|---|
| kyselina 2,5-dihydroxybenzoová[10] | DHB, kyselina gentisová | acetonitril, voda, methanol, aceton, chloroform | 337, 355, 266 | peptidy, nukleotidy, oligonukleotidy, oligosacharidy |
| kyselina 3,5-dimethoxy-4-hydroxyskořicová[8][11] | kyselina sinapová | acetonitril, voda, aceton, chloroform | 337, 355, 266 | peptidy, bílkoviny, lipidy |
| kyselina 4-hydroxy-3-methoxyskořicová[8][11] | kyselina ferulová | acetonitril, voda, propanol | 337, 355, 266 | bílkoviny |
| kyselina α-kyano-4-hydroxyskořicová[12] | acetonitril, voda, ethanol, aceton | 337, 355 | peptidy, lipidy, nukleotidy | |
| Kyselina pikolinová[13] | ethanol | 266 | oligonukleotidy | |
| kyselina 3-hydroxypikolinová[14] | ethanol | 337, 355 | oligonukleotidy |
Matrice obsahuje krystalizované molekuly, nejčastěji se používají kyselina sinapová, alfa-kyano-4-hydroxyskořicová a 2,5-dihydroxybenzoová.[15] Roztok jedné ze tří uvedených sloučenin se obvykle připravuje z ultračisté vody a organického rozpouštědla, jakým je například acetonitril nebo ethanol. Často se do roztoku přidává zdroj [M+H] protiiontů, například kyselina trifluoroctová. A Příkladem roztoku může být 20 mg/ml kyseliny sinapové ve směsi acetonitrilu, vody a kyseliny trifluoroctové v poměru 50:50:0,1.

Hledání vhodných složek matrice je často založeno na pokusu a omylu, ovšem s uvážením potřeby určitých vlastností molekul. Ty by měly mít nižší molekulové hmotnosti (aby se snadno odpařovaly) ale měly by být dostatečně velké (a tedy mít nízký tlak syté páry), aby se nevypařovaly během přípravy vzorku. Často jde o kyseliny, takže se deprotonizují a tím pomáhají ionizovat analyt. Byly však popsány i zásadité matrice.[16] Matrice by měly vykazovat silnou absorpci v ultrafialové nebo infračervené oblasti,[17] aby rychle a účinně zachycovaly laserové paprsky. Taková absorpce se většinou vyskytuje u sloučenin, jejichž molekuly obsahují konjugované systémy dvojných vazeb, jaké má například kyselina skořicová. Na tyto systémy bývají navázány polární skupiny, díky kterým lze dané látky použít ve vodných roztocích. Často obsahují chromoforové skupiny.
Roztok matrice se smíchá s analytem. Voda s organickým rozpouštědlem umožní rozpuštění hydrofobním i hydrofilním) molekulám. Připravený roztok se aplikuje na MALDI destičku (která je obvykle kovová). Rozpouštědlo se odpaří a zbude jen rekrystalizovaná matrice, ve které se nacházejí molekuly analytu, dochází tedy ke okrystalizaci. Kokrystalizace je jedním z důležitých hledisek při výběru matrice, protože vhodná matrice umožňuje získat dobré spektrum zkoumaného analytu.
Při analýze biologických systémů anorganické soli, které také bývají obsaženy v bílkovinných extraktech, narušují ionizaci. Odstraněny mohou extrakcí v pevné fázi nebo vymytím chladnou vodou;[18] tyto postupy je možné použít i k odstranění ostatních látek ze vzorku. Směs matrice a proteinu není homogenní, protože rozdíly v polaritě způsobují oddělování obou složek během kokrystalizace.
Matrici lze použít k tomu, aby k ionizaci docházelo různými způsoby. K ionizaci se, jak je uvedeno výše, nejčastěji používají acidobazické reakce, molekuly s konjugovanými pí systémy, například naftaleny, také mohou fungovat jako akceptory elektronů a tak být použity jako matrice pro MALDI/TOF.[19] Tato vlastnost je výhodná při analýze molekul, které také obsahují konjugované pí systémy.[20] Nejvíce se takovéto matrice používají při zkoumání porfyrinových sloučenin, jako jsou chlorofyly. Mají lepší ionizační vlastnosti a neobjevují se u nich nevhodné způsoby fragmentace nebo dokonce ztráty postranních řetězců.[21] Konjugované porfyriny mohou být použity samy o sobě jako matrice, díky čemuž není nutné používat zvláštní sloučeniny na přípravu matric.[22]
Přístroje
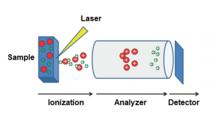
Existuje několik variant MALDI přístrojů; podobná zařízení mohou být použita k odlišným účelům. Hmotnostní spektrometrie se vyvinula do podoby hmotnostní spektrometrie s velmi vysokým rozlišením, jako jsou FT-ICR[23][24] a další.[25] Mnoho MALDI-MS lze zakoupit s výměnným ionizátorem (například elektrosprejovým, MALDI nebo APCI), a tak mohou být použity i měkké ionizační metody.
Laser
MALDI metody obvykle zahrnují použití ultrafialových laserů, například dusíkových (337 nm) a Nd:YAG laserů (355 nebo 266 nm).[26]
Infračervené lasery používané s MALDI mívají vlnové délky 2,94 μm (Er:YAG laser) a 10,6 μm CO2 laser. Infračervené lasery nejsou běžné; používají se díky nižší míře fragmentace při ionizaci.[27]
Infračervená MALDI se rovněž vyznačuje lepším odstraňováním materiálu (což je výhodné u biologických vzorků), menším nízkohmotnostním rušením a kompatibilitou s bezmatricovými laserově desorpčními metodami hmotnostní spektrometrie.
Spektrometr

Na MALDI nejčastěji napojovaným druhem hmotnostního spektrometru je hmotnostní spektrometr doby letu (TOF-MS), protože jej lze použít v širokém rozmezí molekulových hmotností. TOF se nejlépe hodí k MALDI, protože pulzní laser vypouští jednotlivé dávky záření namísto souvislého proudu. MALDI-TOF přístroje často mají reflektron („iontové zrcadlo“), který odráží ionty pomocí elektrického pole, čímž se prodlužuje dráha iontů a tím i rozdíl časů letu u iontů s rozdílnými hodnotami m/z a dochází i k vylepšení rozlišení. Moderní reflektronové TOF přístroje dosahují rozlišení m/Δm 50 000 FWHM a někdy i vyššího.[28]
MALDI je také možné použít jako zdroj iontů pro IMS-TOF MS k identifikaci fosforylovaných a nefosforylovaných peptidů.[29][30]
MALDI-FT-ICR MS je také vhodnou metodou tam, kde je potřeba vysoké rozlišení MALDI-MS analýz.[31]
MALDI za atmosférického tlaku
Matricí asistovaná laserová desorpce/ionizace za atmosférického tlaku (AP-MALDI) ke metoda ionizace, která je protipólem vakuové MALDI fungujícím za atmosférického tlaku.[32]
Hlavním rozdílem mezi vakuovou a AP-MALDI je tlak v prostředí, ve kterém se tvoří ionty. Při vakuové MALDI ionty vznikají za tlaků kolem 1 Pa i nižších, zatímco u AP-MALDI za atmosférického tlaku. V minulosti měl tento postup nevýhodu oproti vakuové MALDI v podobě nízké citlivosti; ionty ovšem lze přemístit do hmotnostního spektrometru a byly popsány meze detekce v řádu attomolů.[33] AP-MALDI MS má využití v mnoha oblastech od proteomiky přes analýzu DNA, RNA, PNA, lipidů, oligosacharidů, fosfopeptidů, bakterií, malých molekul a syntetických polymerů k vývoji léčiv; podobné využití nacházejí také vakuové MALDI přístroje. AP-MALDI iontový zdroj lze lehce spojit s hmotnostní spektrometrií iontové pasti[34] nebo ESI.
Aerosolová MALDI
Při aerosolové hmotnostní spektrometrii laserové paprsky ionizují jednotlivé kapky vzorku; odpovídající přístroje se nazývají jednočásticové hmotnostní spektrometry.[35] Do vzorku lze před aerosolizací přidat MALDI matrici.
Mechanismus ionizace
Laserové paprsky dopadají na krystaly matrice v kapce. Matrice pohlcuje energii laseru a dochází k desorpci a ionizaci. Vytvořená mlha obsahuje neutrální, ionizované, protonované i deprotonované molekuly matrice a nanokapky. Tyto částice se podílí na ionizaci analytu, přesná podoba mechanismu však není známa. Následně matrice předává protony molekulám analytu (například bílkoviny), čímž mu dodává elektrický náboj.[36] Ionty pozorované po tomto procesu jsou původní molekuly [M], u kterých došlo k odštěpení nebo zachycení iontu. MALDI umožňuje tvorbu iontů s jednoduchými i vícenásobnými náboji ([M+nH]n+), a to v závislosti na vlastnostech matrice, vydatnosti laseru a použitém napětí.
Model přenosu protonů v plynné fázi,[2] zavedený jako fyzikálně-chemický model,[37] zahrnuje primární i sekundární ionizační jevy.[36]
Primární procesy spočívají v oddělení náboje absorpcí fotonů v matrici a uvolněném energie za vzniku matricových iontových párů. Primární tvorba iontů probíhá skrz absorbování ultrafialových fotonů a vytváření excitovaných molekul podle těchto rovnic:
- S0 + hν → S1
- S1 + S1 → S0 + Sn
- S1 + Sn → M+ + M−
kde S0 je základní stav, S1 první excitovaný stav a Sn vyšší excitovaný stav.[37] Ionty mohou vznikat přesunem protonů nebo elektronů, což je vyjádřeno symboly M+ a M−. K sekundárním dějům patří reakce iontů a molekul za tvorby iontů analytu.
Podle tepelného modelu vysoké teploty vyvolávají přenos protonů mezi matricí a analytem v kapalné matrici.[38] Důležitým parametrem ověřujícím správnost modelu je poměr množství iontů a neutrálních molekul, chyba v určení tohoto poměru může vést k nesprávnému určení mechanismu ionizace.[39] Model předpovídá nárůst iontové intenzity s koncentrací, protonovou afinitou analytů, a frekvence laserových záblesků.[40][41] Podle tohoto modelu se adukty kovových iontů (například [M+Na]+ nebo [M+K]+) tvoří převážně tepelně podněcovaným rozpouštěním solí.[42]
Při matricí asistované ionizaci (MAI) se připravuje matrice podobně jako u MALDI, ovšem k tvorbě iontů analytu není potřeba laserová ablace.[43] Samotným vystavením matrice a analytu vakuovému prostředí hmotnostního spektrometru vznikají ionty téměř stejné jako při elektrosprejové ionizaci.[44] Pravděpodobně existují mechanistické souvislosti mezi tímto procesem a MALDI.[45]
Výtěžnost iontů se obvykle pohybuje mezi 10−4 a 10−7,[46] přičemž při některých experimentech byly zjištěny i nižší hodnoty kolem 10−9,[47] přičemž již předtím byly provedeny pokusy o provedení dodatečné ionizace pomocí druhého laseru.[48] Většina těchto pokusů nebyla příliš úspěšná, což lze vysvětlit tak, že byly použity axiální TOF přístroje, ve kterých se tlak ve zdroji iontů pohybuje okolo 10−5 až 10−6, čímž dochází k prudké expanzi a vzestupu rychlosti částic až k 1000 m/s.[49]
Úspěchu bylo dosaženo v roce 2015 za použití pozměněného MALDI iontového zdroje s využitím vyššího tlaku (přibližně 300 Pa) spojeného s ortogonálním TOF hmotnostním spektrometrem, přičemž byl použit laditelný laser s vlnovými délkami od 260 do 280 nm, čímž se účinnost tvorby iontů v některých případech zvýšila o tři řády.[50] Tento postup byl následně použit i u ostatních druhů hmotnostních spektrometrů.[51][52]
Využití
Biochemie
V proteomice se MALDI používá k identifikaci bílkovin izolovaných pomocí gelové elektroforézy: SDS-PAGE, afinitní chromatografie, izotopového značkování bílkovin nebo dvourozměrné elektroforézy. MALDI TOF/TOF se používají k určení pořadí aminokyselin v peptidech pomocí vysokoenergetických disociací vyvolávaných srážkami.
Odštěpení sialových kyselin lze detekovat při použití kyseliny gentisové jako matrice při MALDI-MS analýze glykosylovaných peptidů. Pomocí matrice obsahující kyselinu sinapovou, 4-HCCA a kyseliny gentisové;[53] vyšší citlivosti lze dosáhnout amidací sialové kyseliny.[54] Přidáním iontové kapaliny do matrice se omezí ztráty sialových kyselin v průběhu MALDI/TOF-MS analýzy sialylovaných oligosacharidů.[55] 2,4,6-trihydroxyacetofenon (THAP),[56] dihydroxyacetonfosfát (DHAP)[57] a směs 2-aza-2-thiothyminu s fenylhydrazinem[58] luze použít na přípravu matricí omezujících ztráty sialových kyselin během MALDI-MS analýzy glykosylovaných peptidů.
Bylo popsáno omezení některých posttranslačních modifikací při použití infračervené MALDI namísto ultrafialové.[59] V molekulární biologii mohou být směsi kyseliny 5-methoxysalicylové a sperminu použity jako matrice k analýze oligonukleotidů pomocí MALDI hmotnostní spektrometrie.[60]
Organická chemie
Některé syntetické makromolekuly, jako jsou katenany a rotaxany, dendrimery a hyperrozvětvené polymery, mají molekulové hmotnosti v tisících až desetitisících Da a u většiny ionizačních metod je obtížné vytvořit z nich molekulární ionty. S využitím MALDI je možné snadno a rychle analyzovat tyto látky.
Polymery
V chemii polymerů lze MALDI použít k určení rozdělení molekulových hmotností.[61] Polymery s polydisperzitou nad 1,2 se pomocí MALDI zkoumají obtížně kvůli nižším intenzitám signálu oproti oligomerům s vyššími molekulovými hmotnostmi.[62][63][64] Na přípravu matric pro analýzu polymerů se hodí dithranol[65] a trifluoroctan stříbrný.[66] Do vzorku se nejprve přidá dithranol a poté trifluoroctan stříbrný, při opačném pořadí by se vzorek z roztoku vysrážel.
Mikrobiologie
MALDI-TOF spektra se mohou použít k určení mikroorganismů, jako jsou například bakterie. Část zkoumané kolonie mikroorganismů se umístí na destičku poro aplikaci vzorku a překryje matricí. Získaná hmotnostní spektra bílkovin se analyzují a porovnávají s databází profilů jednotlivých druhů. Tato metoda přináší výhody pro další imunologické či biochemické úkony a běžně se používá v klinických mikrobiologických laboratořích.[67][68] MALDI-MS s iontovou cyklotronovou rezonanční hmotnostní spektrometrií a Fourierovou transformací (zkráceně FT-MS) je možné použít k určování virů detekcí jednotlivých iontů.[69]
Oproti ostatním mikrobiologickým identifikačním metodám má MALDI-FT-MS výhodu v podobě rychlé a spolehlivé identifikace, nízkých nákladů a širokého rozmezí mikroorganismů, které lze určit.
Další výhodou je možnost předpovídat citlivost bakterií na antibiotika. Pomocí MALDI je možné předvídat odolnost bakterie Staphylococcus aureus vůči methicilinu[70] a také najít karbapenemázu u enterobakterií,[71] jako jsou například Acinetobacter baumannii[72] a Klebsiella pneumoniae.[73] Většina bílkovin ovládajících odolnost proti antibiotikům má ovšem molekulovou hmotnost mimo rozmezí 2 až 20 kDa, při níž lze analyzovat látky pomocí MALDI-TOF.[74]
Parazitologie
MALDI-TOF spektra se používají k detekci a určení různých parazitů, jako jsou trypanozomy,[75] Leishmania[76] a zimničky.[77] Kromě těchto jednobuněčných parazitů se MALDI/TOF také používá k určování mnohobuněčných parazitů, jako jsou vši[78] a cerkarie.[79]
Lékařství
MALDI/TOF se ve spojení s dalšími analytickými a spektroskopickými metodami k diagnostikování nemocí. MALDI/TOF umožňuje rychlou identifikaci bílkovin a s nimi souvisejících změn, a to při nižších nákladech než u sekvenování, a také při ní nejsou tolik potřeba výpočetní technika, dovednosti nebo čas jako při určování struktury pomocí rentgenové krystalografie.
Příkladem může být diagnostikování nekrotizující enterokolitidy (NEC), což je nemoc postihující střeva u dětí. Příznaky jsou podobné jako u sepse a mnoho dětí umírá kvůli příliš pozdnímu diagnostikování a léčení. MALDI/TOF lze použít k identifikaci bakterií ve výkalech dětí s NEC. Byla vydána studie zaměřená na characterizaci fekálího mikrobiomu spojeného s NEC.[80]
MALDI/TOF se také používá ke zjišťování odolnosti bakterií vůči léčivům, obzvláště β-laktamovým antibiotikům. MALDI/TOF může být použita k detekci karbapenemáz, které naznačují odolnost proti běžným antibiotikům. Tímto způsobem je možné prokázat odolnost bakterie proti léčivům do tří hodin. MALDI pomáhá rozhodnout o tom, zda mají být předepsána silnější antibiotika.[81]
Zkoumání proteinových komplexů
Po zjištění, že některé komplexy peptidů jsou odolné vůči depozici a ionizaci při MALDI[82] byly provedeny studie zabývající se analýzou proteinových komplexů pomocí MALDI-MS.[83][84]
Odkazy
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu MALDI na Wikimedia Commons
Obrázky, zvuky či videa k tématu MALDI na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Matrix-assisted laser desorption/ionization na anglické Wikipedii.
