Κυκλοπροπυλομεθυλαιθέρας
Ο κυκλοπροπυλομεθυλαιθέρας ή μεθυξυκυκλοπροπάνιο ή κυκλοπροπυλομεθυλοξείδιο είναι μια οργανική ένωση σύντομο συντακτικό τύπο  . Είναι ένας αιθέρας. Με βάση το χημικό τύπο C4H8Ο του έχει τα ακόλουθα εικοσιπέντε (25) ισομερή θέσης:
. Είναι ένας αιθέρας. Με βάση το χημικό τύπο C4H8Ο του έχει τα ακόλουθα εικοσιπέντε (25) ισομερή θέσης:
- Βουτεν-1-όλη-1 (ελάσσων ταυτομερές της βουτανάλης) με σύντομο συντακτικό τύπο CH3CH2CH=CHOH.
- Βουτεν-2-όλη-1 ή 3-μεθυλαλλυλική αλκοόλη με σύντομο συντακτικό τύπο CH3CH=CHCH2OH.
- Βουτεν-3-όλη-1 με σύντομο συντακτικό τύπο CH2=CHCH2CH2OH.
- Βουτεν-1-όλη-2 (ελάσσων ταυτομερές της βουτανόνης) με σύντομο συντακτικό τύπο CH3CH2C(OH)=CH2.
- Βουτεν-2-όλη-2 (ελάσσων ταυτομερές της βουτανόνης) με σύντομο συντακτικό τύπο CH3CH=C(OH)CH3.
- Βουτεν-3-όλη-2 με σύντομο συντακτικό τύπο CH2=CHCH(OH)CH3.
- Μεθυλοπροπεν-1-όλη (ελάσσων ταυτομερές της μεθυλοπροπανάλης) με σύντομο συντακτικό τύπο (CH3)2C=CHOH.
- Μεθυλοπροπεν-2-όλη ή 2-μεθυλαλλυλική αλκοόλη με σύντομο συντακτικό τύπο CH2=C(CH3)CH2OH.
- Αιθυλοβινυλαιθέρας ή αιθοξυαιθένιο με σύντομο συντακτικό τύπο CH3CH2OCH=CH2.
- Μεθυλοπροπεν-1-υλαιθέρας ή 1-μεθοξυπροπένιο με σύντομο συντακτικό τύπο CH3OCH=CHCH3.
- Μεθυλοπροπεν-2-υλαιθέρας ή 3-μεθοξυπροπένιο με σύντομο συντακτικό τύπο CH3OCH2CH=CH2.
- Μεθυλο(μεθυλοβινυλ)αιθέρας ή 2-μεθοξυπροπένιο με σύντομο συντακτικό τύπο CH3OC(CH3)=CH2.
- Βουτανάλη (κύριο ταυτομερές) της βουτεν-1-όλης-1 με σύντομο συντακτικό τύπο CH3CH2CH2CHO.
- Μεθυλοπροπανάλη (κύριο ταυτομερές) της μεθυλοπροπεν-1-όλης με σύντομο συντακτικό τύπο (CH3)2CHCHO.
- Βουτανόνη (κύριο ταυτομερές) της βουτεν-2-όλης-2 και της βουτεν-3-όλης-2) με σύντομο συντακτικό τύπο CH3CH2COCH3.
- Κυκλοβουτανόλη με σύντομο συντακτικό τύπο
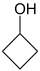 .
. - 1-μεθυλοκυκλοπροπανόλη με σύντομο συντακτικό τύπο
 .
. - 2-μεθυλοκυκλοπροπανόλη με σύντομο συντακτικό τύπο
 .
. - Κυκλοπροπυλομεθανόλη με σύντομο συντακτικό τύπο
 .
. - Οξολάνιο με σύντομο συντακτικό τύπο
 .
. - 2-μεθυλοξετάνιο με σύντομο συντακτικό τύπο
 .
. - 3-μεθυλοξετάνιο με σύντομο συντακτικό τύπο
 .
. - Αιθυλοξιράνιο με σύντομο συντακτικό τύπο
 .
. - 2,2-διμεθυλοξιράνιο με σύντομο συντακτικό τύπο
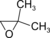 .
. - 2,3-διμεθυλοξιράνιο με σύντομο συντακτικό τύπο
 .
.
| Κυκλοπροπυλομεθυλαιθέρας | |
|---|---|
 | |
| Γενικά | |
| Όνομα IUPAC | μεθοξυκυκλοπροπάνιο |
| Άλλες ονομασίες | Κυκλοπροπυλομεθυλαιθέρας κυκλοπροπυλομεθυλοξείδιο-1 |
| Χημικά αναγνωριστικά | |
| Χημικός τύπος | C4H8O |
| Μοριακή μάζα | 72,11amu[1] |
| Σύντομος συντακτικός τύπος |  |
| SMILES | COC1CC1 |
| Ισομέρεια | |
| Ισομερή θέσης | 25 |
| Φυσικές ιδιότητες | |
| Χημικές ιδιότητες | |
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |
Κυκλοπροπάνια
«Κυκλοπροπάνια» ονομάζονται τα κυκλοαλκάνια με τριμελή δακτύλιο, που αποτελεί και το χαρακτηριστικό της δομής τους. Οι πλευρικές αλυσίδες, όταν υπάρχουν, διαμορφώνονται όπως στα αλκάνια. Το ιδιαίτερο χαρακτηριστικό της μοριακής δομής τους είναι η εμφάνιση γωνίας δεσμού 
Εξαιτίας αυτού του γεγονότος προκύπτει η λεγόμενη «ενέργεια τάσης δεσμών» που συνυπολογίζει την ενέργεια παραμόρφωσης δεσμικής γωνίας (κατά Baeyer), που οφείλεται στη διαφορά γωνίας από την κανονική, και την ενέργεια στρέψης (κατά Piltzer), που οφείλεται στην αδυναμία του συστήματος να στρέψει τους δεσμούς του και να πάρει διαμόρρφωση αποφυγής των απώσεων τύπου Van der Waals, που αναπτύσσονται από την προσέγγιση αλληλοαπωθούμενων ατόμων και ομάδων αυτών. Ενώ λοιπόν το ισομερές προπένιο έχει θερμότητα ολικής καύσης 1.971 kcal/mole το κυκλοπροπάνιο έχει 2.088 kcal/mole. Το ΔQ = 117 kJ/mole αντιστοιχεί ακριβώς στην επιπλέον ενέργεια που παγιδεύει η ιδιάζουσα δομή του τριμελή δακτυλίου[3].Αποτέλεσμα των παραπάνω είναι τα κυκλοπροπάνια (και τα υποκατεστημένα παράγωγά τους) να δείνουν αντιδράσεις προσθηκοδιάσπασης-1,3.
Παραγωγή
Από (2-αλο-1-αλομεθυλο)μεθυλαιθέρα
Με επίδραση ψευδαργύρου σε (2-αλο-1-αλομεθυλο)μεθυλαιθέρα παράγεται κυκλοπροπυλομεθυλαιθέρας, με ενδομοριακή αντίδραση Wurtz [4]:
Από βινυλομεθυλαιθέρα και μεθυλενοδιιωδίδιο
- Με επίδραση μεθυλενοδιιωδίδιου και ψευδαργύρου σε βινυλομεθυλαιθέρα παράγεται κυκλοπροπυλομεθυλαιθέρας[5]:
Με αλκυλίωση αλκοολικού άλατος
Ακόμη, μπορεί να παραχθεί με κυκλοπροπυλίωση μεθανολικού άλατος (π.χ. CH3ONa) με κυκλοπροπυλαλογονίδιο ή μεθυλίωση κυκλοπροπανολικού άλατος με μεθυλαλογονίδιο (CH3X) [6]:
Αναφορές και σημειώσεις
Πηγές
- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Δημήτριου Ν. Νικολαΐδη: Ειδικά μαθήματα Οργανικής Χημείας, Θεσσαλονίκη 1983.










