Νιτρώδης μεθυλεστέρας
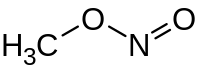
Ο νιτρώδης μεθυλεστέρας (αγγλικά: methyl nitrite) είναι οργανική χημική ένωση, που περιέχει άνθρακα, υδρογόνο, άζωτο και οξυγόνο, με μοριακό τύπο CH3NΟ2. Στις κανονικές συνθήκες περιβάλλοντος, είναι ένα αέριο. Χημικά, αποτελεί τον απλούστερο εστέρα του νιτρώδους οξέος.
| Νιτρώδης μεθυλεστέρας | |||
|---|---|---|---|
 | |||
 | |||
 | |||
| Γενικά | |||
| Όνομα IUPAC | Νιτρώδης μεθυλεστέρας | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | CH3NΟ2 | ||
| Μοριακή μάζα | 61,04 amu | ||
| Σύντομος συντακτικός τύπος | CH3ONΟ | ||
| Αριθμός CAS | 624-91-9 | ||
| SMILES | O=NOC | ||
| InChI | 1S/CH3NO2/c1-4-2-3/h1H3 | ||
| ChemSpider ID | 11730 | ||
| Δομή | |||
| Ισομέρεια | |||
| Ισομερή θέσης | 12 | ||
| Γεωμετρικά ισομερή | 2 | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | −16°C | ||
| Σημείο βρασμού | −12°C | ||
| Χημικές ιδιότητες | |||
| Επικινδυνότητα | |||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Δομή
Σε θερμοκρασία δωματίου, ο νιτρικός μεθυλεστέρας υπάρχει ως ένα μίγμα και των cis- και trans- συμορφών. Η cis συμορφή είναι κατά 3,13 kJ mol-1 πιο σταθερή από την trans συμορφή, με ενεργειακό φράγμα περιστροφής του 45,3 kJ mol-1.[1] Οι cis- και trans- δομές έχουν επίσης προσδιοριστεί με φασματοσκοπία μικροκυμάτων (δείτε παρακάτω τις εξωτερικές συνδέσεις).
 |  |
Σύνθεση
Ο νιτρώδης μεθυλεστέρας μπορεί να παραχθεί με αντίδραση νιτρώδους αργύρου (AgNO2) και ιωδομεθάνιου (CH3I). Ο νιτρώδης άργυρος υπάρχει σε μορφή υδατικού διαλύματος, στο οποίο συνυπάρχουν κατιόντα Ag+ και ανιόντα NO2-. Ένα από τα μονήρη ηλεκτρονιακά ζεύγη ενός ατόμου οξυγόνου του νιτρώδους ανιόντος προσβάλλει τη μεθυλομάδα του ιωδομεθανίου, απελευθερώνοντας ανιόντα I- στο διάλυμα[2]. Αντίθετα από τον ευδιάλυτο στο νερό νιτρώδη άργυρο, ο ιωδιούχος άργυρος (AgI), που σχηματίζεται μετά την αντίδραση, είναι πολύ δυσδιάλυτη στο νερό ένωση, οπότε καθιζάνει ως κίτρινο στερεό.[3] Σημειώστε, όμως, ότι επειδή το άζωτο είναι καλύτερο πυρηνόφιλο από το οξυγόνο, οπότε, αν γίνει αντίδραση μέσω του μηχανισμού SΝ2, το κύριο προϊόν της παραπάνω αντίδρασης θα είναι το νιτρομεθάνιο (CH3NO2). ΄Ετσι, αν χρησιμοποιηθούν διαλύματα νιτρώδους νατρίου (NaNO2) ή νιτρώδους καλίου (KNO2) για να αντιδράσουν με το ιωδομεθάνιο, το κύριο προϊόν θα είναι νιτρομεθάνιο, με το νιτρώδη μεθυλεστέρα ως δευτερεύον υποπροϊόν. Ωστόσο, η παρουσία του κατιόντος αργύρου στο διάλυμα σταθεροποιεί τον ενδιάμεσο σχηματισμό καρβοκατιόντος (CH3+), αυξάνοντας έτσι την απόδοση σε νιτρώδη μεθυλεστέρα. Σε κάθε περίπτωση, και τα δυο ισομερή σχηματίζονται:[4]

Η ύπαρξη και των δυο αερίων ισομερών στο μείγμα της αντίδρασης αποδεικνύεται και με φασματοσκοπία υπερύθρου και με φασματοσκοπία μικροκυμάτων.
Ο νιτρώδης μεθυλεστέρας είναι ένα παραπροϊόν της καύσης αμόλυβδης βενζίνης και ίσως αυτό να αποτελεί μια από τις αιτίες μείωσης του αριθμού των εντόμων, και κατά συνέπεια και των σπουργιτών και άλλων ωδικών πτηνών στην Ευρώπη.[5]
Δείτε επίσης
- Νιτρομεθάνιο
- Οργανική χημεία
- Πυρηνόφιλη υποκατάσταση
Πηγές
- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, Οργανική Χημεία, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
Εξωτερικοί σύνδεσμοι
Σημειώσεις και παραπομπές
| Στο λήμμα αυτό έχει ενσωματωθεί κείμενο από το λήμμα Methyl nitrite της Αγγλικής Βικιπαίδειας, η οποία διανέμεται υπό την GNU FDL και την CC-BY-SA 4.0. (ιστορικό/συντάκτες). |