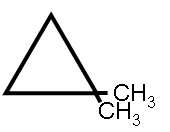
1,1-διμεθυλοκυκλοπροπάνιο
Το 1,1-διμεθυλοκυκλοπροπάνιο (αγγλικά 1,1-Dimethylcyclopropane) είναι οργανική χημική ένωση, που περιέχει άνθρακα και υδρογόνο, δηλαδή είναι υδρογονάνθρακας, με μοριακό τύπο C5H10 ή πιο αναλυτικά 1,1-(CH3)2(C3H4). Πιο συγκεκριμένα, είναι ένας αλεικυκλικός υδρογονάνθρακας. Δομικά αποτελείται από έναν κυκλοπροπανικό δακτύλιο (δηλαδή ανήκει στα «θυγατρικά» κυκλοπροπάνια) και από δύο (2) μεθυλομάδες (CH3-), ενωμένες και οι δύο στο ίδιο (#1) κυκλοπροπανικό άτομο άνθρακα. Το 1,1-διμεθυλοκυκλοπροπάνιο ανήκει στην ομόλογη σειρά των κυκλοαλκανίων, δηλαδή των κορεσμένων υδρογονανθράκων με έναν (τουλάχιστον) δακτύλιο.
| 1,1-διμεθυλοκυκλοπροπάνιο | |||
|---|---|---|---|
 | |||
| Γενικά | |||
| Όνομα IUPAC | 1,1-διμεθυλοκυκλοπροπάνιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C5H10 | ||
| Μοριακή μάζα | 70,1 amu | ||
| Σύντομος συντακτικός τύπος |  | ||
| Αριθμός CAS | 1630-94-0 | ||
| SMILES | CC1(C)CC1 | ||
| Δομή | |||
| Μοριακή γεωμετρία | Τα ανθρακοάτομα του δακτυλίου σε επίπεδη τριγωνική θέση. | ||
| Ισομέρεια | |||
| Ισομερή θέσης | 9 | ||
| Φυσικές ιδιότητες | |||
| Σημείο βρασμού | 20,6°C | ||
| Πυκνότητα | 765 kg/m³ (υγρό) | ||
| Εμφάνιση | Άχρωμο αέριο | ||
| Χημικές ιδιότητες | |||
| Θερμότητα πλήρους καύσης | 3.402 kJ/mole | ||
| Επικινδυνότητα | |||
 | |||
| Εξαιρετικά εύφλεκτο (F+) | |||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Παρασκευές
Ενδομοριακή αντίδραση Freund
Με την τροποποιημένη αντίδραση Φρέουντ (Freund reaction) με Zn, που δίνει μεγαλύτερη απόδοση στην ενδομοριακή αντίδραση. Σ' αυτήν την περίπτωση η στοιχειομετρική εξίσωση της αντίδρασης γίνεται[1][2]:
Η απόδοση είναι μέτρια, γιατί παράλληλα με την ενδομοριακή αντίδραση διεξάγεται αναπόφευκτα και διαμοριακή, τα κύρια προϊόντα της οποίας είναι τα ακόλουθα δύο (2):
- 2,7-διβρωμο-2,7-διμεθυλοκτάνιο [(CH3)2CBrCH2CH2CH2CH2CBr(CH3)2].
- 1,6-διβρωμο-3,3,6-τριμεθυλεπτάνιο [(CH3)2CBrCH2CH2C(CH3)2CH2CH2Br].
- Το 1,6-διβρωμο-3,3,4,4-τετραμεθυλεξάνιο [BrCH2CH2C(CH3)2C(CH3)2CH2CH2Br] δε σχηματίζεται, εξαιτίας στερεοχημικής παρεμπόδισης.
Με χρήση καρβενίου
Με προσθήκη μεθυλενίου σε μεθυλοπροπένιο και χρήση συστήματος διωδομεθάνιου (ZnI2), ψευδαργύρου (Zn) και χαλκού (Cu) (ο τελευταίος ως καταλύτης)[3]:
Χημικές ιδιότητες
Οξείδωση
1. Όπως όλα τα κυκλοαλκάνια, το 1,1-διμεθυλοκυκλοπροπάνιο με περίσσεια οξυγόνου καίγεται προς διοξείδιο του άνθρακα (CO2) και νερό (H2O) [4][5]:
- Αν και η αντίδραση είναι έντονα εξώθερμη δεν συμβαίνει σε μέτριες θερμοκρασίες, γιατί για την έναρξή της πρέπει να υπερπηδηθεί πρώτα το εμπόδιο της διάσπασης των δεσμών C-C[6], των δεσμών C-H[7] και των δεσμών (Ο=Ο)[8] του O2.
- Στην αναφερόμενη θερμότητα καύσεως εμπεριέχεται και η χημική ενέργεια που έχει αποθηκευθεί ως ενέργεια παραμόρφωσης κατά το σχηματισμό του τριμελούς δακτυλίου και απελευθερώνεται με την καύση. Η ενέργεια αυτή για τριμελή ισοκυκλικό ανθρακούχο δακτύλιο υπολογίστηκε, όπως αναφέρεται στο κυκλοπροπάνιο, σε 117 kJ/mole.
2. Παραγωγή υδραερίου:
3. Καταλυτική οξυγόνωση:
- α. Προς 2,2-διμεθυλοκυκλοπροπανόνη:
- β. Με πιο έντονες οξειδωτικές συνθήκες δίνει (κυρίως) 2,2-διμεθυλοξετάνιο:
Αλογόνωση
1. Φωτοχημική αλογόνωση υποκατάστασης υδρογόνου: Το 1,1-διμεθυλοκυκλοπροπάνιο έχει 10 άτομα υδρογόνου για φωτοχημική αντικατάσταση από αλογόνα, οπότε προκύπτουν τα ακόλουθα δύο (2) ισομερή αλογονοπαράγωγα[9]:
- Δραστικότητα των X2: F2 > Cl2 > Br2 > Ι2.
- όπου 0<x<1, διαφέρει ανάλογα με το αλογόνο:
- Δηλαδή το μίγμα που προκύπτει είναι: 71,7% 2,2-διμεθυλο-1-χλωροκυκλοπροπάνιο και 28,3% 1-μεθυλοκυκλοπροπυλο)μεθυλοχλωρίδιο.
- Δηλαδή το μίγμα που προκύπτει είναι: 98,2 1-βρωμο-2,2-διμεθυλοκυκλοπροπάνιο και 1,8% 1-μεθυλοκυκλοπροπυλο)μεθυλοβρωμίδιο.
- Ανάλυση του μηχανισμού της χλωρίωσης του (
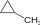 ):
): - 1. Έναρξη: Παράγονται ελεύθερες ρίζες.

- Η απαιτούμενη ενέργεια προέρχεται από την υπεριώδη κτινοβολία (UV) ή θερμότητα (Δ).
- 2. Διάδοση: Καταναλώνονται οι παλαιές ελεύθερες ρίζες, σχηματίζοντας νέες.
- 3. Τερματισμός: Καταναλώνονται μεταξύ τους οι ελεύθερες ρίζες, κατά τη στατιστικά σπάνια περίπτωση της συνάντησής τους.
- Είναι όμως πρακτικά δύσκολο να σταματήσει η αντίδραση στην παραγωγή μονοααλογονιδίων.
- Αν χρησιμοποιηθούν ισομοριακές ποσότητες
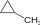 και Χ2 θα παραχθεί μίγμα όλων των αλογονοπαραγώγων του
και Χ2 θα παραχθεί μίγμα όλων των αλογονοπαραγώγων του 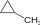 .
. - Αν όμως χρησιμοποιηθει περίσσεια
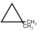 , τότε η απόδοση των μονοπαραγώγων αυξάνεται πολύ, λόγω της αύξησης της στατιστικής πιθανότητας συνάντησης
, τότε η απόδοση των μονοπαραγώγων αυξάνεται πολύ, λόγω της αύξησης της στατιστικής πιθανότητας συνάντησης  με X. σε σχέση με την πιθανότητα συνάντισης μονοπαραγώγου και X., που μπορεί να οδηγήσει στην παραγωγή των υπόλοιπων X-παραγώγων.
με X. σε σχέση με την πιθανότητα συνάντισης μονοπαραγώγου και X., που μπορεί να οδηγήσει στην παραγωγή των υπόλοιπων X-παραγώγων.
- Αν χρησιμοποιηθούν ισομοριακές ποσότητες
- Είναι όμως πρακτικά δύσκολο να σταματήσει η αντίδραση στην παραγωγή μονοααλογονιδίων.
2. Με διαλογόνωση-1,3 παράγεται (κυρίως) 1,3-διαλο-2-μεθυλοβουτάνιο:
Επίδραση καρβενίων
- Η αντίδραση είναι ελάχιστα εκλεκτική και αυτό σημαίνει ότι κατά προσέγγιση έχουμε:
- 1. Παρεμβολή στους έξι (6) δεσμούς CH2-H: 6.
- 2. Παρεμβολή στους τέσσερεις (4) δεσμούς CH-H: 4.
Προκύπτει επομένως μίγμα 1,1,2-τριμεθυλοκυκλοπροπάνιου ~40% και 1-αιθυλο-1-μεθυλοκυκλοπροπάνιου 60%.
Νίτρωση
όπου 0<x<1.
Καταλυτική υδρογόνωση-1,3
Με καταλυτική υδρογόνωση - Παράγεται (κυρίως) μεθυλοβουτάνιο:
Υδραλογόνωση-1,3
Με υδραλογόνο (ΗΧ) - Παράγεται (κυρίως) 2-αλο-2-μεθυλοβουτάνιο:
Υδροξυαλογόνωση-1,3
Με υπαλογονώδες οξύ (HOX) - Παράγεται (κυρίως) 4-αλο-2-μεθυλο-2-βουτανόλη:
Η παραπάνω αντίδραση, ισχύει όταν X = Cl, Br ή I. Στην περίπτωση του υποφθοριώδους οξέος (HOF), παράγεται κυρίως 3-μεθυλο-3-φθορο-1-βουτανόλη:
Ενυδάτωση-1,3
Με επίδραση θειικού οξέος σε 1,1-διμεθυλοκυκλοπροπάνιo (κυρίως) όξινος θειικός 2-μεθυλο-2-βουτυλεστέρας [CH3CH2C(SO4H)(CH3)2], που υδρολύεται σχηματίζοντας 2-μεθυλο-2-βουτανόλη:
Διυδροξυλίωση-1,3
Με επίδραση υπεροξειδίου του υδρογόνου (H2O2) σε 1,1-διμεθυλοκυκλοπροπάνιo, παρουσία καρβοξυλικών οξέων παράγεται (κυρίως) 3-μεθυλο-1,3-βουτανoδιόλη:
Πηγές
- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- [1]