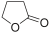Κροτονικό οξύ
Το κροτονικό οξύ[2] (αγγλικά crotonic acid) είναι οργανική χημική ένωση με μοριακό τύπο C4H6O2, αν και συνηθέστερα παριστάνεται με τον ημισυντακτικό του τύπο, E-CH3CH=CHCO2H. Έχει ένα γεωμετρικό ισομερές, το ισοκροτονικό οξύ, που αποτελεί το Z-2-βουτενικό οξύ. Η ονομασία «κροτονικό οξύ» προέρχεται από το κροτονέλαιο, επειδή πιστεύονταν (εσφαλμένα) ότι αποτελεί προϊόν σαπωνοποίησής του. Όταν χρειάζεται, (ανα)κρυσταλλώνεται από θερμό νερό.
| Κροτονικό οξύ | |
|---|---|
 | |
 | |
| Γενικά | |
| Όνομα IUPAC | Κροτονικό οξύ[1] |
| Άλλες ονομασίες | 2-βουτενικό οξύ β-μεθυλακρυλικο οξύ |
| Χημικά αναγνωριστικά | |
| Χημικός τύπος | C4H6O2 |
| Μοριακή μάζα | 86,09 amu |
| Σύντομος συντακτικός τύπος | CH3CH=CHCOOH |
| Συντομογραφίες | MeCH=CHCOOH |
| Αριθμός CAS | 107-93-7 |
| SMILES | CC=CC(=O)O |
| InChI | 1/C4H6O2/c1-2-3-4(5)6/h2-3H,1H3,(H,5,6) |
| PubChem CID | 637090 |
| ChemSpider ID | 552744 |
| Ισομέρεια | |
| Ισομερή θέσης | >95 |
| Γεωμετρικά ισομερή | 2 |
| Φυσικές ιδιότητες | |
| Σημείο τήξης | 70-73 °C |
| Σημείο βρασμού | 185-1891 °C |
| Πυκνότητα | 1020 kg/m3 |
| Χημικές ιδιότητες | |
| pKa | 4,69 |
| Ελάχιστη θερμοκρασία ανάφλεξης | 85,56 °C |
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |
Ισομέρεια
Το κροτονικό οξύ έχει ένα γεωμετρικό ισομερές, καθώς και πολλά ισομερή θέσης, από τα οποία τα σημαντικότερα είναι τα ακόλουθα:
- 2-βουτιν-1,4-διόλη, με ημισυντακτικό τύπο HOCH2C≡CCH2OH.
- γ-βουτυρολακτόνη, με γραμμικό τύπο
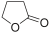 .
. - Ισοκροτονικό οξύ, με ημισυντακτικό τύπο Ζ-CH3CH=CHCOOH.
- Βουτανοδιόνη, με ημισυντακτικό τύπο CH3COCOCH3.
- Δι(οξιράνιο), με γραμμικό τύπο
 .
. - 1,4-διοξένιο, με γραμμικό τύπο
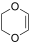 .
. - Μεθυλοπροπενικό οξύ, με ημισυντακτικό τύπο CH2=C(CH3)COOH.
- Προπενικός μεθυλεστέρας, με ημισυντακτικό τύπο CH2=CHCOOCH3.
- Βουτανοδιάλη, με ημισυντακτικό τύπο HCOCH2CH2CHO.
- Αιθανικός βινυλεστέρας, με ημισυντακτικό τύπο CH3COOCH=CH2.
Δομή
Είναι ένα μέλος της ομόλογης σειράς των αλκενικών οξέων, δηλαδή των αλειφατικών μονοκαρβοξυλικών οξέων με ένα διπλό δεσμό. Ο διπλός δεσμός του κροτονικού οξέος βρίσκεται σε συζυγή θέση (δηλαδή με έναν απλό δεσμό ενδιάμεσα) με εκείνον του καρβονυλίου του καρβοξυλίου του.
| Δεσμοί[3] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C#4-H | σ | 2sp2-1s | 109 pm | 3% C- H+ |
| C#2,#3-H | σ | 2sp2-1s | 106 pm | 3% C- H+ |
| C#4-C#3 | σ | 2sp3-2sp2 | 151 pm | |
| C#3=C#2 | σ | 2sp2-2sp2 | 134 pm | |
| π | 2p-2p | |||
| C#2-C#1 | σ | 2sp2-2sp2 | 147 pm | |
| C=O | σ | 2sp2-2sp2 | 132 pm | 19% C+ O- |
| π | 2p-2p | |||
| C-O | σ | 2sp2-2sp3 | 147 pm | 19% C+ O- |
| O-H | σ | 2sp3-1s | 96 pm | 32% O- H+ |
| Γωνίες | ||||
| HC#2,#3H | 120° | |||
| HC#2C#3 | 120° | |||
| CCO | 120° | |||
| COO | 120° | |||
| OCO | 120° | |||
| COH | 104,45° | |||
| Στατιστικό ηλεκτρικό φορτίο[4] | ||||
| Ο (OH) | -0,51 | |||
| Ο (=O) | -0.38 | |||
| C#4 | -0,09 | |||
| C#2,#3 | -0,03 | |||
| Η (HC) | +0,03 | |||
| Η (OH) | +0,32 | |||
| C#1 | +0,57 | |||
Παραγωγή
Το κροτονικό οξύ μπορεί να ληφθεί με αρκετές μεθόδους, μερικές από τις οποίες είναι οι ακόλουθες:
Με οξείδωση Ε-2-βουτενάλης
Με οξείδωση Ε-2-βουτενάλης παράγεται κροτονικό οξύ:[5]

Με συμπύκνωση αιθανάλης και μαλονικού οξέος
Με συμπύκνωση αιθανάλης και μαλονικού οξέος, με τη χρήση πυριδίνης (Py) ως διαλύτη, παράγεται κροτονικό οξύ:[6]

Με υδρόλυση 3-βουτενυλονιτριλίου
Με αλκαλική υδρόλυση 3-βουτενυλονιτριλίου παράγεται κροτονικό οξύ, μετά από ενδιάμεση μετάθεση του διπλού δεσμού:[7][8]

Με αφυδάτωση 3-υδροξυβουτανικού οξέος
Με αφυδάτωση 3-υδροξυβουτανικού οξέος, που πραγματοποιειται με απλή απόσταξη του τελευταίου, παράγεται κροτονικό οξύ:[9]

Κρυσταλλογραφικές ιδιότητες
Το κροτονικό οξύ κρυσταλλώνεται στο μονοκλινές κρυσταλλικό σύστημα, στην ομάδα διαστήματος P21/a (ομάδα διαστήματος 14, θέση 3) με παραμέτρους πλέγματος a = 971 pm, b = 690 pm, c = 775 pm και β = 104.0°. Η μονάδα κελιού περιέχει τύπο 4 μονάδων.[10]
Αντιδράσεις και παράγωγα
Υδρογόνωση
Το κροτονικό οξύ μετατρέπεται σε βουτυρικό οξύ με υδρογόνωση, για παράδειγμα με αναγωγή με ψευδάργυρο και θειικό οξύ:[11]

Αλογόνωση
Το κροτονικό οξύ, μετά από αλογόνωση με χλώριο ή βρώμιο, μετατρέπεται σε 2,3-διαλοβουτανικό οξύ:[11]

Υδραλογόνωση
Το κροτονικό οξύ, μετά από υδραλογόνωση με υδροβρώμιο, μετατρέπεται σε 3-βρωμοβουτανικό οξύ:[11][12]

Υδροξυαλογόνωση
Το κροτονικό οξύ, μετά από υδροξυαλογόνωση με υποχλωριώδες οξύ, μετατρέπεται σε 3-υδροξυ-2-χλωροβουτανικό οξύ:[13]

Οξείδωση
Το κροτονικό οξύ μπορεί να οξειδωθεί με αλκαλικό διάλυμα υπερμαγγανικού καλίου, σχηματίζοντας 2,3-διυδροξυβουτανικό οξύ:[11]

Εστεροποίηση
Το κροτονικό οξύ, μετά από εστεροποίηση με κάποια αλκοόλη (ROH), σχηματίζει τον αντίστοιχο κροτονικό αλκυλεστέρα:[13]

Ανυδρίτης
Το κροτονικό οξύ, μετά από συνθέρμανση με οξικό ανυδρίτη [(CH3CO)2O], σχηματίζει κροτονικό ανυδρίτη:[14]

Θρεονίνη
Η ρακεμεική (DL-)θρεονίνη μπορεί να παραχθεί από το ρακεμεικό κροτονικό οξύ με α-ενεργοποίηση, χρησιμοποιώντας αμμωνία και οξικό υδράργυρο[15]

Πηγές
- Ν. Αλεξάνδρου, Γενική Οργανική Χημεία, ΘΕΣΣΑΛΟΝΙΚΗ 1985
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Πολυχρόνη Σ. Καραγκιοζίδη: Ονοματολογία οργανικών ενώσεων, Θεσσαλονίκη 1991, Έκδοση Β΄.
- Ν. Αλεξάνδρου, Α. Βάρβογλη, Δ. Νικολαΐδη: Χημεία Ετεροκυκλικών Ενώσεων, Θεσσαλονίκη 1985, Έκδοση Β΄.
- Δ. Νικολαΐδη: Ειδικά κεφάλαια Οργανικής Χημεία, Θεσσαλονίκη 1983.