Axe intestin-cerveau
L'axe intestin-cerveau est la signalisation biochimique qui se produit entre le tractus gastro-intestinal et le système nerveux central (SNC)[1]. Le terme "axe intestin-cerveau" est parfois utilisé pour désigner le rôle du microbiote intestinal dans l'interaction, alors que le terme "axe microbiote-intestin-cerveau" inclut explicitement le rôle de la flore intestinale dans les événements de signalisation biochimique qui ont lieu entre le tractus gastro-intestinal et le SNC[1],[2],[3].

De manière générale, l'axe intestin-cerveau comprend le système nerveux central, les systèmes neuroendocriniens et neuro-immuns, y compris l'axe hypothalamo-hypophyso-surrénalien (axe HPA), les voies sympathique et parasympathique du système nerveux autonome, y compris le système nerveux entérique, le nerf vague et le microbiote intestinal[1],[3]. La première des interactions cerveau-intestin découverte fut la phase céphalique de la digestion, lors de la libération des sécrétions gastriques et pancréatiques en réponse à des signaux sensoriels, tels que l'odorat et la vue des aliments, qui a été démontrée pour la première fois par Pavlov[4],[5].
Une étude menée en 2004 a suscité l'intérêt en découvrant que les souris nées et maintenues artificiellement sans microbiote intestinal (germ-free ou GF) présentaient une réponse exagérée de l'axe HPA au stress par rapport aux souris possédant leur microbiote intestinal habituel[1].
En octobre 2016, la plupart des travaux sur le rôle de la flore intestinale dans l'axe intestin-cerveau avaient été menés sur des animaux ou sur la caractérisation des divers composés neuro-actifs que la flore intestinale peut produire. Les études chez l'homme - recherchant des variations du microbiote intestinal entre personnes présentant divers troubles psychiatriques et neurologiques ou stressées, ou mesurant les effets de divers probiotiques (appelés "psychobiotiques" dans ce contexte) - avaient généralement été modestes et commençaient tout juste à se généraliser[6]. On ignorait encore si les modifications du microbiote intestinal étaient la cause ou la conséquence d'une pathologie, ou des deux à la fois, et si elles pouvaient éventuellement impliquer divers mécanismes de rétroaction dans l'axe intestin-cerveau[7],[1].
Le microbiote intestinal


Le microbiote intestinal est la communauté complexe de micro-organismes qui vivent dans le tube digestif de l'homme ou d'autres animaux. Le métagénome ou microbiome intestinal est l'agrégat de tous les génomes du microbiote intestinal[8]. L'intestin est une niche dans laquelle le microbiote humain habite[9].
Chez l'homme, le microbiote qui siège au sein du tube digestif est celui qui contient le plus grand nombre de bactéries et le plus grand nombre d'espèces par rapport aux autres zones du corps[10]. Chez l'homme, le microbiote intestinal s'établit dès la naissance. Des différences se marqueront selon le mode d'accouchement, par voie naturelle ou par césarienne, selon qu'il y a eu ou pas d'allaitement naturel. Le microbiote atteint une certaine maturité et stabilité relative vers l'âge de 2 ans. À ce moment, l'épithélium intestinal et, plus précisément, l'intégrité de la barrière muqueuse intestinale qu'il constitue se sont développés de telle manière à pouvoir supporter et même soutenir les bactéries commensales, tout en formant une barrière efficace contre les organismes pathogènes que l'intestin contient inévitablement[11],[12].
Entre le microbiote intestinal et son hôte humain ce n'est pas simplement une relation commensale qui s'installe, à savoir une coexistence pacifique et non préjudiciable pour chacune des deux parties, mais c'est une véritable relation mutualiste[9] qui opère. Les micro-organismes intestinaux sont bénéfiques pour l'hôte, notamment en récupérant l'énergie des glucides et autres fibres alimentaires non digérés et non absorbés par la muqueuse de l'intestin grêle. Ces substances subissent une fermentation par ces bactéries, qui les métabolisent en une multitude gaz (H2, CH4, H2S,CO2...) et de divers acides gras à chaîne courte (AGCC) également nommés acides gras volatils (AGV) comportant, entre autres l'acétate, le butyrate et le propionate[10],[13]. Les bactéries intestinales jouent également un rôle important dans la synthèse des vitamines B et de la vitamine K, ainsi que dans le métabolisme des acides biliaires, des stérols et des xénobiotiques[9],[13]. L'importance systémique des AGCC et des autres composés qu'ils produisent ressemble à l'action des hormones et la flore intestinale représente un réel organe endocrinien[13]. Toute dysbiose intestinale est corrélée à de nombreuses affections, dont les pathologies inflammatoires et auto-immunes[10],[14].
La composition du microbiote intestinal évolue au fil du temps, en fonction des changements de régime alimentaire, des infections, des médicaments administrés à l'hôte, dont particulièrement les antibiotiques auxquels il doit faire face, et plus globalement de l'évolution de l'état de santé général[10],[14].
Prenons pour exemple la biosynthèse de composés bioactifs (indole et certains autres dérivés) à partir de tryptophane par des bactéries intestinales[15]. L'indole est produit à partir de tryptophane par des bactéries qui expriment la tryptophanase[15]. Clostridium sporogenes métabolise le tryptophane en indole, puis en acide 3-indolepropionique (IPA)[16] un puissant antioxydant neuroprotecteur qui piège les radicaux hydroxyles[15],[17],[18]. L'IPA se lie au récepteur du prégnane X (PXR) dans les cellules intestinales, facilitant ainsi l'homéostasie muqueuse et la fonction de barrière[15]. Après absorption par la muqueuse intestine, l'IPA diffuse dans le cerveau, où il exerce un effet neuroprotecteur, notamment contre l'ischémie cérébrale et la maladie d'Alzheimer[15]. Différentes espèces de lactobacilles métabolisent le tryptophane en indole-3-aldéhyde (I3A) qui agit sur le récepteur d'hydrocarbure aryle (AhR) dans les cellules immunes intestinales, augmentant ainsi la production d'interleukine-22 (IL-22)[15]. L'indole lui-même induit la sécrétion du Glucagon-like peptide-1 (GLP-1) dans les cellules L entéro-endocrines et joue le rôle de ligand pour AhR[15]. L'indole peut également être métabolisé par le foie en sulfate d'indoxyl, un composé toxique quand il est en forte concentration et qui est alors associé à des maladies vasculaires et à un dysfonctionnement rénal[15]. AST-120 (charbon actif), un sorbant intestinal par voie orale, adsorbe l'indole, ce qui diminue la concentration de sulfate d'indoxyle dans le plasma sanguin[15].
Système nerveux entérique
Le système nerveux entérique est l'une des divisions principales du système nerveux et consiste en un système de neurones disposés en forme de maillage qui régit la fonction du système digestif. Il a été décrit comme un "second cerveau" pour plusieurs raisons. Le système nerveux entérique peut fonctionner de manière autonome. Il communique normalement avec le système nerveux central (SNC) par le système nerveux parasympathique (par exemple, via le nerf vague) et sympathique (par exemple, par l'intermédiaire des ganglions prévertébraux). Cependant, des études sur les vertébrés montrent que, lorsque le nerf vague est sectionné, le système nerveux entérique continue de fonctionner[19].
Chez les vertébrés, le système nerveux entérique comprend des neurones efférents, des neurones afférents et des interneurones, qui rendent tous le système nerveux entérique capable de supporter des réflexes en l'absence d'entrée du système nerveux central. Les neurones sensoriels rendent compte des conditions mécaniques et chimiques. Par les muscles intestinaux, les motoneurones contrôlent le péristaltisme et le brassage du contenu intestinal. D'autres neurones contrôlent la sécrétion d'enzymes. Le système nerveux entérique utilise également plus de 30 neurotransmetteurs, dont la plupart sont identiques à ceux du système nerveux central, tels que l'acétylcholine, la dopamine et la sérotonine. Plus de 90 % de la sérotonine dans l'organisme se trouve dans l'intestin, ainsi que près de 50 % de la dopamine. La double fonction de ces neurotransmetteurs est un élément important des recherches sur l'axe intestin-cerveau[20],[21],[22].
La première des interactions intestin-cerveau se situait entre la vue et l'odeur des aliments et la libération des sécrétions gastriques, appelée phase céphalique ou réponse céphalique de la digestion[4],[5].
Intégration intestin-cerveau
L'axe intestin-cerveau, système de communication neurohumorale bidirectionnel, est important pour le maintien de l'homéostasie et est régulé par les systèmes nerveux central et entérique ainsi que par les voies neurale, endocrinienne, immunitaire et métabolique, notamment l'axe hypothalamo-hypophyso-surrénalien (axe HPA)[1]. Ce terme a été élargi pour inclure le rôle de la flore intestinale dans l'axe « microbiote-intestin-cerveau », un lien entre des fonctions incluant le microbiote intestinal[1],[3],[2].
Une étude réalisée en 2004 (Nobuyuki Sudo et Yoichi Chida) a montré que des souris exemptes de bactéries (souris de laboratoire génétiquement homogènes, nées et élevées dans un environnement aseptique) montraient une réponse exagérée de l'axe HPA au stress par rapport aux souris possédant un microbiote intestinal développé normalement[1].
La flore intestinale peut produire une gamme de molécules neuroactives, telles que l'acétylcholine, les catécholamines, l'acide γ-aminobutyrique, l'histamine, la mélatonine et la sérotonine, toutes indispensables à la régulation du péristaltisme et des sensations au départ de l'intestin[23]. Les modifications de la composition de la flore intestinale dues à un régime alimentaire, à des médicaments ou à une maladie sont en corrélation avec des modifications des taux de cytokines sériques, dont certaines peuvent affecter le fonctionnement du cerveau[23]. La flore intestinale libère également des molécules qui peuvent directement activer le nerf vague qui transmet au cerveau des informations sur l'état des intestins[23].
De même, des situations chroniques ou extrêmement stressantes activent l'axe hypothalamo-hypophyso-surrénalien, provoquant des modifications de la flore intestinale et de l'épithélium intestinal qui, elles-mêmes, peuvent avoir des effets systémiques[23]. De plus, la voie anti-inflammatoire cholinergique, qui passe par le nerf vague, affecte l'épithélium intestinal et la flore[23]. La faim et la satiété sont intégrées au cerveau, et la présence ou non de nourriture dans les intestins et les types d'aliments présents affectent également la composition et l'activité de la flore intestinale[23].
Cela dit, la plupart des travaux sur le rôle de la flore intestinale dans l'axe intestin-cerveau ont été menés chez des animaux, y compris des souris hautement artificielles et ne contenant pas de microbiote. En 2016, les études réalisées chez l'homme et visant à mesurer les modifications de la flore intestinale en réponse au stress ou à mesurer les effets de divers probiotiques étaient généralement de petite taille et ne pouvaient pas être généralisées. Il est difficile de savoir si les modifications de la flore intestinale résultent d'une maladie ou en sont la cause, ou des deux à la fois en étant la conséquence d'un nombre indéfini de boucles de rétroaction au sein de l'axe intestin-cerveau[7].
L'histoire des idées sur une relation entre l'intestin et l'esprit remonte au XIXe siècle. Les concepts de dyspepsie et de neurasthénie gastrique (entéronéphroptose traumatique) faisaient référence à l'influence de l'intestin sur les émotions et les pensées humaines[24],[25].
Recherche
Probiotiques
Une revue systématique d'analyses effectuées en 2016 sur des animaux de laboratoire et des essais cliniques préliminaires menés sur des souches de bactéries probiotiques disponibles dans le commerce a révélé que certaines espèces des genres Bifidobacterium et Lactobacillus (B. longum, B. breve, B. infantis, L. helveticus, L. rhamnosus, L. plantarum et L. casei) étaient les plus susceptibles d'être utiles pour certains troubles du système nerveux central[26].
Anxiété et troubles de l'humeur
À partir de 2018, les travaux sur la relation entre la flore intestinale et les troubles anxieux et les troubles de l'humeur, ainsi que les tentatives d'influencer cette relation à l'aide de probiotiques ou de prébiotiques (appelés "psychobiotiques"), étaient à un stade précoce, avec des preuves insuffisantes pour en tirer des conclusions sur les changements de la flore intestinale dans ces conditions, ou sur l'efficacité de tout traitement probiotique ou prébiotique[27],[7]. La dénomination de psychobiotiques est apparue dans la littérature internationale en 2013 sous l'impulsion de Timothy Dinan (chercheur à l'APC Microbiome Institute à Cork en Irlande), en référence aux « probiotiques » à action centrale et en les définissant comme des organismes vivants dont l’ingestion produit un avantage pour la santé des patients souffrant de maladies psychiatriques ou neurologiques [28],[29]. Thomas Insel, directeur du National Institute of Mental Health (NIMH) estimait en 2012 que la façon dont le microbiote semble influencer le développement du cerveau et in fine nos comportements, apparaît comme l’un des grands chantiers en matière de recherche pour les neurosciences cliniques dans le futur[28]. En avril 2016, deux revues de la littérature permettaient d'identifier treize essais cliniques en double aveugle, randomisés et versus placebo, portant sur les psychobiotiques ; parmi celles-ci seulement cinq rapportaient des améliorations significatives sur des symptômes psychiques[28]. Parmi ces travaux, le travail publié en 2011 par le laboratoire français ETAP, en collaboration avec le laboratoire BIOFORTIS, avait permis d'objectiver pour la première les effets centraux de probiotiques [30],[31].
Les personnes souffrant d'anxiété et de troubles de l'humeur ont tendance à avoir des problèmes gastro-intestinaux. De petites études ont été menées pour comparer la flore intestinale des personnes atteintes d'un trouble dépressif majeur et des personnes en bonne santé, mais ces études ont eu des résultats contradictoires[7].
Le rôle potentiel de la flore intestinale dans les troubles anxieux, et plus généralement du rôle de la flore intestinale dans l'axe intestin-cerveau, a suscité beaucoup d'intérêt, selon des études publiées en 2004 montrant que les souris sans microbiote avaient une réponse exagérée de l'axe HPA au stress dû à un enfermement, et qui a été inversé en colonisant leur intestin avec une espèce de Bifidobacterium[2]. Des études portant sur la séparation maternelle des rats montrent que le stress néonatal conduit à des modifications à long terme du microbiote intestinal, telles que la réduction de sa diversité et la modification de sa composition, qui ont également induit un comportement de type stressé et anxieux[32]. De nombreuses études ont été réalisées en 2016 pour caractériser divers neurotransmetteurs connus pour être impliqués dans les troubles anxieux et les troubles de l'humeur que la flore intestinale puisse produire (par exemple, les espèces Escherichia, Bacillus et Saccharomyces peuvent produire de la noradrénaline, Candida, Streptococcus et Escherichia peuvent produire de la sérotonine, etc.). Cependant, chez l'homme, les interactions et les voies par lesquelles la flore intestinale pourrait influer sur l'anxiété ne sont pas claires[8].
Autisme
Environ 70 % des personnes autistes ont également des problèmes gastro-intestinaux[source insuffisante], en outre l'autisme est souvent diagnostiqué au moment où un équilibre plus stable de la flore intestinale s'établit, indiquant qu'il peut y avoir un lien entre l'autisme et la flore intestinale[33]. Certaines[Lesquelles ?] études ont montré principalement une augmentation de la quantité de Clostridium dans les selles des enfants autistes[34], mais cela n'a pas été reproduit de manière cohérente[33]. De nombreux facteurs environnementaux considérés comme pertinents pour favoriser le développement de l'autisme affecteraient également la flore intestinale, laissant ouverte la question de savoir si certaines variations spécifiques de la flore intestinale conduisent au développement de l'autisme ou si ces changements se produisent parallèlement[3],[33]. En 2016, les études sur les probiotiques n'avaient été menées qu'avec des animaux. Les études d'autres changements alimentaires pour traiter l'autisme n'ont pas été concluantes[7].
Maladie de Parkinson
En 2015, une étude a comparé la flore intestinale des personnes atteintes de la maladie de Parkinson à celle des témoins sains. Les personnes atteintes de Parkinson présentaient des taux inférieurs de Prevotellaceae et les patients présentant des taux élevés d'Enterobacteriaceae souffraient des symptômes plus graves sur le plan clinique[3].
La neuro-gastroentérologie
Cette science englobe l'étude du cerveau, de l'intestin et de leurs interactions, de manière à permettre de comprendre et de gérer la motilité gastro-intestinale et les troubles gastro-intestinaux fonctionnels. Plus précisément, la neuro-gastroentérologie se concentre sur les fonctions, les dysfonctionnements et les malformations des divisions sympathique, parasympathique et entérique du tube digestif[35].
Fonction des neurones dans le tractus gastro-intestinal
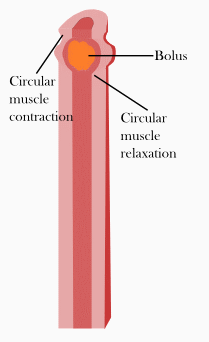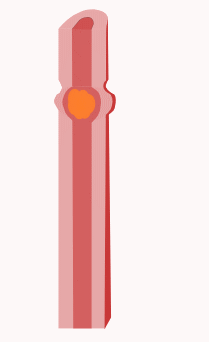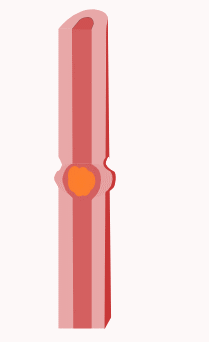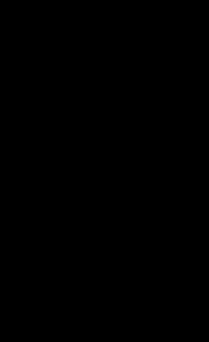
Le réflexe péristaltique
Le péristaltisme est une série de contractions et de relaxations de muscles radialement symétriques qui se propagent dans un tube musculaire. Chez l'homme et d'autres mammifères, le péristaltisme se situe au niveau des muscles lisses du tube digestif pour propulser le contenu dans le système digestif. Le péristaltisme a été découvert en 1899 par les travaux des physiologistes William Bayliss et Ernest Starling. Travaillant sur l'intestin grêle des chiens, ils ont constaté que la réaction à l'augmentation de la pression dans l'intestin provoquait la contraction de la paroi musculaire au-dessus du point de stimulation et le relâchement de la paroi musculaire en dessous du point de stimulation[36],[37].
Segmentation
Les contractions de segmentation se situent dans les parois de muscle lisse. Contrairement au péristaltisme, qui implique la contraction et la relaxation des muscles dans une direction, la segmentation se produit simultanément dans les deux directions, à mesure que les muscles circulaires se contractent. Cela permet de bien mélanger le contenu intestinal, appelé chyme, pour permettre une plus grande absorption.
Sécrétion
La sécrétion d'enzymes digestives gastro-intestinales, telles que la gastrine et la sécrétine, est régulée par les neurones cholinergiques situés dans les parois du tube digestif. La sécrétion d'hormones est contrôlée par le réflexe vagovagal, où les neurones du tube digestif communiquent par le biais de voies afférentes et des fibres nerveuses efférentes au sein du nerf vague[38].
Anatomie
Système nerveux entérique

Le système nerveux entérique est l'une des principales divisions du système nerveux et l'axe principal de la neuro-gastroentérologie. Le système nerveux entérique fait référence à l'ensemble du système de neurones qui régissent le système gastro-intestinal[39]. Il est capable de fonctionner indépendamment du cerveau et de la moelle épinière[37], mais il repose sur l'innervation par le système nerveux autonome via le nerf vague et les ganglions prévertébraux chez le sujet sain. Cependant, des études ont montré que le système fonctionne avec un nerf vague sectionné[19]. Les neurones du système nerveux entérique contrôlent les fonctions motrices du système, en plus de la sécrétion d'enzymes gastro-intestinales. Ces neurones communiquent via de nombreux neurotransmetteurs similaires au système nerveux central, notamment l'acétylcholine, la dopamine et la sérotonine. La présence importante de sérotonine et de dopamine dans l'intestin est un domaine de recherche essentiel pour les neuro-gastroentérologues[40],[41],[42].
Le plexus d'Auerbach
Le plexus d'Auerbach, également appelé plexus myentérique, est un ensemble de fibres non myélinisées et de corps cellulaires autonomes postganglionnaires situés entre les couches circulaires et longitudinales de la musculeuse externe du tube digestif. Il a été découvert et nommé par le neuropathologiste allemand Leopold Auerbach. Ces neurones fournissent des entrées motrices aux deux couches de la musculeuse externe et fournissent des entrées parasympathiques et sympathiques. L'anatomie du plexus est semblable à celle du système nerveux central. Le plexus comprend des récepteurs sensoriels, tels que des chimiorécepteurs et des mécanorécepteurs, qui sont utilisés pour fournir une entrée sensorielle aux interneurones du système nerveux entérique. Le plexus est le noyau d'origine parasympathique du nerf vague et communique avec le médulla oblongata par les nerfs vagues antérieur et postérieur.
Le plexus de Meissner
Le plexus de Meissner est un ensemble de plexus de nerfs parasympathiques allant du plexus d'Auerbach à la muscularis mucosae de la paroi gastro-intestinale. Il a été découvert et nommé par le physiologiste allemand Georg Meissner. Il fonctionne comme une voie d'innervation dans la couche de muqueuse de la paroi gastro-intestinale.
Les dysfonctionnements
Troubles gastro-intestinaux fonctionnels
Les troubles gastro-intestinaux fonctionnels sont une classe de troubles gastro-intestinaux dans lesquels il existe un dysfonctionnement dans les activités normales du tractus gastro-intestinal, mais aucune anomalie structurelle pouvant en expliquer la cause. Il existe rarement des tests permettant de détecter la présence de ces troubles. La recherche clinique en neurogastroentérologie porte principalement sur l'étude des troubles gastro-intestinaux fonctionnels courants tels que le syndrome du côlon irritable qui est le trouble gastro-intestinal fonctionnel le plus répandu[43].
Troubles de la motilité
Les troubles de la motilité constituent la deuxième classe de troubles gastro-intestinaux étudiés par les neurogastroentérologues. Ils sont divisés en fonction de la région qu'ils affectent: l'œsophage, l'estomac, l'intestin grêle et le gros intestin. La recherche clinique en neurogastroentérologie porte principalement sur l'étude des troubles courants de la motilité, tels que le reflux gastro-œsophagien, l'atteinte de la muqueuse de l'œsophage provoquée par la remontée d'acide provenant de l'estomac via le sphincter inférieur de l'œsophage (cardia)[44].
Sociétés de neurogastroentérologie
- Société américaine de neurogastroentérologie et de motilité[45]
- Société européenne de neurogastroentérologie et de motilité[46]
- La revue Neurogastroentérologie & motilité
Voir également
Images supplémentaires
- Le plexus myentérique d'un lapin. X 50.
- Le plexus sous-muqueux d'un lapin. X 50.