Acide butanoïque
L'acide butanoïque, aussi appelé acide butyrique du grec βουτυρος (beurre), est un acide carboxylique saturé de formule CH3CH2CH2-COOH
| Acide butanoïque | |||
 | |||
 | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | Acide butanoïque | ||
| Synonymes | acide butyrique | ||
| No CAS | |||
| No ECHA | 100.003.212 | ||
| No CE | 203-532-3 | ||
| DrugBank | DB03568 | ||
| PubChem | |||
| FEMA | 2221 | ||
| SMILES | |||
| InChI | |||
| Apparence | liquide incolore, huileux, d'odeur caractéristique[1]. | ||
| Propriétés chimiques | |||
| Formule | C4H8O2 [Isomères] | ||
| Masse molaire[3] | 88,105 1 ± 0,004 4 g/mol C 54,53 %, H 9,15 %, O 36,32 %, | ||
| Diamètre moléculaire | 0,560 nm[2] | ||
| Propriétés physiques | |||
| T° fusion | −7,9 °C[1] | ||
| T° ébullition | 164 °C[1] | ||
| Solubilité | dans l'eau : miscible[1], Miscible avec l'éthanol, l'éther | ||
| Paramètre de solubilité δ | 21,5 MPa1/2 (25 °C)[4]; 25,1 J1/2·cm-3/2 (25 °C)[2] | ||
| Masse volumique | 0,959 g·ml-1 à 20 °C 0,964 g·ml-1 à 25 °C | ||
| T° d'auto-inflammation | 452 °C[1] | ||
| Point d’éclair | 72 °C (coupelle fermée)[1] | ||
| Limites d’explosivité dans l’air | 2–10 %vol[1] | ||
| Pression de vapeur saturante | à 20 °C : 57 Pa[1] | ||
| Point critique | 52,7 bar, 354,85 °C[6] | ||
| Thermochimie | |||
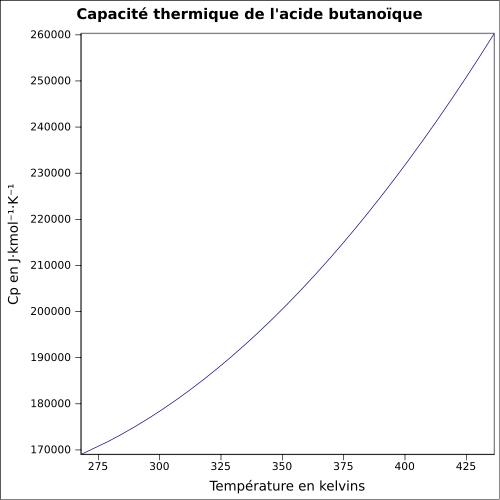
| Cp | |||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 10,17 ± 0,05 eV (gaz)[8] | ||
| Propriétés optiques | |||
| Indice de réfraction | 1,398 | ||
| Précautions | |||
| SGH[9] | |||
| H314 | |||
| SIMDUT[10] | |||
Produit non classé | |||
| NFPA 704 | |||
| Transport | |||
| |||
| Écotoxicologie | |||
| DL50 | 8,79 g·kg-1 (rats, oral) | ||
| LogP | 0,79[1] | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier | |||
On le trouve par exemple dans le beurre rance, le parmesan, et le contenu gastrique, où il dégage une odeur forte et désagréable. L'acide butyrique peut être perçu à partir d'environ 5 à 40 µg/m3 selon les sources[11].
Dans des conditions normales de température et de pression, l'acide butanoïque est un liquide légèrement huileux qui se solidifie à −8 °C et dont le point d'ébullition est de 164 °C. Il est facilement soluble dans l'eau, l'éthanol, et l'éther et se dissocie de son solvant par l'addition de chlorure de calcium. Le dichromate de potassium et l'acide sulfurique l'oxydent en dioxyde de carbone et en acide acétique, alors que le permanganate de potassium alcalin l'oxyde seulement en dioxyde de carbone. De plus, il a pour isomère de constitution l'acide 2-méthylpropanoïque, qui lui doit son deuxième nom d'acide isobutyrique.
C'est aussi un acide gras à courte chaîne présent dans les huiles végétales et les graisses animales. Le glycéride (ester de glycérol) de l'acide butyrique compose 3 % à 4 % du beurre. Quand le beurre rancit, les glycérides sont hydrolysés, libérant ainsi de l'acide butyrique à l'odeur désagréable. L'acide butyrique normal ou l'acide butyrique de fermentation est également trouvé comme ester hexylique dans l'huile de Heracleum giganteum et comme ester octylique dans celle du panais (Pastinaca sativa) ; il est aussi présent dans la transpiration.
Il est habituellement produit par la fermentation du sucre ou de l'amidon, provoquée par l'addition de fromage en décomposition, auquel on ajoute du carbonate de calcium pour neutraliser les acides formés dans le processus. La fermentation butyrique de l'amidon est facilitée par l'addition directe de Bacillus subtilis.
Divers esters sont obtenus à partir de l'acide butyrique. Ces esters sont appelés butyrate ou plus correctement butanoate. Ceux à faible masse molaire, comme le butanoate de méthyle, ont la plupart du temps des arômes plaisants. Ils sont ainsi utilisés comme additifs alimentaires ou dans les parfums.
Sa formule brute est la même que celle du formiate de propyle.
Usage
L'acide butanoïque est utilisé dans la préparation de divers arômes (esters butanoates), esters d'acide butyrique de faible poids moléculaire, comme le butanoate de méthyle, ont, pour la plupart, des arômes ou des goûts agréables. De ce fait, ils sont utilisés comme additifs dans l'alimentation et les parfums.
Grâce à sa forte odeur, il est également utilisé comme additif pour les appâts de pêche[12]. Beaucoup de saveurs disponibles sur le marché pour appâter les carpes communes (Cyprinus carpio) utilisent l'acide butyrique comme base d'ester, mais il n'est pas évident de savoir si les poissons sont attirés par l'acide butyrique lui-même ou par les autres substances ajoutées. L'acide butyrique est, cependant, l'un des rares acides organiques à se révéler savoureux à la fois pour les tanches et les bouvières[13].
À titre anecdotique, cette substance a également été utilisée comme répulsif non toxique provoquant des nausées et qui gâche la chair des baleines par l'équipe de Sea Shepherd contre le navire usine des baleiniers japonais[14] et par des militants anti-avortement[15] ; certaines forces policières pensent également l'adopter comme arme non-létale[réf. nécessaire].
Fabrication des butyrates
Fermentation classique
Les butyrates ou correctement butanoates, esters de l'acide butanoïque, sont issues de fermentations faisant intervenir des bactéries anaérobies. Ce processus a été découvert par Louis Pasteur en 1861. Les principales bactéries productrices de butyrates sont :
- Clostridium butyricum ;
- Clostridium kluyveri ;
- Clostridium pasteurianum ;
- Fusobacterium nucleatum ;
- Butyrivibrio fibrisolvens ;
- Eubacterium limosum ;
- Clostridium tyrobutyricum.
Le bilan de la réaction est le suivant :
- C6H12O6 → C4H8O2 + 2 CO2 + 2 H2
La première étape de la production des butanoates emprunte la chaîne métabolique de la glycolyse, qui aboutit à la formation de deux molécules de pyruvate par molécule de glucose. Le pyruvate obtenu est ensuite oxydé en éthanoate (acétate sous la forme d'éthanoyl-coenzyme A) par un processus enzymatique unique faisant intervenir une série d'enzymes appelée complexe pyruvate déshydrogénase, avec formation parallèle de dioxyde de carbone (CO2) qui quitte alors la cellule par diffusion et réduction de NAD+ en NADH.
- L'éthanoyl-coenzyme A se transforme en acétoacétyl-coenzyme A. L'enzyme responsable est l'acétyl-CoA acétyl-transférase.
- L'acétoacétyl-coenzyme A se transforme en β-hydroxybutyryl-CoA. l'enzyme responsable est la β-cétoacyl-CoA réductase (coenzyme : NADH).
- La β-hydroxybutyryl CoA se transforme en crotonyl CoA. l'enzyme responsable est la β-hydroxyacyl deshydratase.
- La crotonyl-CoA se transforme en butyl-CoA (CH3CH2CH2C=O-CoA). l'enzyme responsable est la énoyl-CoA réductase (coenzyme : NADH).
- Un groupement phosphate remplace le CoA pour former un phosphate de butyle. L'enzyme responsable est la phosphobutyrylase.
- Le groupement phosphate rejoint l'ADP pour former de l'ATP et des butyrates; l'enzyme responsable est la butyrate kinase.
Acétone et fermentation des butyrates
Certaines bactéries produisent de l'acétone et du butanol par un autre processus commençant comme une fermentation de butyrates, comme :
- Clostridium acetobutylicum : (la plus importante, utilisée dans l'industrie chimique) ;
- Clostridium beijerinckii ;
- Clostridium tetanomorphum ;
- Clostridium aurantibutyricum.
Ces bactéries suivent le processus de fermentation décrit précédemment mais, lorsque le pH est inférieur à 5, elles passent vers la production de butanol et d'acétone pour empêcher une plus forte baisse du pH qui leur serait fatale. Deux molécules de butanol sont produites pour une molécule d'acétone. La modification se produit après la formation de l'acétoacétyl CoA. Cet intermédiaire peut, dans ces conditions, agir de deux nouvelles façons :
Activité physiologique de l'acide butanoïque
L'acide butyrique peut inhiber la fonction des histones désacétylase, augmentant ainsi la proportion d'histones acétylés, lesquelles ont une plus faible affinité pour l'ADN que la forme non acétylée (pour des raisons de répulsion électrostatiques). Il est en général admis que la fixation des facteurs de transcription sur l'ADN est défavorisée par la présence d'histones non acétylées (ayant une faible affinité pour l'ADN). Il est donc possible de conclure que l'acide butyrique augmente l'activité transcriptionnelle de la cellule au niveau de promoteurs régulés par les histones déacétylases.
L'acide butyrique est produit par le microbiote intestinal des mammifères. Sa production est amplifiée par les agents prébiotiques (fibres solubles). Il sert de carburant à la muqueuse intestinale et d'immunostimulant local et systémique[16]. Il permettrait au système immunitaire de faire la différence entre une colonisation par des bactéries symbiotiques et des agents pathogènes tels que le choléra[17].
Sous forme cationique ou d'ester l'acide butyrique a des propriétés antivirales, antifongiques et antibactériennes. Son intérêt sous cette forme réside surtout dans son potentiel à réguler les cellules cancéreuses et induire une différenciation cellulaire[18].
Source
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Butyric acid » (voir la liste des auteurs).
Bibliographie
Voet & Voet ; John Wiley & Sons, 1995