Hydroxyde de calcium
| Hydroxyde de calcium | |
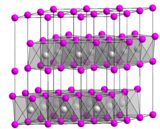 | |
| Structure cristalline. __ Ca2+ __ OH− | |
| Identification | |
|---|---|
| Synonymes | dihydroxyde de calcium, |
| No CAS | |
| No ECHA | 100.013.762 |
| No CE | 215-137-3 |
| PubChem | 14777 |
| No E | E526 |
| SMILES | |
| InChI | |
| Apparence | cristaux incolores ou poudre blanche[1] |
| Propriétés chimiques | |
| Formule | Ca(OH)2 |
| Masse molaire[2] | 74,093 ± 0,005 g/mol H 2,72 %, Ca 54,09 %, O 43,19 %, |
| Propriétés physiques | |
| T° fusion | (décomposition) : 580 °C[1] |
| Solubilité | 1,85 g·L-1 (eau, 0 °C) 1,73 g·L-1 (eau, 20 °C) |
| Masse volumique | 2,24 g·cm-3[3] |
| Cristallographie | |
| Système cristallin | Trigonal |
| Réseau de Bravais | Hexagonal |
| Paramètres de maille | a = 3,589 Å c = 4,911 Å Z = 1 |
| Volume | 54,69 Å3 |
| Précautions | |
| SIMDUT[4] | |
 E, | |
| Transport | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier | |
L'hydroxyde de calcium est un corps chimique minéral, composé ionique du cation calcium et de l'anion hydroxyde, de formule brute Ca(OH)2. Cet alcali antique est aussi appelé « chaux éteinte », « chaux grasse » et « chaux aérienne », car cette poudre corrosive et hygroscopique était préparée à partir de la chaux vive ou oxyde de calcium produite autrefois par le four à chaux du chaufournier. C'est également un minéral naturel rare, de densité 2,23, nommé « portlandite » par les minéralogistes car il s'agit d'un simple produit d'hydrolyse du ciment Portland.

Il s'agit du principal constituant dissous de l'eau de chaux ou en suspension du lait de chaux. En effet, ce minéral hydroxyde alcalino-terreux est très peu soluble dans l'eau : suivant la composition des chaux éteintes industrielles, souvent un peu magnésiennes, entre 1,1 g·L-1 et 1,6 g·L-1 à 20 °C, environ entre 0,6 g·L-1 et 0,7 g·L-1 à 80 °C[5]. Le composé pur au laboratoire est à peine légèrement plus soluble[6]. Sa solubilité déjà très faible dans l'eau décroît faiblement avec la température. Sa constante de produit de solubilité est de l'ordre de 5,02 × 10−6 à 25 °C.
Préparation
La chaux éteinte était préparée selon la méthode rapide des anciens chaufourniers par extinction de la chaux vive - CaO - par immersion dans l'eau[7]. Il s'agit d'une réaction très exothermique, l'hydratation de l'oxyde de calcium engendre de l'hydroxyde de calcium :
- CaO solide blanc + H2O liquide → Ca(OH)2 faiblement dissous (aqueux), l'essentiel en suspension dans l'eau, avec ΔH=~1 155 kJ·kg-1 de chaux vive.
Le solide divisé en suspension dans l'eau, de l'ordre de 100 g·L-1 forme ce qu'on appelle un « lait de chaux », l'hydroxyde de calcium est le solide blanc obtenu après séchage à l'étuve ou au four. Le lait de chaux filtré donne une « eau de chaux » limpide.À l'air humide, une réaction pouvait donner de la chaux aérienne, en fait de l'hydroxyde de calcium, mais ceci uniquement en absence de carbonatation ou fixation de dioxyde de carbone ce qui est rarement le cas[8]. L'eau de chaux se trouble en présence de ce dernier gaz : elle était pour les anciens chimistes, à la suite de travaux de Jean-Baptiste Van Helmont, le premier détecteur de gaz connu de la présence de ce gaz sylvestre.
Une autre voie radicale, absolument non rentable, mais assez commune au laboratoire, est la réaction du métal calcium, produisant un dégagement gazeux :
- Ca métal solide + 2 H2O liquide → Ca(OH)2 aqueux, puis précipité en grains en large part + H2 gaz
Elle est dangereuse du fait de la réactivité potentielle du métal et de l'explosivité ou inflammabilité potentielle à l'air du gaz dihydrogène.
Toxicologie et sécurité
Il s'agit d'un alcali agressif, reconnu corrosif et irritant pour la peau et les muqueuses. Il peut causer des irritations et surtout des atteintes oculaires graves en cas de projection et/ou de contact. Il est irritant pour les voies respiratoires. Il présente une toxicologie vis-à-vis de certains organes du corps, dépourvus de régulations chimiques propres. La toxicité chronique reste encore méconnue : il est susceptible d'action à long terme, telle que la lente fragilisation des dents.
Pour l'environnement, la chaux bien souvent éteinte est une menace alcaline, particulière pour les cours et plans d'eau et les écosystèmes aqueux.
Usages
Si la chaux vive CaO rafle l'essentiel des emplois en sidérurgie, les travaux publics et les routes (assèchement du socle de voie depuis l'Antiquité romaine), le traitement des eaux et agriculture, la construction et le bâtiment, la chaux éteinte est utilisée comme agent d'absorption du dioxyde de carbone, que ce soient les appareils d'anesthésie et respiratoires de secours, ainsi que dans l'alimentation.
L'hydroxyde de calcium est un additif alimentaire (E526[9]) utilisé comme régulateur alimentaire de pH et affermissant/stabilisant[10] dans de nombreux produits[11].
La chaux est aussi utilisée en production de la graisse industrielle.[réf. nécessaire]
Références
Voir aussi
Article connexe
Liens externes
- Page sur la chaux
- Fiche toxicologique, CNESST
- Fiche de sécurité chimique compacte, CDC,
- Lucile Goupy, « Risques liés à l'utilisation d'hydroxyde de calcium sur le long terme » [PDF], sur cpeastudyclub.org, L'Information dentaire no 16,
