Rifamycine
Une rifamycine est un antibiotique de la famille des ansamycines. Ces molécules sont produites naturellement par Amycolatopsis mediterranei, la bactérie à partir de laquelle elles ont été isolées, ou produites artificiellement. Elles sont particulièrement efficaces contre les mycobactéries et ont de ce fait été utilisées dans des traitements contre la tuberculose, la lèpre et les infections au complexe Mycobacterium avium (en) (MAC). Le groupe des rifamycines comprend les médicaments classiques à rifamycine ainsi que les dérivés de rifamycine : rifampicine (ou rifampine), la rifabutine, la rifapentine et le rifalazil.
Découverte et commercialisation
Amycolatopsis mediterranei a été isolée en 1957 à partir d'un échantillon de sol provenant de la région de Saint-Raphaël sur la Côte d'Azur. Cette bactérie a été nommée Streptomyces mediterranei par deux microbiologistes, l'Italienne Grazia Beretta et l'Israélien Pinhas Margalith, du groupe pharmaceutique italien Lepetit SpA à Milan[1]. Les premières rifamycines ont été isolées la même année à partir d'une culture par fermentation de cette bactérie au laboratoire Lepetit à Milan par deux chercheurs italiens, Piero Sensi et Maria Teresa Timbal, en collaboration avec Pinhas Margalith. Sept rifamycines ont été découvertes, appelées rifamycine A, B, C, D, E, S et SV.

La rifamycine B a été la première à être commercialisée. La société Lepetit a déposé une demande de brevet pour cette molécule en août 1958 au Royaume-Uni et en mars 1959 aux États-Unis, donnant lieu respectivement aux brevets GB921045 en mars 1963 et US 3,150,046 en septembre 1964. Il est largement admis que la rifamycine B a contribué à venir à bout de la tuberculose résistante aux médicaments dans les années 1960.
Mode d'action
L'activité antibactérienne des rifamycines repose sur l'inhibition de la transcription de l'ADN en ARN en raison de la forte affinité des rifamycines pour l'ARN polymérase des procaryotes[2]. Les données sur des structures cristallisées de rifamycines liées à l'ARN polymérase indiquent que ces antibiotiques bloquent la transcription par occlusion stérique[3],[4], c'est-à-dire en occupant la place nécessaire à l'amorçage de la polymérisation de l'ARN par la polymérase ; si la rifamycine se lie à l'enzyme après que la polymérisation a commencé, celle-ci se poursuit normalement et aucune inhibition n'est observée.
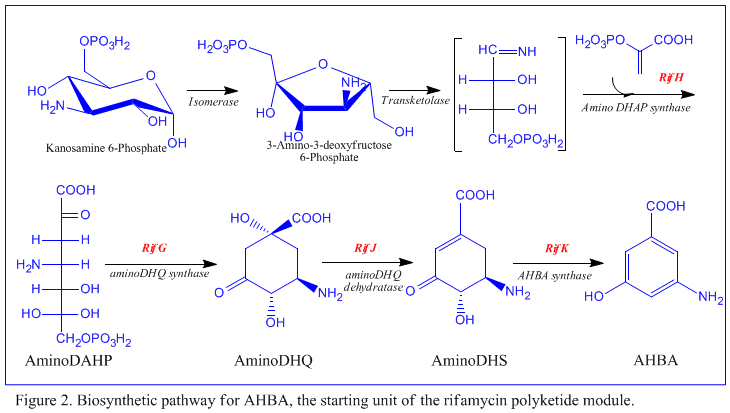
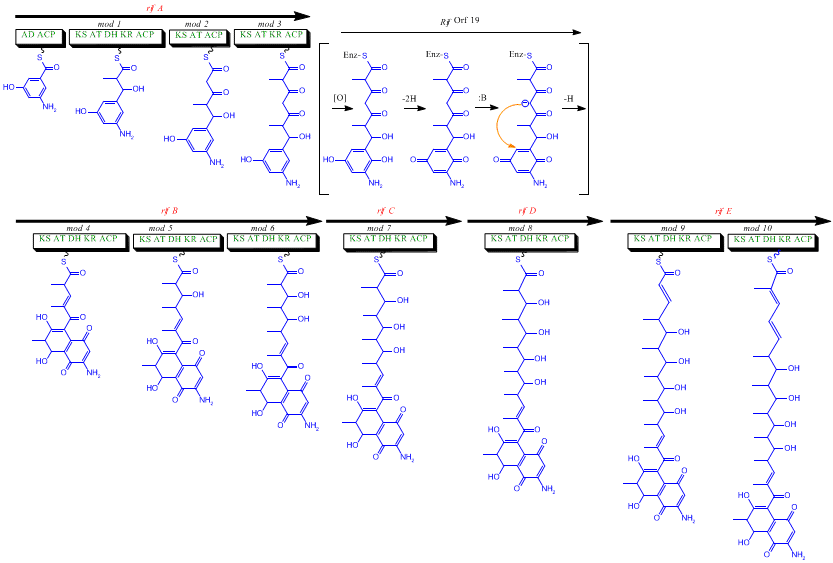
Biosynthèse
Bien que la rifamycine B soit un antibactérien doux, c'est le précurseur de plusieurs dérivés plus puissants utilisés en thérapeutique. La biosynthèse de cet antibiotique commence avec une amorce rare, l'acide 3-amino-5-hydroxybenzoïque (AHBA), sur une polycétide synthase de type I qui allonge la chaîne en utilisant deux unités acétate et huit unités propionate[5]. On pense que l'AHBA provient essentiellement du métabolisme du shikimate mais trois analogues d'acides aminés convertis en AHBA ont été observés dans les extraits cellulaires d’A. mediterranei[6].