Izotopi berilija
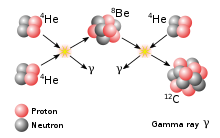
Trenutno je poznanih 12 berilijevih izotopov, od 5Be do 16Be ter 8 izomerov. Berilij ima le en stabilni izotop, 9Be, ki je edini, ki se v naravi pojavlja v dovolj velikih količinah, da jih lahko izmerimo. Atomska masa berilija je tako ista kot atomska masa 9Be. Najstabilnejši izmed radioaktivnih izotopov je 10Be, ki ima razpolovno dobo milijon in pol let, v naravi pa se pojavlja v sledovih. Medtem ko ostali izotopi nimajo posebnih uporab, se 10Be uporablja za ocenjevanje starosti plasti ledu ter hitrosti akumulacije ali erozije.[1] Ostala dva izotopa, ki se pojavljata v naravi, imata prekratki razpolovni dobi, da bi lahko z njimi merili starost. 7Be nastaja pri proton-proton fuziji v zvezdah z združitvijo 3He in 4He.[2] 10Be in 7Be oba v naravi nastajata v atmosferi zaradi trkov med atomi v zraku in kozmičnimi žarki. Nastali berilij se nato raztopi v vodnih hlapih in tako pride na površje Zemlje. Obstajajo tudi nekateri dokazi, da uran razpade tudi na nekatere nuklide z atomsko maso 4–9. Podatki še posebej nakazujejo na razpad na 7Be in 8Be in naj bi se tako 8Be tudi v izredno majhnih količinah pojavljal v naravi.[3] Poleg tega se berilij-8 pojavlja v zvezdah, zmožnih zlivanja helija in je vmesni produkt nastanka ogljika-12. Pomemben izotop je trudi 16Be, saj je edini do sedaj znan izotop, ki naj bi razpadel z emisijo dinevtrona (2Nt).
| ||||||||||||
| Standardna atomska masa Ar, standard(Be) |
| |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
Berilij je precej nestabilen glede na njegovo pozicijo v periodnem sistemu. Ima sodo število protonov, kar naj bi mu dalo prednost v stabilnosti pred sosednjima litijem in borom. Kljub temu imata tako litij kot bor dva stabilna izotopa, berilij pa le enega. Prav tako ni stabilen izotop z enakim številom protonov in nevtronov, 8Be, kar je značilno za vse druge izotope od vodika do kisika. 8Be je izredno nestabilen; bolj stabilna sta celo 7Be in 9Be, oba z lihim številom nevtronov. To je zaradi tega, ker je berilij-8 sestavljen iz dveh jeder helija-4 in zato ima veliko težnjo po temu, da razpade nanj. Berilij je prvi element, ki ima izotope, stabilnejše od nekaj let.

Uvod

Vsak element ima točno določeno število protonov,[a] lahko pa se njegovi atomi razlikujejo v številu nevtronov. Nuklidom, ki imajo isto število protonov, vendar se razlikujejo v številu nevtronov, pravimo izotopi. Če se še bolj poglobimo, lahko za nekatere izotope ločimo tudi njegove izomere.[b] V grobem imajo različni izotopi elementa enake kemijske lastnosti, vendar se razlikujejo v fizikalnih lastnostih.[c] Običajno razmerje med nevtroni in protoni je pri nižjih elementih približno 1, vendar ko se približujemo težjim elementom, se razmerje začne večati.[4] Kljub temu poznamo izotope, ki imajo dvakrat toliko nevtronov, kolikor protonov.[5] Če moramo označiti, da nekje potrebujemo točno določen izotop elementa, se njegovo masno število zapiše nadčrtano pred simbolom, na primer, atom helija z masnim številom 3 bi zapisali kot 3He, ali helij-3, kar je bolj pogosta zapisa izotopa v besedilu.
V naravi najbolj razširjeni izotopi elementov so po večini stabilni, vendar predstavljajo le majhen delež vseh izotopov. Za vsak element poznamo tudi radioaktivne izotope – tako poznamo radioaktiven ogljik, radioaktivno železo, radioaktivno zlato. Čeprav se od teh elementov v naravi pojavlja radioaktivni izotop ogljika, 14C, in železa, 60Fe, ju je v naravi zelo malo in je nevarnost minimalna.[d] Radioaktivni izotopi zlata so bili ustvarjeni le v laboratorijih, zato je vse naravno zlato stabilno.
Za izračun relativne atomske mase elementa moramo poznati atomske mase vseh izotopov, ki se pojavljajo v naravi ter njihovo razširjenost. Večini izotopov, ki se pojavljajo v naravi se da določiti izmed koliko atomi elementa bomo našli ta izotop. Tako dobimo podatke o razširjenosti izotopov, ki bi se morali sešteti do 1.[e] Pri nekaterih elementih se razmerje med izotopi med kraji razlikuje, zato sta podani dve številki – minimalna in maksimalna vrednost. Nekaterim izotopom, ki se v naravi pojavljajo v izredno majhnih količinah, ne moremo natančno določiti, zato je podan le podatek, da se element pojavlja v sledovih. Teh izotopov se v izračunu ne upošteva, saj bi v vsakem primeru imeli zelo majhen vpliv. Taki izotopi so radioaktivni in običajno nastanejo s kozmičnim sevanjem ali razpadom radioaktivnih izotopov. Izotopi, ki se v naravi ne pojavljajo, so sintetični in se jih v izračun ne vključuje. Atomsko maso elementa se izračuna tako, da se atomsko maso vsakega izotopa pomnoži z njegovo razširjenostjo v naravi in jih nato seštejemo. Tako dobimo povprečno atomsko maso vseh atomov elementa, ki se pojavljajo v naravi.
Umetne izotope dobimo tako, da naravnim izotopom dodamo ali odvzamemo protone ali nevtrone ali celo večje dele nuklida. Umeten izotop lahko opazimo tudi pri razpadu drugih umetnih izotopov; najbolj poznana izotopa, pridobljena na tak način, sta 2Nt in 2He.[6][7] Umetni izotopi so vsi radioaktivni in zelo hitro razpadejo. Izotopi lahko razpadejo na več načinov. Glavni trije razpadi so alfa, beta in gama razpad, obstajajo pa tudi drugi. Kako bo razpadel nek izotop je odvisno od tega, kakšno je njegovo razmerje med nevtroni in protoni. Če je premalo nevtronov, bo razpadel na takšen način, da se bo znebil protona. Tak je na primer beta plus razpad, ki proton spremeni v nevtron. Če je nevtronov preveč, se bo želel znebiti nevtrona, na primer z beta minus razpadom. Če je razmerje hudo preveliko ali premajhno, lahko izotop izvrže enega ali več nevtronov oz. protonov. Če je izotop na splošno pretežak (težji od svinca, ki je najtežji stabilni izotop), se želi znebiti tako protonov kot nevtronov, zato izvrže jedro helija-4 (2 protona in 2 nevtrona), kar je znano kot razpad alfa. Ker ta način zmanjša vrstno število le za 2, se pri mnogih izotopih to mora zgoditi večkrat, da postanejo stabilni. Tako dobimo razpadne verige izotopov, ki kažejo razpad določenega izotopa. Pri nizkem masnem številu so verige sorazmeroma krajše, za supertežke izotope pa so najdaljše. Isti izotop lahko razpade tudi na več načinov – tako govorimo o vejah razpadne verige.
Pri določanju možnosti, ali je izotop stabilen, poleg razmerja med protoni in nevtroni upoštevamo tudi, dva druga dejavnika: prvi je t. i. magična števila, pri katerih je večja možnost za stabilnost. Ta števila so 2, 8, 20, 28, 50 in 82 za protone in nevtrone ter še 126 za število nevtronov.[8] Izotopi s takim številom nevtronov in protonov bi morali biti bolj stabilni od ostalih. Ta števila so vsa parna, saj na splošno velja, da je izotop s sodim številom nevtronov in protonov bolj stabilen kot tisti z lihim. V bistvu obstajajo le štirje stabilni izotopi z lihim številom tako protonov kot nevtronov.[f]
Izotopov elementa se običajno ne poimenuje, vendar so kljub temu nekateri poimenovani. Drugo ime za 1H je protij, za 2H devterij in za 3H tritij. Ti trije vodikovi izotopi so tudi edini, ki imajo svoje simbole (P, D in T). Poleg teh so poimenovani tudi izotopi, izključno iz nevtronov ali protonov. Tako poznamo mononevtron (1Nt), dinevtron (2Nt) … ter monoproton (1H), diproton (2He) itd. 1H ima tako dve poimenovanji, protij in monoproton.
Seznam
| Be – 9,0121831(5)[g] | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Izotop[h] | Z | N | Ar (amu)[i] | Evez/A (keV)[j] | Spin[k] | Leto odkritja | Razpad[l] | Pojavljanje v naravi | ||||||
| t½[m] | Vrsta | %[n] | Takojšnji produkti[o] | Stabilni produkti[p] | %[q] | CIAAW | ||||||||
| 5Be | 4 | 1 | 5,039870 ± 0,002150 | 20 ± 400 | ? | ? | p | 100 | 4Li, 1H | 3He, 1H | sintetičen | |||
| 6Be | 4 | 2 | 6,019726 ± 0,000006 | 4487,2 ± 0,9 | 0+ | 1958 | 5 ± 0,3 zs | 2p | 100 | 4He, 1H | 4He, 1H | sintetičen | ||
| 7Be | 4 | 3 | 7,01692872 ± 0,00000008 | 5371,548 ± 0,01 | 3/2− | 1938 | 53,22 ± 0,06 dni | EC | 100 | 7Li | 7Li | v sledovih | ||
| 8Be | 4 | 4 | 8,00530510 ± 0,00000004 | 7062,435 ± 0,04 | 0+ | 1932 | 81,9 ± 3,7 as | ɑ | 100 | 4He | 4He | v sledovih? | ||
| 9Be | 4 | 5 | 9,01218307 ± 0,00000008 | 6462,668 ± 0,009 | 3/2− | 1921 | Stabilen | 100% | 1 | |||||
| 10Be | 4 | 6 | 10,01353470 ± 0,00000009 | 6497,630 ± 0,008 | 0+ | 1935 | 1,51 ± 0,04 mil. let | β− | 100 | 10B | 10B | v sledovih | ||
| 11Be | 4 | 7 | 11,02166108 ± 0,00000026 | 5952,540 ± 0,022 | 1/2+ | 1958 | 13,76 ± 0,07 s | β−, ɑ | 2,9 ± 4 | 7Li, 4He | 7Li, 4He | sintetičen | ||
| β− | ? | 11B | 11B | |||||||||||
| β−, n | ? | 10B, 1Nt | 10B, 1H | |||||||||||
| 12Be | 4 | 8 | 12,0269221 ± 0,000002 | 5720,72 ± 0,16 | 0+ | 1966 | 21,50 ± 0,04 ms | β− | 99,50 ± 3 | 12B | 12C, 4He | sintetičen | ||
| β−, n | 0,50 ± 3 | 11B, 1Nt | 11B, 1H | |||||||||||
| 13Be | 4 | 9 | 13,036135 ± 0,000011 | 5241,4 ± 0,8 | (1/2−) | 1983 | 1,0 ± 0,7 zs | n | 100 | 12Be | 12C, 11B, 4He, 1H | sintetičen | ||
| 14Be | 4 | 10 | 14,042890 ± 0,000014 | 4994 ± 9 | 0+ | 1973 | 4,35 ± 0,17 ms | β−, n | 98 ± 2 | 13B, 1Nt | 13C, 12C, 1H | sintetičen | ||
| β−, 2n | 0,8 ± 0,8 | 12B, 1Nt | 12C, 4He, 1H | |||||||||||
| β− | 0,8 ± 0,8 | 14B | 14N, 13C, 1H | |||||||||||
| β−, 3n | 0,2 ± 2 | 11B, 1Nt | 11B, 1H | |||||||||||
| β−, t | 0,02 ± 1 | 11Be, 3H | 11B, 10B, 7Li, 4He, 3He, 1H | |||||||||||
| β−, ɑ | < 0,004 | 10Li, 4He | 9Be, 4He, 1H | |||||||||||
| 15Be | 4 | 11 | 15,053490 ± 0,00018 | 4541 ± 11 | ? | ? | < 200 ns | n | 100 | 14Be, 1Nt | 14N, 13C, 12C, 11B, 10B, 9Be, 7Li, 4He, 3He, 1H | sintetičen | ||
| 16Be | 4 | 12 | 16,061670 ± 0,00018 | 4285 ± 10 | 0+ | 2012 | 650 ± 130 ys | 2n | 100 | 14Be, 2Nt | 14N, 13C, 12C, 11B, 10B, 9Be, 7Li, 4He, 3He, 1H | sintetičen | ||
Izomeri
| Izomer | Ekscitacijska energija | Spin | Leto odkritja | Razpad | Pojavljanje v naravi | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| t½ | Vrsta | % | Takojšnji produkti | Stabilni produkti | % | CIAAW | ||||
| 7Be* | 10980 ± 30 | 3/2− | ? | ? | p | ? | 6Li, 1H | 6Li, 1H | sintetičen | |
| 3He | ? | 4He, 3He | 4He, 3He | |||||||
| ɑ | ? | 4He, 3He | 4He, 3He | |||||||
| 8Be*1 | 16626 ± 3 | 2+ | 2004 | ? | ɑ | 100 | 4He | 4He | sintetičen | |
| 8Be*2 | 27494,3 ± 2 | 0+ | ? | ? | n | 39,4 | 7Be, 1Nt | 6Li, 1H | sintetičen | |
| d | 27 | 6Li, 2H | 6Li, 2H | |||||||
| ? | 14 | |||||||||
| t | 11,7 | 5Li, 3H | 4He, 3H, 1H | |||||||
| ɑ | 7,9 | 4He | 4He | |||||||
| 9Be* | 14390,5 ± 1,8 | 3/2− | 1976 | 1,25 ± 0,1 | ? | 100 | sintetičen | |||
| 10Be* | 21179 ± 20 | (2−) | ? | ? | n | ? | 9Be, 1Nt | 9Be, 1H | sintetičen | |
| p | ? | 9Li, 1H | 9Be, 4He, 1H | |||||||
| t | ? | 7Li, 3H | 7Li, 3He | |||||||
| 12Be* | 2251 ± 1 | 0+ | 2007 | 229 ± 8 ns | IT | 100 | 12Be | 12C, 11B, 4He, 1H | sintetičen | |
| 13Be* | 1500 ± 50 | (5/2−) | 1992 | ? | ? | 100 | sintetičen | |||
| 14Be* | 1520 ± 150 | (2+) | 1995 | ? | ? | 100 | sintetičen | |||
Opombe
Sklici
Viri
- »BERYLLIUM« (v angleščini). CIAAW. 2003. Pridobljeno 3. februarja 2021.
- »The AME2016 atomic mass evaluation (II). Tables, graphs and references« (PDF) (v angleščini). Iop Science. 17. maj 2017. Pridobljeno 3. februarja 2021.
- »Table I. The NUBASE 2012 table of nuclear and decay properties« (PDF) (v angleščini). Chinese Physics C (HEP & NP). 2012. str. 1176–1286. Pridobljeno 3. februarja 2021.