Toničnost
Toničnost ali toniciteta, poznana tudi kot efektivna osmolarnost[1][2], je kvalitativna mera za razlikovanje osmotskega tlaka med dvema raztopinama, običajno predeljenima s celično polprepustno (semipermeabilno) membrano.[3] Za razliko od osmolarnosti (koncentracije osmozno aktivnih delcev[4]) toničnost nima enote, ker ni kvantitativna veličina.[5] Toničnost lahko definiramo tudi kot koncentracijo raztopljenih topljencev v opazovani raztopini v primerjavi s koncentracijo topljencev primerjane raztopine.[6]
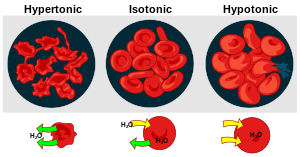
Toničnost raztopine je tesno povezana z učinkom na prostornino (volumen) celice in sledečimi spremembami celične oblike.[7] Ločimo tri različna stanja toničnosti, v katerih je lahko neka raztopina glede na drugo; hipertoničnost, hipotoničnost in izotoničnost.[8]
Toničnost in premiki vode
Pojem toničnost ima veliko pomembnost v celični biologiji in fiziologiji, saj omogoča razumevanje premikov vode med celicami in njihovo okolico, pri čemer voda vselej prehaja v smeri višje koncentracije topljenca (oziroma iz raztopine, kjer je manjša koncentracija topljenca in več proste vode – vode, ki ni vezana na molekule in ione, ter lahko posledično difuzno prehaja,[9] v raztopino, kjer je proste vode manj, koncentracija topljenca pa je večja).[6][9] V povezavi z osmozo se pogosto uporablja pojem osmotski potencial, za katerega je značilno, da se niža, če raztopini dodajamo topljenec. Posledično voda osmotsko prehaja iz raztopine z višjim osmotskim potencialom v raztopino z nižjim osmotskim potencialom.[10][11][12][13] Voda se venomer premika, dokler ni koncentracija topljenca v obeh raztopinah izenačena.[6][14]

Stanja toničnosti
Z dodajanjem topljencev se toničnost raztopine poveča, kljub temu pa je za opredelitev stanja toničnosti potrebna primerjava dveh različnih raztopin (denimo znotrajcelične tekočine in medceličnine).[6][9] Toničnost se pojavlja v treh različnih stanjih; hipertoničnosti, izotoničnosti in hipotoničnosti.[8]
Hipertoničnost
Kadar je v neki raztopini večja koncentracija raztopljenih topljencev (in posledično manj proste oziroma nevezane vode) kot v drugi, rečemo, da je opazovana raztopina hipertonična glede na primerjano.[6][9][15] Pravimo, da je osmotski potencial hipertonične raztopine bolj negativen kot osmotski potencial primerjane raztopine.[16] Hipertonično stanje se pogosto ponazori z eritrociti (rdečimi krvničkami), ki se jih da v z natrijevim kloridom koncentrirano raztopino. Ker je v raztopini več topljencev kot znotraj celice (v celici pa več proste vode kot zunaj), voda prehaja iz celice in posledično eritrociti izgubijo svojo tipično obliko ter se skrčijo (tako imenovana krenacija[17]). Celica ima v tem primeru glede na medij, ki jo obdaja, manj negativen osmotski potencial.[9][16][17] Pri rastlinskih celicah je dobro poznan pojav plazmolize, ki se odvije, kadar tovrstno celico damo v hipertonično raztopino in pride do izhajanja vode iz vakuole ter citosola, čemur sledi odstop celične membrane od celične stene. Proces je v določenih primerih povraten (reverzibilen), saj lahko plazmolizirana celica doživi deplazmolizo in preide v normalno stanje.[18]
Izotoničnost
Kadar je v neki raztopini raztopljena enaka koncentracija topljencev (in raztopina vsebuje enako količino vode) kot v primerjani, rečemo, da sta si raztopini izotonični.[6][9] Pravimo, da sta osmotska potenciala obeh raztopin enaka.[16] Izotonično stanje je mogoče ponazoriti s pomočjo eritrocitov in izotonične raztopine, pri čemer se oblika celice ne spremeni (krvničke so še vedno značilne diskaste oblike), ker prehajanja vode ni oziroma je to uravnoteženo (tako znotraj kot zunaj celice je enaka količina topljencev in proste vode, zatorej neto prehajanja vode ni).[9][17] Človeku dobro poznana izotonična raztopina je fiziološka raztopina,[19] ki ima osmolarnost podobno osmolarnosti človeške krvne plazme (masna koncentracija pribl. 0,9 %[19]).[20]
Hipotoničnost
Kadar je v neki raztopini raztopljena manjša koncentracija topljencev kot v drugi (in hkrati vsebuje več proste vode), rečemo, da je takšna raztopina hipotonična glede na primerjano.[6][9] Pravimo, da je osmotski potencial hipotonične raztopine manj negativen kot osmotski potencial primerjane raztopine.[16] Hipotonično stanje pogosto eksperimentalno prikažemo s pomočjo eritrocitov, ki se jih da v razredčeno raztopino (na primer vodo). Ker je v vodi precej manj topljencev (in več proste vode) kot v celici, voda prehaja v eritrocite, ki zaradi tega nabreknejo ali (ob veliki razliki med primerjanima raztopinama) celo počijo (tako imenovana hemoliza). Celica ima glede na medij, ki jo obdaja, bolj negativen osmotski potencial.[9][16][17][21] Rastlinska celica v hipotonični raztopini ne bo počila, ker jo pred tem ščiti ovoj trdne celične stene.[22][23]