光延反应
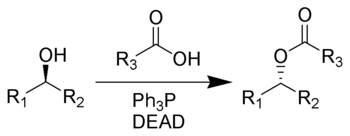
光延反应(Mitsunobu反应)是一种双分子亲核取代反应(SN2反应)。 由日本化学家光延旺洋(Mitsunobu, Oyo) 等人于1967年发明,是现代有机合成中常用的反应。 该反应能将醇通过与三苯基膦和偶氮二羧酸二乙酯(DEAD)[1] 反应转化为多种化合物比如酯。 此反应的特点是条件温和,产率高并带有构型翻转。
| 光延反应 | |
|---|---|
| 命名根据 | 光延旺洋 |
| 反应类型 | 偶联反应 |
| 标识 | |
| 有机化学网站对应网页 | mitsunobu-reaction |
| RSC序号 | RXNO:0000034 |
总反应
醇羟基在偶氮二羧酸二乙酯(DEAD)和三苯基膦的作用下被亲核试剂取代,同时跟羟基所连的碳原子构型发生翻转(瓦尔登翻转,Walden inversion)。总反应方程式如下:
反应機構
Mitsunobu反应機構相当复杂,其中的中间体实体以及它们所起的作用仍然有许多争论。

首先是三苯基膦(2)进攻DEAD形成中间体(3),夺取羧酸(4)质子形成离子(5),醇氧进攻离子(5)的膦碳正中心形成离子(8),而DEAD脱落下来形成肼的副产物(7)。其中(8)到(11)的手性翻转取决于羧酸的pKa以及溶剂极性。[7][8][9]虽然说反应当中参与了很多的膦中间体,但是(8)到(12)是唯一形成产物的路径并且最后得到三苯基氧膦副产物。
投料顺序
对于Mitsunobu反应来说,投料顺序至关重要。首先应当将羧酸,醇,三苯基膦溶解于适当的溶剂当中,比如四氢呋喃(或者乙醚等),冷至零度,然后将DEAD缓慢滴加,最后在室温下搅拌。若反应不完可以升温到室温或者继续加热进行。 另外一种投料方式,是将三苯基膦和DEAD先于溶剂中搅拌,再将醇和酸依次溶剂加入。[10]
反应变化与讨论
其他亲核官能团
许多其他的亲核试剂都能代替常规的羧酸来进行反应。 而要让反应进行顺利,亲核试剂的pKa必须不大于15。
反应改进
一个有用的改进,是使用树脂键合的三苯基膦和二叔丁基偶氮二羧酸酯来代替DEAD。 这样反应以后的后处理,可以使用过滤来去除三苯氧膦,二叔丁基偶氮二羧酸酯通过三氟乙酸处理来除去。[13]此外Bruce H. Lipshutz还开发了一种试剂(DCAD),能够很方便的通过过滤来除去。[14]
正磷试剂

角田 鉄人等人发现可以把三苯基膦和DEAD结合成一个试剂:正膦(Phosphorane)叶立德 (ylide)。(氰基甲基)三甲基正膦 (CMMP, R = 甲基) 和 (氰基甲基)三丁基正膦 (CMBP, R = 丁基) 都被证明有效。[15]

叶立德在这里起到碱和还原剂的作用。副产物是 乙腈 (6) 和三苯氧膦 (8)。
用途
在有机合成中常用来使一个带羟基的手性碳原子在温和的条件下发生构型翻转,以改变其立体化学构型。

此外选用不同的亲核试剂可以生成C-O键,C-N键,C-S键,C-C键等等。
反应实例当中不使用DEAD而用碱性更强的偶氮二羧酸二哌啶酯(ADDP),这是因为酚羟基酸性太弱了。反应当中的膦是高分子支载的三苯基膦(PS-PPh3)。
參考文献
外部链接
- The Mitsunobu Reaction(页面存档备份,存于互联网档案馆) by Kevin Jantzi
