انصمام رئوي
الانصمام الرئوي (بالإنجليزية: Pulmonary embolism) (PE) هو انسداد في أحد شرايين الرئتين بمادة انتقلت من مكان آخر في الجسم عبر مجرى الدم (انسداد وعائي).[6] قد تشمل أعراض الانصمام الرئوي زلة تنفسية، ألم صدري خاصة عند التنفس، ونفث دموي.[2] قد تظهر أيضاً أعراض خثرة دموية في الساق، مثل ساق حمراء، دافئة، متوذمة، ومؤلمة.[2] تشمل علامات الانصمام الرئوي انخفاض مستويات الأكسجين في الدم وتسرع التنفس وتسرع القلب وأحياناً حمى خفيفة.[11] يمكن أن تؤدي الحالات الشديدة إلى الغيبوبة، انخفاض ضغط الدم بشكل غير طبيعي، والموت المفاجئ.[3]
| انصمام رئوي | |
|---|---|
 رسم توضيحي للرئة يصور الانصمام الرئوي على أنه خثرة (جلطة دموية) انتقلت من منطقة أخرى من الجسم، مسببة انسداد الشريان الرئوي القصبي، مما يؤدي إلى خثار شرياني من الفصوص العلوية والسفلية في الرئة اليسرى | |
| معلومات عامة | |
| الاختصاص | علم الدم، طب القلب، طب الرئة |
| الأسباب | |
| عوامل الخطر | السرطان، الراحة في الفراش لفترات طويلة، التدخين، السكتة الدماغية، بعض الحالات الوراثية، الأدوية الحاوية على هرمون الاستروجين، الحمل، البدانة، بعد الجراحة[1] |
| المظهر السريري | |
| البداية المعتادة | أعمار متقدمة [1] |
| الأعراض | ضيق النفس، ألم الصدر، نفث دموي[2] |
| المضاعفات | غشي، صدمة، الموت المفاجئ[3] |
| الإدارة | |
| التشخيص | تعتمد على الأعراض، D-dimer، تصوير الأوعية الرئوية المقطعي المحوسب، تصوير الأوعية الرئوية بالنظائر المشعة[4] |
| العلاج | ممعيات (هيبارين، وارفارين، مميعات فموي ذات تأثير مباشر DOAC)[5] |
| أدوية | وارفارين، وأنيسينديون، وفينوبروكومون، ودالتيبارين الصوديوم، وبابافيرين، وستربتوكاينيز، وديكومارول، وأبيكسابان، وفوندابارينوكس ، وإيدوكسابان، وريفاروكسابان، وألتيبلاس، وإيدوكسابان، وهيبارين |
| الوبائيات | |
| انتشار المرض | حوالي 450000/سنة (في الولايات المتحدة الأمريكية)، 430000 (في أوروبا)[6][7][8] |
| الوفيات | >10-12000/سنة (في الولايات المتحدة الأمريكية)،[9] >30-40000 (في أوروبا)[10] |
| تعديل مصدري - تعديل | |
عادة ما يحدث الانصمام الرئوي نتيجة خثرة دموية في الساق انتقلت إلى الرئة.[6] يزداد خطر الإصابة بالخثرات الدموية عند مرضى السرطان والراحة في الفراش لفترات طويلة والتدخين والسكتة الدماغية وبعض الحالات الوراثية والأدوية الحاوية على هرمون الاستروجين والحمل والبدانة بعد الجراحة.[1] ترجع نسبة صغيرة من الحالات إلى انصمام بالهواء أو الدهون أو السائل الأمنيوسي.[12][13] يعتمد التشخيص على العلامات والأعراض جنباً إلى جنب مع نتائج الاختبارات.[4] إذا كان خطر الإصابة منخفضاً، فقد يستبعد الفحص الدموي المعروف باسم D-dimer الحالة.[4] وبخلاف ذلك، فإن تصوير الأوعية الرئوية المقطعي المحوسب أو تصوير الرئة بالنظائر المشعة أو الموجات فوق الصوتية للساقين قد يؤكد التشخيص.[4] يُعرف الخثار الوريدي العميق والانصمام الرئوي معاً باسم الخثار الوريدي (VTE).[14]
تشمل عوامل الوقاية من الانصمام الرئوي البدء في تحريك المريض بأسرع وقت ممكن بعد الجراحة، وتمارين الساقين أثناء فترات الجلوس، واستخدام مميعات الدم بعد بعض أنواع الجراحات.[15] يتم العلاج بمضادات التخثر مثل الهيبارين أو الوارفارين أو أحد مضادات التخثر الفموية ذات التأثير المباشر.[5] يوصى بالمميعات لمدة ثلاثة أشهر على الأقل.[5] قد تتطلب الحالات الشديدة حل الخثرة باستخدام الأدوية مثل منشط بلازمينوجين النسيجي (tPA) الذي يعطى وريدياً أو بواسطة قسطرة، وقد يتطلب البعض إجراء عملية جراحية (استئصال الخثرة الرئوية).[16] إذا كانت مميعات الدم غير مناسبة فيمكن استخدام مرشح الوريد الأجوف المؤقت.[16]
تؤثر الصمات الرئوية على حوالي 430000 شخص كل عام في أوروبا.[8] أما في الولايات المتحدة، تصيب ما بين 300000 و 600000 شخص كل عام،[6][7] والتي تساهم في 40000 حالة وفاة على الأقل.[9] معدلات الإصابة متشابهة في الذكور والإناث.[1] تصبح أكثر شيوعاً مع تقدم الناس في السن.[1]
الأعراض والعلامات
عادة ما تظهر أعراض الانصمام الرئوي بشكل مفاجئ وقد تشمل واحد أو أكثر مما يلي: زلة تنفسية (ضيق التنفس)، تسرع التنفس (التنفس السريع)، ألم صدري جنبي «التهاب الجنبة» (يزداد سوءًا بالتنفس)، سعال، ونفث دموي (سعال مدمى).[17] أما العلامات التي قد تلاحظ في الحالات الأشد: الزرقة (اللون الأزرق، عادة في الشفاه والأصابع)، الوهط، وعدم استقرار الدورة الدموية بسبب انخفاض تدفق الدم عبر الرئتين والجانب الأيسر من القلب. حوالي 15٪ من جميع حالات الوفاة المفاجئة تُعزى إلى الانصمام الرئوي.[3] في حين أن الانصمام الرئوي قد يتظاهر بغشي، إذ أقل من 1٪ من حالات الغشي تحدث بسبب الصمة الرئوية.[18]
عند الفحص السريري، عادة ما تكون الرئتان طبيعيتان. قد يُسمع أحياناً احتكاك جنبي فوق المنطقة المصابة من الرئة (غالباً في الانصمام الرئوي مع احتشاء). يوجد أحياناً انصباب جنب الذي يكون نضحياً، ويمكن اكتشافه أثناء الفحص عبر الأصمية بالقرع، خفوت أصوات التنفس، والاهتزاز الصوتي. يمكن أن نجد علامات إجهاد بطين أيمن على شكل رفعة أيسر القص، وارتفاع صوت الجزء الرئوي من صوت القلب الثاني، و/أو ارتفاع ضغط الوريد الوداجي.[3] قد توجد حمى خفيفة، خاصة إذا كان هناك نزف أو احتشاء رئوي.[19]
نظراً لأن الصمات الرئوية الأصغر تميل إلى الاستقرار في مناطق رئوية محيطية التي تفتقر الدوران الجانبي، فمن المرجح أن تسبب احتشاء رئوي وانصباب جنب صغير (كلاهما مؤلم)، ولكن لا تسبب نقص أكسجة، زلة تنفسية، وعدم استقرار هيموديناميكي مثل تسرع القلب. عادةً ما تسبب الصمات الرئوية الأكبر، التي تميل إلى الاستقرار مركزياً، زلة تنفسية، نقص أكسجة، انخفاض ضغط الدم، تسرع القلب، والإغماء، ولكنها غالباً ما تكون غير مؤلمة لعدم وجود احتشاء رئوي لتمتعها بالدوران الدموي الجانبي. غالباً ما يتم تفويت الصمات الصغيرة لأنها تسبب ألم جنبي فقط بدون أي موجودات أخرى وأيضاً غالباً ما يتم تفويت الصمات الرئوية الكبيرة لأنها غير مؤلمة وتحاكي الحالات الأخرى التي تسبب تغيرات في تخطيط القلب الكهربائي وارتفاع طفيف في مستويات التروبونين والببتيد الدماغي المدر للصوديوم.[20]
توصف الصمات الرئوية أحياناً بأنها ضخمة، تحت ضخمة، وغير ضخمة اعتماداً على العلامات والأعراض السريرية. على الرغم من أن التعريفات الدقيقة غير واضحة، إلا أن التعريف المقبول للصمة الرئوية الضخمة هو الذي يشتمل على عدم استقرار هيموديناميكي مثل انخفاض ضغط الدم المستمر، تباطؤ معدل ضربات القلب أو توقف النبض.[21]
عوامل الخطر

حوالي 90٪ من الصمات ناتجة عن خثار الأوردة العميقة القريبة في الساق (DVTs) أو خثار أوردة الحوض.[22] تشكل الإصابة بخثار الأوردة العميقة عامل خطر لانزلاق وهجرة الخثرات إلى الدورة الدموية الرئوية. تدعى هذه الحالات عموماً بـ الصمات الخثرية الوريدية (VTE).
تعد الصمات الخثرية الوريدية أكثر شيوعاً في الأفراد الذين يعانون من نقص المناعة وكذلك المصابين بأمراض مرافقة، حيث يعود تطور الخثار بشكل كلاسيكي إلى مجموعة من الأسباب تسمى ثالوث فيرخوف (تغيرات جريان الدم، عوامل في جدار الوعاء الدموي، وعوامل تؤثر على خصائص الدم)، وغالباً، يوجد أكثر من عامل خطر واحد.
- تغيرات جريان الدم: عدم الحركة (بعد الجراحة خاصة الجراحات العظمية في أو أسفل الورك دون وقاية من الخثرات،[23][24] أو عمليات تثبيت المفاصل خاصة مفاصل الساقين،[24] الطيران لمسافات طويلة)، الإصابة، الحمل (محفز للتخثر أيضاً)، البدانة (محفز للتخثر أيضاً)، السرطان (محفز للتخثر أيضاً).
- عوامل في جدار الوعاء الدموي: الجراحة (بسبب التلف الوريدي أثناء الجراحة[24])، القثطرة تسبب إصابة مباشرة («إصابة بطانة الوعاء»).
- العوامل المؤثرة على خصائص الدم (الحالة المحفزة للتخثر): وسائل تحديد النسل الهرمونية المحتوية على الإستروجين،[24] الحمل (نظراً لأن الجسم يضع نفسه في ما يعرف باسم «حالة فرط التخثر»، لتقليل خطر حدوث نزيف أثناء الولادة وينظم ذلك من خلال زيادة التعبير عن العامل السابع، الثامن، العاشر، عامل فون ويلبراند، والفيبرينوجين[24])، أهبة التخثر الوراثية (العامل الخامس لايدن، طفرة البروثرومبين G20210A، عوز البروتين C، عوز البروتين S، عوز أنتي الثرومبين، فرط هوموسيستين الدم واضطرابات البلازمينوجين/ انحلال الفبرين)، أهبة التخثر المكتسبة (متلازمة أضداد الفوسفوليبيد، المتلازمة الكلائية، البيلة الخضابية الليلية الانتيابية)، السرطان (مرضى سرطان البنكرياس والكولون «قد تكون أشكال السرطان الأخرى أيضاً من العوامل المؤهبة خاصة الأورام عالية الدرجة، ولكن سرطان البنكرياس والكولون أكثر شيوعاً»، هذا يرجع إلى إطلاق المواد المسببة للتخثر، ويبلغ خطر الإصابة بالصمات الخثرية الوريدية (VTE) ذروته أثناء التشخيص والعلاج، ولكنه يقل في فترة الشفاء.[24])
تشمل عوامل الخطر الأخرى: دوالي وريدية محدثة بتخرب وعائي،[23] فرط ضغط الدم الرئوي،[23] داء السكري.[23]
التشخيص

من أجل تشخيص الانصمام الرئوي، يوصى بمراجعة المعايير السريرية لتحديد الحاجة إلى الاختبارات.[25] بالنسبة لأولئك ذوي الخطورة المنخفضة: عمر أقل من 50، معدل ضربات القلب أقل من 100 نبضة في الدقيقة، مستوى الأكسجين أكثر من 94٪ في هواء الغرفة، لا يوجد وذمة ساق أو نفث دموي أو جراحة أو رض في الأسابيع الأربعة الماضية أو حوادث خثرية سابقة أو استخدام لهرمون الاستروجين، عادة لا تكون هناك حاجة لمزيد من الاختبارات.[26]
في الحالات التي يكون فيها الأفراد ذوي الخطورة العالية، هناك حاجة للمزيد من الاختبارات. يعتبر تصوير الأوعية الرئوية المقطعي المحوسب (CTPA) الطريقة المفضلة لتشخيص الانصمام الرئوي نظراً لسهولة إجراؤه ودقته.[27] على الرغم من أن تصوير الأوعية الرئوية المقطعي المحوسب مفضل، إلا أن هناك اختبارات أخرى يمكن إجراؤها.[25][28][29] على سبيل المثال، يمكن استخدام الموجات فوق الصوتية الضاغطة لاستقصاء أوردة الطرف السفلي القريبة.[27] يستخدم هذا الاختبار في المقام الأول كاختبار تأكيدي، مما يعني أنه يؤكد تحليلاً سابقاً يُظهر وجود أو اشتباه في وجود انصمام رئوي.[27] وفقاً لدراسة مقطعية، فإن التصوير بالموجات فوق الصوتية الضاغطة له حساسية 41٪ ونوعية 96٪.[27]
يعتمد تشخيص الانصمام الرئوي بشكل أساسي على مزيج من معايير سريرية مع اختبارات نوعية لأن الأعراض السريرية النموذجية للانصمام الرئوي (زلة تنفسية وألم صدري) لا يمكن تمييزها بشكل قاطع عن الأسباب الأخرى لألم الصدر والزلة التنفسية. يعتمد قرار إجراء التصوير الطبي على الحالة السريرية، أي التاريخ الطبي والأعراض ونتائج الفحص السريري، متبوعاً بتقييم الحالة وفق المعايير.[3]
اختبارات احتمالية الإصابة بالانصمام الرئوي
الطريقة الأكثر شيوعاً للتنبؤ بالاحتمالية السريرية، هي معيار ويلز، وهي قاعدة تنبؤ سريري. في عام 1995، طور فيليب ستيفن ويلز قاعدة تنبؤ لاحتمالية حدوث انصمام (بناءً على بحث في الأدبيات الطبية)، بناءً على معايير سريرية.[30] تم مراجعة قاعدة التنبؤ في عام 1998،[31] كما تمت مراجعتها في عام 2000 بشكل أكبر عندما بُسَطَت لتكون فعالة بواسطة ويلز وزملاؤه.[32]
توجد قواعد تنبؤ إضافية بالانصمام الرئوي، مثل معايير جنيف. والأهم من ذلك أن استخدام أي قاعدة يرتبط بالحد من تكرر الانصمام الخثاري المتكرر.[33]
معيار ويلز للتنبؤ بالانصمام الرئوي
| المعايير | عدد النقاط |
|---|---|
| موجودات سريرية تتوافق مع خثار وريدي عميق | 3 |
| لا يوجد تشخيص بديل يفسر الأعراض | 3 |
| تسرع قلب مع نبض أكثر من 100 نبضة/دقيقة | 1.5 |
| عدم حركة (ثلاثة أيام أو أكثر) أو جراحة خلال الأربع أسابيع السابقة | 1.5 |
| سوابق خثار وريدي عميق أو سوابق انصمام رئوي | 1.5 |
| وجود نفث دموي | 1 |
| وجود خباثة | 1 |
| عدد النقاط | احتمالية الإصابة بالانصمام الرئوي[28] | نسبة احتمال الإصابة |
|---|---|---|
| >6 | عالي | (59%) |
| 2-6 | متوسط | (29%) |
| <2 | منخفض | (15%) |
- التفسير البديل
| عدد النقاط | احتمالية الإصابة بالانصمام الرئوي | الإجراء المتبع |
|---|---|---|
| >4 | الانصمام الرئوي محتمل | يجب إجراء الاختبارات التصويرية التشخيصية |
| 4 أو أقل | الانصمام الرئوي غير محتمل | يجب إجراء D-Dimer لنفي الانصمام الرئوي |
معايير استبعاد الانصمام الرئوي
تساعد معايير استبعاد الانصمام الرئوي (PERC) في تقييم الأشخاص المشتبه بإصابتهم بالانصمام الرئوي. على عكس معايير ويلز وجنيف، وهي قواعد تنبؤ سريري تهدف إلى تقسيم خطورة الإصابة عند الأشخاص المشتبه بهم، تم تصميم قاعدة PERC لاستبعاد الانصمام الرئوي لدى الأشخاص المصنفين كفئة منخفضة الخطورة.[36][38]
الأشخاص في هذه الفئة منخفضة الخطورة دون أي من هذه المعايير قد لا يحتاجون لمزيد من الاستقصاءات للانصمام الرئوي: إشباع الأكسجين منخفض SaO2 <95٪، تورم ساق أحادية الجانب، نفث دموي، التهاب وريد خثاري عميق أو انصمام رئوي سابق، جراحة أو رض حديث، العمر> 50، استخدام هرمونات، ومعدل ضربات قلب سريعة. الأساس المنطقي وراء هذا القرار هو أن إجراء مزيد من الاختبارات (تحديداً تصوير الأوعية المقطعية المحوسبة للصدر) قد يسبب ضرر أكبر (من التعرض للإشعاع والمواد الظليلة) وأكثر خطورة من الانصمام الرئوي.[39] لقاعدة PERC حساسية 97.4٪ ونوعية 21.9٪ مع نسبة سلبية كاذبة 1.0٪ (16/1666).[38]
الفحوصات المخبرية
عند وجود شك منخفض أو معتدل بالانصمام الرئوي، يعد تركيز D-dimer الطبيعي كافياً لاستبعاد احتمال وجود انصمام رئوي خثاري، مع وجود خطر لحوادث خثرية انصمامية لثلاثة أشهر بنسبة 0.14٪.[40] إن D-dimer حساس للغاية ولكنه غير نوعي (نوعيته حوالي 50٪). أي إن إيجابية D-dimer لا تعني بالضرورة وجود انصمام رئوي، لكن سلبية D-dimer هي مؤشر على غياب الانصمام الرئوي.[41] تعتبر الاحتمالية المنخفضة قبل الاختبار ذات قيمة في استبعاد الانصمام الرئوي.[42] الحد النموذجي للاختبار هو 500 ميكروغرام/لتر، على الرغم أن هذا يختلف حسب كل مخبر وحسب طريقة إجراء الاختبار.[43] ومع ذلك، في الأشخاص الذين تزيد أعمارهم عن 50 عاماً، يوصى بتغيير القيمة الحدية إلى (عمر الشخص مضروباً بـ 10 ميكروغرام/لتر) لأنها تقلل النتائج الإيجابية الكاذبة دون فقدان أي حالات من الانصمام الرئوي.[26][43][44]
عندما يُشتبه بالانصمام الرئوي، يجب إجراء العديد من اختبارات الدم من أجل استبعاد الأسباب الثانوية الهامة للانصمام الرئوي. يتضمن ذلك تعداد الدم الكامل وحالة التخثر (PT ،aPTT، TT) وبعض اختبارات المسح (سرعة ترسب الدم، وظائف الكلية، وظيفة الكبد، الشوارد). إذا كان أحد هذه التحاليل غير طبيعية، فإن ذلك يبرر إجراء مزيد من الاستقصاءات.[45]
تزداد مستويات التروبونين (16 و 47٪) عند مرضى الانصمام الرئوي.[46]
تشخيص شعاعي
في الأشخاص النموذجيين الذين لا يُعرف أنهم معرضون لخطر عالي للانصمام الرئوي، يكون التصوير مفيد لتأكيد أو استبعاد التشخيص بعد استخدام اختبارات الخط الأول البسيطة.[25][28][47] توصي الجمعيات الطبية باختبارات مثل D-dimer لتقديم دليل داعم للحاجة إلى التصوير، ويجرى التصوير إذا أكدت الاختبارات الأخرى احتمالاً متوسطاً أو مرتفعاً لوجود دليل يدعم تشخيص الانصمام الرئوي.[28][47] تصوير الأوعية الرئوية المقطعي المحوسب هو خط التصوير التشخيصي الأول الموصى به لمعظم الناس.[48] يمكن أن تؤكد الموجات فوق الصوتية للساقين وجود انصمام رئوي ولكنها لا تنفي ذلك.[49]
تصوير الأوعية الرئوية المقطعي المحوسب
هو تصوير الأوعية الرئوية باستخدام التصوير المقطعي المحوسب (CT) مع التباين الإشعاعي بدلاً من قسطرة القلب الأيمن. وتتمثل مزاياه في أنه دقيق، غير باضع، ومتوفر في كثير من الأحيان، ويمكنه تحديد أمراض الرئة الأخرى في حالة عدم وجود انصمام رئوي.
من الصعب تقييم دقة تصوير الأوعية الرئوية المقطعي المحوسب بسبب التغيرات السريعة في عدد صفوف الكشافات المتوفرة في أجهزة التصوير المقطعي المحوسب متعدد الكاشفات (MDCT).[50] في دراسة، وجد أن التصوير المقطعي المحوسب الحلزوني ذو الشريحة الواحدة قد يساعد في تشخيص الأشخاص المشكوك بإصابتهم بالانصمام الرئوي.[51] في هذه الدراسة كانت الحساسية 69% والنوعية 84%. في هذه الدراسة كانت نسبة الكشف عنها 32٪ ، القيمة التنبؤية الإيجابية 67.0٪، والقيمة التنبؤية السلبية 85.2٪. ومع ذلك، قد تكون نتائج هذه الدراسة متحيزة بسبب التحيز المحتمل في التضمين، لأن الفحص بالأشعة المقطعية كان أداة التشخيص النهائية للأشخاص الذين يعانون من الانصمام الرئوي. لاحظ المؤلفون أن التصوير المقطعي المحوسب ذو شريحة واحدة غير كافٍ لاستبعاد الانصمام الرئوي من تلقاء نفسه. أشارت دراسة منفصلة بمزيج من 4 شرائح و 16 ماسحة ضوئية إلى حساسية 83٪ ونوعية 96٪، مما يعني أنه اختبار جيد لاستبعاد الانصمام الرئوي إذا لم يُرى في التصوير وأنه جيد جداً في تأكيد الانصمام الرئوي إذا شوهد. لاحظت هذه الدراسة أن الاختبارات الإضافية ضرورية عندما يكون الاحتمال السريري غير متوافق مع نتائج التصوير.[52] لا يعد CTPA أدنى دقة من مسح VQ، ويحدد المزيد من الصمات مقارنة بمسح VQ.[53]
- في التصوير المقطعي المحوسب، يمكن تصنيف الصمات الرئوية وفقاً لمستوى الشجرة الشريانية.
- الصمات الرئوية المقطعية وتحت المقطعية في كلا الجانبين
- تصوير الأوعية الرئوية المقطعي المحوسب يُظهر "انصمام سرجي الشكل" عند تفرع الشريان الرئوي الرئيسي تأثير الجلطة في الشرايين الفُصَّية في كلا الجانبين.
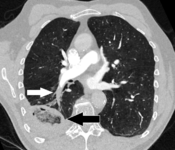
- الانصمام الرئوي (السهم الأبيض) الذي استمر لفترة طويلة وتسبب في احتشاء الرئة (السهم الأسود) يُنظر إليه على أنه علامة الهالة العكسية.
اختبار نسبة التهوية إلى التروية

(أ) بعد استنشاق 20 ميللي كوري من غاز زينون-133، تم الحصول على صور الومضان في الإسقاط الخلفي، والتي تُظهر التهوية الموحدة للرئتين.
(ب) بعد الحقن الوريدي لـ 4 ميللي كوري من الألبومين الموسوم بالتيكنيسيوم-99، تظهر الصور الومضانية هنا في الإسقاط الخلفي انخفاض النشاط في مناطق متعددة.
يُظهر اختبار نسبة التهوية إلى التروية (أو مسح V/Q أو التصوير الومضاني للرئة) أن بعض مناطق الرئة يتم تهويتها لكن لا يصلها الجريان الدموي (بسبب الانسداد بالجلطة).[17] يعد هذا النوع من الفحص بدقة التصوير المقطعي المحوسب متعدد الشرائح، لكنه أقل استخداماً، نظراً لتوافر تقنية التصوير المقطعي المحوسب بشكل أكبر. وهو مفيد بشكل خاص عند الأشخاص الذين يعانون من حساسية تجاه مواد التباين اليودية أو ضعف وظائف الكلى أو الحوامل (نظراً لانخفاض تعرضه للإشعاع مقارنةً بالتصوير المقطعي المحوسب).[54][55][56] يمكن إجراء الاختبار باستخدام التصوير ثنائي الأبعاد المستوي أو التصوير المقطعي المحوسب بإصدار فوتون واحد (SPECT) الذي يتيح التصوير ثلاثي الأبعاد. تعمل الأجهزة الهجينة التي تجمع بين (SPECT و CT) على تمكين التوصيف التشريحي لأي خلل.[57]
تصوير الأوعية الرئوية بالتنظير الفلوري
تاريخياً، كان المعيار الذهبي للتشخيص هو تصوير الأوعية الرئوية بالتنظير الفلوري، ولكنه لم يعد مستخدماً مع زيادة توافر التقنيات غير الغازية التي تقدم دقة تشخيصية مماثلة.[58]
إيكو القلب
في حالة الإصابة بصمة رئوية ضخمة وتحت ضخمة، يمكن ملاحظة خلل وظيفي في الجانب الأيمن من القلب عند إجراء الإيكو، وهو مؤشر على وجود انسداد شديد في الشريان الرئوي، والبطين الأيمن (الذي يضخ الدم بضغط منخفض) غير قادر على مطابقة الضغط. تشير بعض الدراسات إلى أن هذا قد يكون مؤشر على انحلال الخثرة. لا يحتاج كل شخص يشتبه بإصابته بانصمام رئوي إلى إجراء إيكو قلب، ولكن قد يشير الارتفاع في التروبونينات القلبية أو الببتيد المدر للصوديوم الدماغي إلى إجهاد القلب ويستدعي إجراء إيكو قلب،[59] ويكون مهماً في التشخيص.[60]
يشار إلى المظهر المحدد للبطين الأيمن في إيكو القلب بعلامة مكونيل (McConnell's sign) وهي تعذر الحركة للجدار نصف الحر للبطين الأيمن مع وجود حركة طبيعية للقمة.[61] هذه الظاهرة لها حساسية 77٪ ونوعية 94٪ لتشخيص الانسداد الرئوي الحاد في حالة ضعف البطين الأيمن.[61]
- إيكو قلب يظهر علامات الانصمام الرئوي[62]
اختبارات غير تشخيصية
الاختبارات التشخيصية ذات الاحتمالية المنخفضة أو الاختبارات غير التشخيصية هي اختبارات تجرى بشكل متكرر لكنها لا تعتبر حساسة للانصمام الرئوي، ولكن يمكن أن تكون تشخيصية.
- غالباً ما يتم إجراء صورة بسيطة للصدر عند الأشخاص الذين يعانون من زلة تنفسية للمساعدة في استبعاد الأسباب الأخرى، مثل قصور القلب الاحتقاني وكسر ضلع. نادراً ما تكون الصورة البسيطة للصدر طبيعية في الانصمام الرئوي،[63] ولكنها تفتقر عادةً إلى العلامات التي تشير إلى تشخيص الانصمام الرئوي (على سبيل المثال، علامة ويسترمارك، سنام "حدبة" هامبتون).
- التصوير بالموجات فوق الصوتية للساقين، المعروف أيضاً باسم دوبلر الساق، بحثاً عن خثار وريدي عميق (DVT). إن وجود خثار وريدي عميق بحد ذاته كافٍ لاستخدام مميعات الدم، دون الحاجة إلى فحوصات V/Q أو التصوير المقطعي الحلزوني (بسبب الارتباط القوي بين DVT و PE). قد تكون هذه مقاربة جيدة في الحمل، حيث تزيد الطرائق الأخرى خطر حدوث عيوب خلقية في الجنين. ومع ذلك، فإن الفحص السلبي لا يستبعد الانصمام الرئوي، وقد تكون هناك حاجة لفحص بجرعة منخفضة من الإشعاع إذا اُعتبرت الأم معرضة لخطر الإصابة بالانصمام الرئوي. ولذلك فإن الاستخدام الرئيسي لإيكو للساقين هو للأشخاص الذين يعانون من أعراض سريرية توجه لخثار وريدي عميق.[56]
تخطيط القلب الكهربائي

الاستخدام الأساسي لتخطيط القلب الكهربائي هو استبعاد الأسباب الأخرى لألم الصدر.[64] يتم إجراء تخطيط القلب الكهربائي (ECG) بشكل روتيني للأشخاص الذين يعانون من آلام صدرية لتشخيص سريع لاحتشاء عضلة القلب (النوبات القلبية)، وهو تشخيص تفريقي هام للألم الصدري. في حين قد تحدث تغيرات معينة في تخطيط القلب عند مرضى الانصمام الرئوي، إلا أنه لا توجد تغيرات نوعية بما يكفي للتأكيد أو حساسة بدرجة كافية لاستبعاد التشخيص.[64] قد يُظهر تخطيط القلب علامات إجهاد القلب الأيمن أو قلب رئوي حاد في حالات الصمات الرئوية الكبيرة - العلامات الكلاسيكية هي موجة S كبيرة في المسرى I، وموجة Q عميقة في المسرى III، وانقلاب موجة T في المسرى III، يُرمز لهذه التغيرات بـ (S1Q3T3). وهي تحدث في 12-50٪ من الأشخاص المشخصين، ولكنها تحدث أيضاً في 12٪ بدون انصمام رئوي.[65][66]قد تحدث هذه التغيرات أيضاً في حالات رئوية حادة أخرى، وبالتالي فإن لها قيمة تشخيصية محدودة. العلامات الأكثر شيوعاً في تخطيط القلب هي تسرع القلب الجيبي، انحراف المحور للأيمن، وحصار الحزمة اليمنى.[67] ومع ذلك، لا يزال تسرع القلب الجيبي موجوداً فقط في 8-69٪ من الأشخاص المصابين بالانصمام الرئوي.[68]
قد تشير علامات الانصمام الرئوي على تخطيط القلب إلى إنذار أسوأ بما أن الموجودات الست المرتبطة بإجهاد البطين الأيمن على التخطيط (معدل ضربات القلب> 100 نبضة في الدقيقة، S1Q3T3، موجات T معكوسة في المساري V1-V4، ارتفاع قطعة ST في aVR، حصار غصن أيمن تام، والرجفان الأذيني) تترافق مع زيادة خطر الإصابة بصدمة دورانية والموت.[69]
يشتبه بالانصمام الرئوي أو احتشاء عضلة قلبية سفلي في حال وجود موجة T منقلبة في المساري V1-3. تظهر حالات الانصمام الرئوي انقلاب موجات T في المساري II و aVF، بينما لا يظهر احتشاء عضلة القلب السفلية موجات T منقلبة في II و aVF.[70]
العلاج
العلاج المضاد للتخثر هو الدعامة الأساسية للعلاج. بشكل حاد، قد تكون هناك حاجة إلى علاجات داعمة، مثل الأكسجين أو التسكين. غالباً ما يُقبل المرضى في المستشفى في المراحل المبكرة من العلاج، ويبقون مستشفيين حتى يصل INR إلى المستويات العلاجية (إذا تم استخدام الوارفارين). ومع ذلك، يمكن علاج الحالات منخفضة الخطورة في المنزل بشكل مشابه لعلاج الإصابة بالخثار الوريدي العميق.[71][72] الأدلة لدعم مقاربة واحدة ضعيفة.[73]
مضادات التخثر
العلاج المضاد للتخثر هو الدعامة الأساسية للعلاج. لسنوات عديدة، كانت مضادات فيتامين ك (الوارفارين أو أقل شيوعاً أسينوكومارول أو فينوبروكومون) هي حجر الزاوية في العلاج. نظراً لأن مضادات فيتامين ك لا تعمل على الفور، فإن العلاج الأولي يكون بمضادات التخثر القابلة للحقن سريعة المفعول: الهيبارين غير المجزأ (UFH) أو الهيبارين منخفض الوزن الجزيئي (LMWH) أو فوندابارينوكس، في حين يتم البدء بمضادات فيتامين K الفموية ومعايرتها (عادةً كجزء من العلاج للمرضى المستشفيين) عبر النسبة المعيارية الدولية INR، وهو اختبار يحدد الجرعة.[5] فيما يتعلق بالعلاجات القابلة للحقن، قد يقلل الهيبارين منخفض الوزن الجزيئي من احتمال حدوث النزف عند الأشخاص المصابين بالانصمام الرئوي مقارنةً بالهيبارين غير المجزأ.[74] وكذلك قلل الهيبارين منخفض الوزن الجزيئي من تكرر الخثار وقلل حجم الخثرة مقارنةً بالهيبارين. لم يكن هناك فرق في معدل الوفيات الإجمالي بين المعالجين بالهيبارين المنخفض الوزن منخفض الوزن الجزيئي والمعالجين بالهيبارين غير المجزأ.[74] تتطلب مضادات فيتامين ك تعديل الجرعة بشكل متكرر ومراقبة النسبة المعيارية الدولية (INR). في الانصمام الرئوي، تعتبر قيم INR بين 2.0 و 3.0 مثالية بشكل عام.[5] في حالة حدوث نوبة أخرى من الانصمام الرئوي أثناء العلاج بالوارفارين، يمكن زيادة نافذة INR على سبيل المثال 2.5-3.5 (ما لم تكن هناك مضادات استطباب) أو يمكن تغيير مانع التخثر إلى نوع آخر مثل الهيبارين منخفض الوزن الجزيئي.[5] في السنوات الأخيرة، قُدِّمت العديد من مضادات التخثر الشبيهة بالوارفارين لكنها لا تحتاج لمعايرة INR. تُعرف باسم مضادات التخثر الفموية مباشرة التأثير، وحالياً تفضل هذه العلاجات على مضادات فيتامين K وفقاً للإرشادات المهنية الأمريكية.[5] اثنان منها (ريفاروكسابان وأبيكسابان) لا يتطلبان علاجاً أولياً بالهيبارين أوفوندابارينكس، على خلاف دابيغاتران وإيدوكسابان.[5] وجدت مراجعة كوكرين أنه لا يوجد دليل على وجود فرق بين مانعات التخثر مباشرة التأثير الفموية (ريفاروكسابان، أبيكسابان، دابيغاتران، وإيدوكسابان) ومانعات التخثر القياسية في الوقاية من الانصمام الرئوي المتكرر.[75]
عند مرضى السرطان الذين أصيبوا بانصمام رئوي، يُفضل العلاج بكورس من الهيبارين المنخفض الوزن الجزيئي على العلاج بالوارفارين أو مضادات التخثر الفموية الأخرى.[5][76] وبالمثل، تُعالج النساء الحوامل باستخدام الهيبارين منخفض الوزن الجزيئي إلى ما بعد الولادة لتجنب تأثيرات الوارفارين المشوهة للجنين، خاصة في المراحل الباكرة من الحمل، ولكن يمكن استخدامه أثناء الرضاعة الطبيعية.[56]
عادة ما يستمر العلاج بمضادات التخثر لمدة 3-6 أشهر أو «مدى الحياة» إذا كان هناك حالات سابقة لخثار وريدي عميق أو انصامات رئوية أو لم يكن هناك أي من عوامل الخطر العابرة المعتادة.[5][76] بالنسبة للمرضى بدون سبب معروف يمكن عكسه، قد يكون العلاج لمدة عامين أفضل من 6 أشهر.[77] بالنسبة للمرضى المصابين بصمات رئوية صغيرة (المعروفة باسم انصمامات رئوية تحت قطعية)، فإن التأثيرات المانعة للتخثر غير معروفة لأنه لم يتم دراستها بشكل كافي حتى عام 2020.[78]
حل الخثرات
يعتبر الانصمام الرئوي الضخم سبباً لعدم الاستقرار الهيموديناميكي (صدمة و/أو انخفاض ضغط الدم، والذي يُعرَّف على أنه ضغط دم انقباضي أقل من 90 ملم زئبق أو انخفاض ضغط قدره 40 ملم زئبقي لمدة> 15 دقيقة إذا لم يكن بسبب لا نظميات قلبية، نقص حجم الدم أو إنتان دم) وهو استطباب لحل الخثرة، وهو التحطيم الأنزيمي للخثرة بالأدوية. في هذه الحالة، يُعد أفضل علاج متاح لمن ليس لديهم مضادات استطباب.[29][76][79] كما يوصى به أيضاً للمرضى الذين عانوا من توقف قلب مع انصمام رئوي معروف.[80] إن حل الخثرة الموجه بالقسطرة (CDT) هو تقنية جديدة ثبت أنها آمنة وفعالة نسبياً للصمات الرئوي الضخمة. يتضمن ذلك الوصول إلى الجهاز الوريدي عن طريق وضع قسطرة في وريد في المنطقة الإربية وتوجيهه عبر الأوردة باستخدام التصوير التنظيري حتى يصل بجوار الانصمام الرئوي في الدورة الدموية الرئوية. يتم إطلاق أدوية تحطم الخثرات من خلال القسطرة بحيث يكون أعلى تركيز لها بجوار الصمة الرئوية مباشرة. يتم إجراء CDT من قبل أخصائي الأشعة التداخلية أو جراحي الأوعية الدموية، وفي المراكز الطبية التي تقدم CDT، يمكن جعله كخط أول في العلاج.[81] يتم فحص تحلل الخثرة بمساعدة الموجات فوق الصوتية باستخدام القسطرة.[82]
لا يزال استخدام حل الخثرات في الصمات الرئوية غير الضخمة محل نقاش.[83][84] وجد البعض أن العلاج يقلل من خطر الموت ويزيد خطر النزف بما في ذلك النزف داخل القحف.[85] بينما لم يجد آخرون أي انخفاض في خطر الموت.[84]
مرشح الوريد الأجوف السفلي

هناك حالتان يُعتبر فيهما مرشح الوريد الأجوف السفلي مفيداً، وهما في حال وجود مضاد استطباب للعلاج بمضادات التخثر (على سبيل المثال بعد فترة قصيرة من إجراء عملية جراحية كبيرة)، أو في حال حدوث انصمام رئوي عند مريض موضوع أساساً على مضادات التخثر.[76] في هذه الحالات، قد يتم زرعها لمنع دخول خثرات من خثار وريدي عميق إلى الشريان الرئوي والمساهمة بزياددة الانسداد الموجود أصلاً.[76] على الرغم من الميزة النظرية للجهاز في منع الصمات الرئوية، إلا أن هناك نقص في الأدلة التي تدعم فعاليته.[86]
يتم وضع المرشح عادة من خلال الولوج عبر الوريد الوداجي أو الوريد الفخذي ويتم تثبيت المرشح عادة في الوريد الأجوف السفلي قبل نقطة الالتقاء مع الوريد الكلوي.[87]يجب إزالة مرشحات الوريد الأجوف السفلي بمجرد القدرة على البدء باستخدام مضادات التخثر.[76] على الرغم من أن الفلاتر الحديثة من المفترض أن تكون قابلة للاسترداد، إلا أن المضاعفات قد تمنع إزالة بعضها. لا يُعرف الأمان طويل الأمد من ترك المرشح بشكل دائم في الجسم.[61]
التداخل الجراحي
التدبير الجراحي للانصمام الرئوي الحاد (استئصال خثرة رئوية) غير شائع وقد تم التخلي عنه إلى حد كبير بسبب النتائج السيئة على المدى الطويل. ومع ذلك، في الآونة الأخيرة، فقد ظهرت مجدداً مع مراجعة التقنية الجراحية ويعتقد أنها تفيد بعض الناس.[88] يتم علاج الانصمام الرئوي المزمن المؤدي إلى ارتفاع ضغط الدم الرئوي (المعروف باسم ارتفاع ضغط الدم الانصمامي الخثاري المزمن) بإجراء جراحي يُعرف باسم استئصال خثرة الشريان الرئوي وبطانته.[89]
الوقاية من الانصمام الرئوي
من الممكن الوقاية من الانصمام الرئوي عند الأشخاص مع عوامل خطر. قد يتلقى الأشخاص المستشفيين أدوية وقائية، تتضمن الهيبارين غير المجزأ، والهيبارين منخفض الوزن الجزيئي (LMWH) أو فوندابارينوكس، واستخدام الجوارب المضادة للتخثر لتقليل خطر الإصابة بخثار الأوردة العميقة في الساق التي قد تنفصل وتهاجر إلى الرئتين.[90]بعد الانتهاء من التمييع في الأشخاص الذين يعانون من انصمام رئوي سابق، يكون استخدام الأسبرين على الأمد الطويل مفيد لمنع تكرار حدوثه.[5]
وبائياً
هناك ما يقرب من 10 ملايين حالة انصمام رئوي سنوياً.[24] في الولايات المتحدة، يعد الانصمام الرئوي السبب الرئيسي لما لا يقل عن 10.000 إلى 12.000 حالة وفاة سنوياً وسبباَ مساهماً في ما لا يقل عن 30.000 إلى 40.000 حالة وفاة سنوياً.[9] إن نسبة حدوث الانصمام الرئوي الحقيقية غير معروفة لأنها في كثير من الأحيان لا يتم تشخيصها أو ملاحظتها إلى أن تُشرَّح الجثة.[24] من عام 1993 إلى عام 2012، كان هناك عدد متزايد من حالات الاستشفاء بسبب الانصمام الرئوي، حيث زادت من 23 حالة لكل 100.000 شخص إلى 65 حالة لكل 100.000 شخص.[24] على الرغم من هذه الزيادة، كان هناك انخفاض في معدل الوفيات خلال نفس الفترة الزمنية بسبب التطورات الطبية التي حدثت.[24]
الانصمام الخثري الوريدي (VTE)، عامل خطر شائع، يوجد بمعدلات أعلى بكثير لدى الأشخاص الذين تزيد أعمارهم عن 70 عاماً (أعلى بثلاث مرات مقارنة بالأعمار بين 45 إلى 69).[24] من المحتمل أن يكون هذا بسبب انخفاض مستوى النشاط بشكل عام بين المسنين، مما يؤدي إلى ارتفاع معدلات عدم الحركة والسمنة.[24] إن الانصمام الخثري الوريدي له معدل وفيات كبير ومتزايد باستمرار.[24] تبلغ هذه النسبة 10٪ تقريباً بعد 30 يوم، و15٪ بعد ثلاثة أشهر وتصل إلى 20٪ بعد عام واحد.[24] الانصمام الرئوي وحده (عندما يحدث نتيجة الاستشفاء) له معدل وفيات من حوالي 5٪ إلى 10٪ لذلك يمكن أن يلعب الانصمام الخثاري الوريدي عاملاً كبيراً في شدة الانصمام.[24]
عند النظر في جميع الحالات، انخفض معدل الصمات الرئوية القاتلة من 6٪ إلى 2٪ خلال الـ 25 عاماً الماضية في الولايات المتحدة.[91] في أوروبا، تم الإبلاغ عن ما يقرب من 40.000 حالة وفاة سنوياً بسبب الانصمام الرئوي باعتباره السبب الرئيسي بين عامي 2013 و2015، وهو تقدير متحفظ بسبب قلة احتمالية التشخيص.[92]
الإنذار

أقل من 5 إلى 10٪ من الانصمام الرئوي العرضي قاتل خلال الساعة الأولى من الأعراض.[80][93] هناك العديد من العلامات المستخدمة في تصنيف الخطورة وهي أيضاً مشعرات للإنذار السيئ تشمل انخفاض ضغط الدم، الصدمة القلبية، الإغماء، ودليل على ضعف القلب الأيمن، وارتفاع الإنزيمات القلبية.[29] بعض التغيرات في تخطيط القلب الكهربائي بما في ذلك S1Q3T3 ترتبط أيضاً بإنذار أسوأ على المدى القصير.[21] هناك عوامل أخرى مرتبطة بالمريض مثل الداء الرئوي الانسدادي المزمن وقصور القلب المزمن يعتقد أنها تلعب دوراً في الإنذار.[29]
يعتمد الإنذار على حجم الإصابة الرئوية وعلى وجود أمراض أخرى مرافقة، يمكن أن يؤدي الانصمام المزمن للرئة إلى ارتفاع ضغط الدم الرئوي. بعد الانصمام الرئوي الضخم، يجب حل الصمة بطريقة ما إذا كان المريض سيبقى على قيد الحياة. في حالة الانصمام الرئوي الخثاري، يمكن تحطيم الجلطة الدموية عن طريق انحلال الفبرين أو يمكن إعادة الاسْتِقْناء بحيث تتشكل قناة جديدة من خلال الجلطة. يجب استعادة تدفق الدم بأسرع ما يمكن في أول يوم أو يومين بعد الانصمام الرئوي[94] إذ يتباطأ التحسن بعد ذلك وقد يحدث عجز دائم. هناك جدل حول ما إذا كانت الصمات الرئوية صغيرة الحجم تحتاج إلى علاج على الإطلاق[95] وهناك بعض الأدلة على أن المرضى الذين يعانون من الانصمام الرئوي تحت القطاعي قد يكونون بصحة جيدة دون علاج.[52][96]
بمجرد إيقاف مضادات التخثر، فإن خطر الإصابة بانصمام رئوي مميت هو 0.5٪ سنوياً.[97] في دراسة نشرت في عام 1960 من قبل باريت وجوردان، والتي قارنت بين استخدام مانعات التخثر والدواء الغُفْل لعلاج الانصمام الرئوي فإن معدل الوفيات من PEs غير المعالجة يصل إلى 26٪. أجرى باريت وجوردان دراستهما في مستشفى بريستول الملكي عام 1957.[98] هذه الدراسة هي التجربة الوحيدة على الإطلاق المضبوطة بالغُفْل لفحص دور مضادات التخثر في العلاج، وكانت نتائجها مقنعة لدرجة أن التجربة لم تتكرر أبداً لأن القيام بذلك سيعتبر غير أخلاقي. إن معدل الوفيات 26٪ المبلغ عنه في مجموعة الدواء الغفل ربما يكون مبالغ به، بالنظر إلى أن التكنولوجيا الحالية قدرت هذه النسبة في الانصمام الرئوي الشديد فقط.[99]
توقع الوفيات
يمكن لـ PESI و sPESI تقدير معدل وفيات المرضى. تُستخدم معايير جنيف ومعايير ويلز لحساب احتمالية الإصابة بالانصمام الرئوي قبل إجراء الاختبارات. هذه المعايير هي أدوات تستخدم مع المقاربة السريرية في تحديد الاختبارات التشخيصية وأنواع العلاج.[100] تشتمل خوارزمية PESI على 11 متغير سريري متاح بشكل روتيني.[101] وتصنف الأشخاص في واحد من خمسة تصانيف (I-V)، مع معدل وفيات لمدة 30 يوماً تتراوح من 1.1٪ إلى 24.5٪. إذ يعتبر المرضى في الفئتين الأولى والثانية ذوي خطورة منخفضة أما في الفئتين الثالثة إلى الخامسة ذوي خطورة عالية.[101]