2-Methyltetrahydrofuran
2-Methyltetrahydrofuran (2-MTHF) ist ein organisches Lösungsmittel und gehört zur Stoffklasse der cyclischen Ether.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Strukturformel ohne Stereochemie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2-Methyltetrahydrofuran | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C5H10O | ||||||||||||||||||
| Kurzbeschreibung | farblose Flüssigkeit mit etherischem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 86,13 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | flüssig | ||||||||||||||||||
| Dichte | 0,85 g·cm−3 (Racemat)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | 80 °C (Racemat)[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Brechungsindex | 1,4059 (21 °C)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | 4500 mg·kg−3 (LD50, Kaninchen, transdermal)[4] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Gewinnung und Darstellung
2-Methyltetrahydrofuran entsteht als Nebenprodukt bei der industriellen Produktion von Furfurylalkohol aus Furfural.[5] Es kann auch durch eine Nickel-katalysierte Hydrierung von 2-Methylfuran hergestellt werden.[5] Dieses kann aus dem durch Aufarbeitung pflanzlicher Pentosen zugänglichen Furfural gewonnen werden, so dass die Herstellung von 2-Methyltetrahydrofuran insgesamt aus nachwachsenden Rohstoffen erfolgen kann.
Ein neueres Verfahren geht über die Zyklisierung und Hydrierung von Levulinsäure, die ebenfalls aus Kohlenhydraten gewonnen werden kann.[5][6]Alle kommerziellen Herstellprozesse ergeben das Racemat. Eine Enantiomerentrennung kann chromatographisch an chiralen stationären Phasen mit überkritischen Medien erfolgen.[7][8] Die Synthese des (S)-(+)-2-Methyltetrahydrofurans gelingt durch die Hydrierung von 2-Methylfuran mittels chiraler Rhodiumkomplex-Katalysatoren.[9]
Eigenschaften
Stereochemie
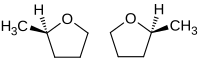
Die Verbindung enthält ein Stereozentrum und kann somit in Form zweier Enantiomere auftreten. Praktische Bedeutung hat allerdings nur das Racemat.
- (R)-Enantiomer (links), (S)-Enantiomer (rechts)
Physikalische Eigenschaften
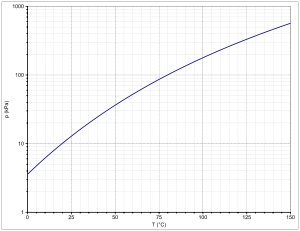
2-Methyltetrahydrofuran ist eine farblose, niedrigviskose Flüssigkeit mit charakteristischem Geruch. Der Siedepunkt bei Normaldruck beträgt 80,3 °C. Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in kPa, T in °C) mit A = 5,95009, B = 1175,51 und C = 217.80.[10][11] Die folgende Tabelle gibt einen Überblick über wichtige thermodynamische Eigenschaften.
Zusammenstellung der wichtigsten thermodynamischen Eigenschaften Eigenschaft Typ Wert [Einheit] Bemerkungen Wärmekapazität cp 156,89 J·mol−1·K−1 (25 °C)[12]
1,82 J·g−1·K−1 (25 °C)[12]Kritische Temperatur Tc 537 K[13][14] Kritischer Druck pc 37,6763 bar[13][14] Kritisches Volumen Vc 0,267 l·mol−1[13][14] Kritische Dichte ρc 0,3226 g·ml−1[14] Azentrischer Faktor ωc 0,300[14] Verdampfungsenthalpie ΔVH0
ΔVH34,0 kJ·mol−1[15]
30,43 kJ·mol−1[16]
am Siedepunkt
Die Temperaturabhängigkeit der Verdampfungsenthalpie lässt sich entsprechend der vereinfachten Watsongleichung ΔVH=A·(1−Tr)n (ΔVH in kJ/mol, Tr =(T/Tc) reduzierte Temperatur) mit A = 45,7503 kJ/mol, n = 0,38 und Tc = 537,0 K im Temperaturbereich zwischen 136 K und 537 K beschreiben.[16]
Mit einem Wassergehalt von 10,6 Ma% bildet die Verbindung ein bei 71 °C siedendes Azeotrop. Weitere azeotrop siedende Gemische werden mit Methanol, Ethanol, 1-Propanol und 2-Propanol gebildet.[2]
| Azeotrope mit verschiedenen Lösungsmitteln[2] | ||||||||||||
| Lösungsmittel | Methanol | Ethanol | 1-Propanol | 2-Propanol | Wasser | |||||||
| Gehalt Methyltetrahydrofuran | in Ma% | 43 | 66 | 99 | 82 | 89,4 | ||||||
| Siedepunkt | in °C | 62,8 | 74,4 | 79,5 | 77 | 71 | ||||||
Bei 20 °C lösen sich in 100 g Wasser 14 g Methyltetrahydrofuran, umgekehrt lösen sich 4 g Wasser in 100 g Methyltetrahydrofuran.[2] Die Löslichkeit von Wasser in 2-Methyltetrahydrofuran ändert sich nur wenig mit steigender Temperatur. Dagegen sinkt die Löslichkeit von Methyltetrahydrofuran in Wasser mit steigender Temperatur.[17]
| Löslichkeiten im System 2-Methyltetrahydrofuran - Wasser[18][17] | ||||||||||||
| Temperatur | in °C | 0,0 | 9,5 | 19,3 | 29,5 | 39,6 | 50,1 | 60,7 | 70,6 | |||
| Löslichkeit von Wasser in Methyltetrahydrofuran | in Ma% | 4,0 | 4,1 | 4,1 | 4,2 | 4,3 | 4,4 | 4,6 | 5,0 | |||
| Löslichkeit von Methyltetrahydrofuran in Wasser | in Ma% | 21,0 | 17,8 | 14,4 | 11,4 | 9,2 | 7,8 | 6,6 | 6,0 | |||
Sicherheitstechnische Kenngrößen
2-Methyltetrahydrofuran bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt unterhalb von −12 °C.[19][1] Der Explosionsbereich liegt zwischen 1,5 Vol.‑% als untere Explosionsgrenze (UEG) und 8,9 Vol.‑% als obere Explosionsgrenze (OEG).[20][17] Eine Korrelation der Explosionsgrenzen mit der Dampfdruckfunktion ergibt einen unteren Explosionspunkt von −15 °C sowie einen oberen Explosionspunkt von 18 °C. Die Sauerstoffgrenzkonzentration liegt bei 100 °C bei 9,4 Vol%.[21] Die Zündtemperatur beträgt 270 °C.[20][17] Der Stoff fällt somit in die Temperaturklasse T3.
Chemische Eigenschaften
2-Methyltetrahydrofuran neigt in Gegenwart von Luft wie viele andere Ether zur Bildung von Peroxiden.[1] Die Geschwindigkeit der Peroxidbildung ist ähnlich der von Tetrahydrofuran.[2] Das handelsübliche Produkt enthält Butylhydroxytoluol als Stabilisator. Gegenüber Säuren ist es wesentlich stabiler als Tetrahydrofuran.[2]
Verwendung
2-Methyltetrahydrofuran wird als Lösungsmittelaltenative zum Tetrahydrofuran besonders bei metallorganischen Reaktionen gesehen.[2] Zum einen besitzt es auch bei niedrigen Temperaturen wie −70 °C mit 1,85 cp eine niedrige Viskosität[22], zum anderen kann der Temperaturbereich bis zum höheren Siedepunkt von 80 °C genutzt werden.[2] Da die Verbindung beim Abkühlen unterhalb des Schmelzpunktes glasartig erstarrt, kann es als Lösungsmittel bei spektroskopischen Untersuchungen bei −196 °C genutzt werden.[23] Eine Verwendung als Verschnittkomponente in Motorenbenzin wurde in den USA erfolgreich getestet.[11] In der organischen Chemie wird es als Reaktant für die Herstellung N-substituierter 2-Methylpyrrolidine verwendet.[11]