Die Familie Adenoviridae (von altgriechisch ἀδήν ‚Drüse‘) oder Adenoviren (Einzahl: Adenovirus) umfasst unbehüllte Viren mit einer doppelsträngigen, linearen DNA (Desoxyribonukleinsäure) als Genom. Ihr Kapsid hat eine ikosaedrische Symmetrie und besitzt einen besonderen, die Virusfamilie charakterisierenden Aufbau aus Penton- und Hexon-Kapsomeren. An den Pentonen sind typische, antennenartige Fiberproteine verankert, die den Virionen der Familie ihr „satellitenartiges“ Erscheinungsbild geben. Die Familie beinhaltet derzeit 47 human- und tierpathogene Virusspezies mit zahlreichen Subtypen bei Säugetieren, Vögeln, Reptilien und Fischen. Beim Menschen verursachen die humanen Adenoviren überwiegend Erkrankungen der Atemwege.
| Adenoviridae | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Adenoviridae | ||||||||||||||
| Systematik | ||||||||||||||
| ||||||||||||||
| Taxonomische Merkmale | ||||||||||||||
| ||||||||||||||
| Wissenschaftlicher Name | ||||||||||||||
| Adenoviridae | ||||||||||||||
| Links | ||||||||||||||
|
Die ersten Adenoviren wurden 1953 von einer Arbeitsgruppe um Wallace P. Rowe und Robert J. Huebner aus Tonsillen und anderem adenoidem Drüsengewebe von Kindern isoliert und in einer Zellkultur vermehrt.[2][3] Diese unter anderem bei Erkältungskrankheiten vorgefundenen Viren wurden auch als Adenoidal-Pharyngeal-Conjunctival-Viren (APC-Viren) und Adenoid Degeneration Agents (A-D-Agents, im Deutschen AD-Agens) bezeichnet, da sie in adenoidem Gewebe nekrotische Veränderungen verursachen.[4]
In der Geschichte der Molekularbiologie spielen die Adenoviridae eine bedeutende Rolle, da bei ihnen 1977 ein grundlegender Prozess der Genexpression entdeckt wurde, das so genannte Spleißen. In der Gentechnik und der virologischen Forschung sind Adenoviren für das Einschleusen von DNA als viraler Vektor in Zellen und Organismen von gewisser Bedeutung.
Morphologie

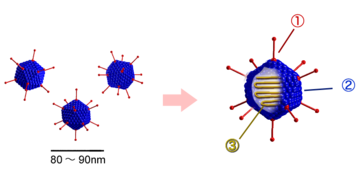
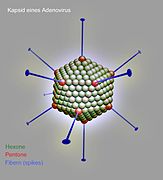
Die unbehüllten Kapside der Adenoviridae sind zwischen 70 und 90 nm im Durchmesser groß und bestehen aus 252 Kapsomeren. Von diesen Kapsomeren existieren zwei unterschiedliche Typen: 12 der sogenannten Pentone und 240 der Hexone. Die Hexone (8–10 nm) bestehen aus einem Trimer des Hexonproteins (Virusprotein II, Molekülmasse 120 kDa) und sind bei Mitgliedern der Gattung Mastadenovirus durch weitere hexonassoziierte Proteine an ihren Kontaktstellen stabilisiert (VP IX, X, XI). An der Innenseite der Hexone befinden sich zwei weitere Proteine (VP VI und VIII), die gleichzeitig mit Proteinen des innersten Nukleoproteinkomplexes interagieren. Das VP VI befindet sich in ringförmiger Anordnung nur an den fünf Hexonen, die jeweils um ein Penton gelagert sind.
Die Pentone befinden sich an den Ecken der ikosaedrischen Symmetrie (an den Achsenpunkten der fünfstrahligen Symmetrieachse) und bestehen aus einem Pentamer des Pentonbasisproteins (VP III, 80 kDa) und dem pentonbasisassoziierten Protein (VP IIIa, 66 kDa). An den Pentonen setzen die – je nach Spezies zwischen 9 und 77,5 nm langen – Fibern (spikes) an, die aus Trimeren des glykosylierten Fiberproteins (VP IV, 62 kDa) zusammengesetzt sind. Innerhalb der Gattung Aviadenovirus bestehen die Fibern aus zwei unterschiedlichen Fiberproteinen.
Das Fiberprotein vermittelt die Bindung an die Oberfläche der Wirtszelle und induziert die gruppenspezifischen Antikörper. Einen Nachteil von unbehüllten Viren gegenüber behüllten können die Adenoviren daher aufgrund der Fiberstruktur umgehen: Eine Anpassung an einen neuen Wirt oder eine neue Zielzelle (damit einem neuen Rezeptor) können unbehüllte Viren gewöhnlich nur durch Mutationen ihrer äußersten Kapsidproteine realisieren; diese Mutationen können jedoch zu einer Instabilität des Kapsids oder dem vollständigen Verlust seiner Verpackungsfähigkeit führen. Die Adenoviren haben hingegen die Möglichkeit, neue Varianten allein durch Mutationen der Fiberstrukturen zu entwickeln und das komplexe Kapsid unverändert beizubehalten.
Das Innere (Core) der Adenoviren ist von einem Nukleoproteinkomplex angefüllt, der aus dem doppelsträngigen, linearen DNA-Genom besteht, an das die basischen Proteine VP VII und X (bei der Gattung Mastadenovirus zusätzlich VP V) angelagert sind. Zusätzlich befindet sich an beiden 5’-Enden der dsDNA ein kovalent gebundenes Protein, das sogenannte Terminale Protein (TP).


Das Genom ist zwischen 26 und 45 kBp lang und enthält an beiden Enden repetitive Sequenzen, die so genannten ITRs (Inverted terminal repeats). Innerhalb der Familie ist der zentrale Anteil des Genoms, der überwiegend für die Strukturproteine des Kapsids codiert, sehr konserviert. Die Gattungen unterscheiden sich jedoch wesentlich in der DNA-Sequenz und deren Genprodukte an den Enden des Genoms.
- Virion eines Adenovirus
- Struktur der Adenoviren
- Kapsid eines Adenovirus
- Schemazeichnung eines Adenovirus
Systematik
Die Systematik nach ICTV (Stand November 2018) beinhaltet u. a. folgende Spezies:
- Genus Atadenovirus[5]
- Bovine atadenovirus D bei Rindern
- Possum atadenovirus A beim Opossum
- Ovine atadenovirus D bei Schafen (mit Goat adenovirus 1 alias Caprine adenovirus type 1)
- Deer atadenovirus A beim Reh
- Lizard atadenovirus A bei Bartagamen, Chamäleon, Gecko
- Snake atadenovirus A bei Schlangen
- Psittacine atadenovirus A bei Papageien
- Duck atadenovirus A bei Enten
- Genus Aviadenovirus[6]
- Fowl aviadenovirus A – E (Geflügeladenoviren) bei Gänse- und Hühnervögeln
- Goose aviadenovirus A bei Gänsen
- Duck aviadenovirus B bei Enten
- Pigeon aviadenovirus A und B bei Tauben
- Falcon aviadenovirus A bei Falken
- Psittacine aviadenovirus B bei Papageien
- Turkey aviadenovirus B bis D bei Truthühnern
- Genus Ichtadenovirus[7]
- Sturgeon ichtadenovirus A alias White sturgeon adenovirus beim Weißen Stör
- Genus Mastadenovirus
- Human mastadenovirus A bis F (HAdV-A bis HAdV-F) beim Menschen
- Bovine mastadenovirus A bis C bei Rindern
- Canine mastadenovirus A[8]
- Equine mastadenovirus A bei Pferden
- Guinea pig mastadenovirus A (mit Guinea pig adenovirus 1), bei Meerschweinchen
- Ovine mastadenovirus A und B bei Schafen
- Ovine mastadenovirus C (Ovine adenovirus 8, OAdV-8) bei Schafen[9]
- Porcine mastadenovirus A bei Schweinen
- Simian mastadenovirus A bei Affen
- Tree shrew mastadenovirus A (mit Tree shrew adenovirus 1), bei Tupaias
- „Caprine adenovirus“ (Vorschlag, mit Goat adenovirus 2, GAdV-2) bei Ziegen[9]
- „Guinea pig adenovirus 2“ (Vorschlag), bei Meerschweinchen
- ohne Zuordnung zu einer Spezies (Ovine adenovirus 6 bei Schafen[9])
- Genus Siadenovirus[10]
- Frog siadenovirus A alias Froschadenovirus 1 bei Fröschen
- Great tit siadenovirus A bei Kohlmeisen
- Penguin siadenovirus A bei Pinguinen
- Raptor siadenovirus A bei Raubvögeln
- Skua siadenovirus A bei Raubmöwen
- Turkey siadenovirus A (Truthahnadenovirus A) bei Truthühnern
Schimpansen-Adenoviren: Aus Schimpansen isolierte Adenoviren werden aufgrund ihrer großen Ähnlichkeit mit bestimmten Humanen Adenoviren (HAdVs) in „menschliche“ Adenovirus-Arten klassifiziert. So gehören die Simian-Adenoviren SAdV-22 bis SAdV-25 zur Spezies Human-Mastadenovirus E und SAdV-21 zur Spezies Human-Mastadenovirus B.[11]
Ähnlichkeiten zu anderen Viren
Der Phage PRD1 (Familie Tectiviridae) zeigt in der Struktur des Kapsids und der Schwanzfibern auffällige Ähnlichkeiten mit Adenoviren. Auch die Anordnung einiger Gene auf dem Genom dieses Phagen (DNA-Polymerase, Terminales Protein) und das Vorhandensein zweier ITRs (Inverted terminal repeats) zeigt Analogien, was insgesamt auf einen stammesgeschichtlichen Zusammenhang mit den Adenoviren hindeutet.[12] Beide Familien wurden daher vom ICTV im März 2020 in dieselbe Klasse Tectiliviricetes gestellt.[1]
In Pflanzen und Pilzen findet sich, teils im Cytoplasma oder innerhalb der Mitochondrien, ein lineares Plasmid (z. B. das „Killer-Plasmid“ der Hefe), das eine ähnliche Anordnung der Gene für die ITRs, die Polymerase und das Terminale Protein zeigt.
Die Schwanzfibern vieler Mitglieder der Adenoviridae und das Coxsackievirus B nutzen den gleichen Rezeptor CAR (Coxsackie-Adenovirus-Rezeptor) zur Erkennung von Zielzellen. Darüber hinaus haben die adenoviralen Schwanzfibern strukturelle Ähnlichkeiten mit einem Anheftungsprotein innerhalb der Reoviridae.
Anwendungen
Humane Adenoviren (vor allem Typ 5 aus der Spezies C) sind ein im Labor weit verbreiteter gentherapeutischer Vektor.
- Insbesondere in der Krebstherapie sollen die adenoviralen Vektoren zukünftig eingesetzt werden,[13] beispielsweise der künstlich hergestellte HAdv-C5-Abkömmling Ad5-3M.[14] Genmanipulierte Vakzine werden gegen Infektionen mit anderen Viren getestet, so Typ 5 gegen Ebolavirus[15][16] und SARS-CoV-2 (COVID-19-Impfstoffe).[17][18]
- Gam-COVID-Vac – Eine Anwendung von Adenoviren verfolgen russische Forscher bei der Bekämpfung von COVID-19. Zwei modifizierte rekombinante humane Viren (Adenovirus Typ 26 (rAd26-S) und Adenovirus Typ 5 (rAd5-S)) exprimieren das Spikeprotein von SARS-CoV-2. Der Einsatz zweier verschiedener Adenovirusvektoren soll garantieren, dass der Impfstoff funktional bleibt, sollte die Immunabwehr einen der beiden Vektoren erkennen und ausschalten.[19]
- Beim zugelassenen COVID-19-Impfstoff Ad26.COV2.S werden ebenfalls modifizierte Ad26-Adenoviren verwendet.[20]
- Ad5-Adenoviren wurden 2007 als Trägerviren zur Impfung gegen AIDS parallel in zwei Studien getestet („STEP“ und „Phambili“-Studien mit MRK-Ad5 AIDS), wobei sich herausstellte, dass die Gegenwart des Impfstoffes die Wahrscheinlichkeit erhöhte, sich mit HIV zu infizieren – bei unbeschnittenen Männern, die ungeschützten Analverkehr hatten,[21] und die vorher mit Ad5-Adenoviren infiziert waren.[20] In der STEP-Studie war dies am Zeitpunkt des Abbruches wegen mangelnder Wirksamkeit statistisch aber nicht signifikant: Von 1,500 Probanden erkrankten 24 mit dem Impfstoff an HIV, dagegen 21, die mindestens einmal das Placebo erhalten hatten.[22] Bei Probanden, die zweimal geimpft wurden, erkrankten 19 an HIV (Impfstoff) und 11 in der Placebogruppe.[22] Eine Gruppe renommierter Forscher warnte 2020 in einem gemeinsamen Aufruf in The Lancet daher vor der Verwendung von Ad5-Adenoviren als Trägerviren für COVID-19-Impfstoffe.[23] Eine mögliche Rolle spielten hierbei T-Helferzellen, die durch Adenoviren stark stimuliert werden und gleichzeitig für HI-Viren als Wirtszellen dienen.[20]
Die als Vektor verwendeten Viren sind replikationsgehemmt. Ihnen fehlt eine Genregion, die für die Vermehrung notwendig ist.[20]
Neben humanen Adenoviren werden auch aus Schimpansen-Adenoviren (ChAd oder AdC) abgeleitete nicht-replizierende Vektoren getestet. Vorteile gegenüber humanen Adenoviren ist bei ChAd die vernachlässigbare Seroprävalenz unter Menschen.[24] Zudem vermittelt eine bestehende Immunität gegenüber humanen Adenoviren des Types 5 keine gegenüber ChAd. Im Mittelpunkt steht hierbei ChAdOx1, das vom Jenner Institute (in Oxford) entwickelt wurde. ChAdOx1 wird als Impfstoff gegen verschiedene Krankheiten klinisch geprüft bzw. ist bereits zugelassen:
- gegen SARS-CoV-2 steht der bereits zugelassene Impfstoff Vaxzevria, zuvor AZD1222, auch ChAdOx1 nCoV-19, von AstraZeneca zur Verfügung.
- weitere auf ChAdOx1-basierende Impfstoffe sind beispielsweise in klinischer Testung ChAdOx1 MERS gegen MERS,[25] sowie präklinisch ChAdOx1 ZIKV gegen das Zika-Virus[26] oder ChAdOx1 sCHIKV gegen Chikungunya-Virus[27] (noch laufende Phase-I-Studien)[28].
Neben ChAdOx1 wird auch die Plattform ChAd-SARS-CoV-2-S als potentieller Impfstoff gegen SARS-CoV-2 entwickelt, es liegen bereits erste tierexperimentelle Daten zur Wirksamkeit vor.[29]
Ein Impfstoff auf Basis von Adenoviren soll den Tasmanischen Teufel gegen die ansteckende Krebskrankheit DFTD1 immun machen.[30]
Gesundheitliche Folgen beim Menschen
Humane Adenoviren verursachen eine Vielzahl von unterschiedlichen Erkrankungen. Die unterschiedlichen Spezies A–G der Adenoviren sind nicht eindeutig einem Krankheitsbild zuzuordnen. Die Erkrankungen, die durch humane Adenoviren ausgelöst werden, können von leichten bis schweren Atemwegsinfektionen, über disseminierte (verteilte) Infektionen bei immunsupprimierten Kindern, als auch Durchfälle sein. Vor allem ist das humane Adenovirus (Typ 19) bekannt dafür, Keratokonjunctivitiden (Augenentzündung mit Beteiligung der Cornea) auszulösen.[31] Nach einer US-Studie soll das Adenovirus 36 menschliches Fettgewebe dazu veranlassen, sich in besonders große Fettzellen zu verwandeln, wodurch eine Dickleibigkeit hervorgerufen werden kann.[32][33]
Literatur
- M. B. Matthews, T. Shenk: Adenovirus virus-associated RNA and translational control. In: Journal of Virology, 65, 1991, S. 5657–5662.
- C. M. Fauquet, M. A. Mayo et al..: Eighth Report of the International Committee on Taxonomy of Viruses. London / San Diego 2004, ISBN 978-0-12-249951-7.
- David M. Knipe, Peter M. Howley (Hrsg.): Fields’ Virology. 4. Auflage. Philadelphia 2001.
Weblinks
- Matheus A. Duarte, João M. F. Silva, Clara R. Brito, Danilo S. Teixeira, Fernando L. Melo, Bergmann M. Ribeiro, Tatsuya Nagata, Fabrício S. Campos: Faecal Virome Analysis of Wild Animals from Brazil. In: MDPI Viruses, Band 11, Nr. 9, Special Issue: Emerging Viruses: Surveillance, Prevention, Evolution and Control; 30. August 2019, S. 803; doi:10.3390/v11090803