Ammoniumoxalat
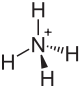
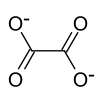
Ammoniumoxalat, Formel (NH4)2C2O4[3], ist eine kristalline chemische Verbindung aus der Gruppe der Oxalate, also der Salze der Oxalsäure.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
  | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Ammoniumoxalat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | (NH4)2C2O4 | |||||||||||||||
| Kurzbeschreibung | farb- und geruchloses, kristallines Pulver[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 124,1 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest[1] | |||||||||||||||
| Dichte | 1,48 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | Zersetzung: etwa 70 °C[1] | |||||||||||||||
| Löslichkeit | löslich in Wasser (45 g·l−1 bei 20 °C) [1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 | −1123,0 kJ/mol[2] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Ammoniumoxalat kann durch Neutralisation von Oxalsäure mit Ammoniaklösung hergestellt werden.
Eigenschaften
Ammoniumoxalat bildet rhombische Kristalle, ist farblos und in Wasser löslich. Beim Erhitzen zersetzt sich die Verbindung zu Ammoniak, Wasser, Kohlendioxid und Kohlenmonoxid.[4]
Verwendung
Ammoniumoxalat wird als Nachweismittel für Calcium-Ionen verwendet, wobei schwer lösliches Calciumoxalat entsteht, das als weißer Niederschlag ausfällt. Durch Reaktion mit Bariumchlorid kann Bariumoxalat gewonnen werden.[5]
Vorkommen
Ammoniumoxalat kommt in der Natur als das sehr seltene Mineral Oxammit vor. Es bildet sich in Guanolagerstätten als Produkt der Ausscheidungen von Seevögeln oder Fledermäusen.
Weblinks
- Patent US4018875A: Ammonium oxalate process. Angemeldet am 4. März 1975, veröffentlicht am 19. April 1977, Erfinder: Robert Kenneth Jordan.



