FGAM-Synthase
Protein
Die FGAM-Synthase (FGAMS) (auch FGARAT; formal: Phosphoribosylformylglycinamidin-Synthase) ist das Enzym, das in allen Lebewesen den vierten Schritt der Purinbiosynthese katalysiert, nämlich die Umwandlung von FGAR (ein Keton) zu FGAM (ein Imin). Die FGAMS in den meisten gramnegativen Bakterien und Eukaryoten ist ein großes Protein, das aus drei Domänen (N-terminal, FGAMS, Glutaminase) besteht, während es sich bei grampositiven Bakterien und Archaeen um einen Komplex aus drei Einzelproteinen handelt. Das für das menschliche Enzym codierende Gen wurde 1999 identifiziert.[1][2][3]
| Phosphoribosylformylglycinamidin-Synthase | ||
|---|---|---|
| Andere Namen |
| |
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 1338 Aminosäuren | |
| Bezeichner | ||
| Gen-Name | PFAS | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 6.3.5.3, Ligase | |
| Reaktionsart | Keton-Imin-Umwandlung | |
| Substrat | FGAR + Glutamin + ATP + H2O | |
| Produkte | FGAM + Glutamat + ADP + Pi | |
| Vorkommen | ||
| Homologie-Familie | Hovergen | |
| Übergeordnetes Taxon | Lebewesen | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 5198 | 237823 |
| Ensembl | ENSG00000178921 | ENSMUSG00000020899 |
| UniProt | O15067 | Q5SUR0 |
| Refseq (mRNA) | NM_012393 | NM_001159519 |
| Refseq (Protein) | NP_036525 | NP_001152991 |
| Genlocus | Chr 17: 8.25 – 8.27 Mb | Chr 11: 68.99 – 69.01 Mb |
| PubMed-Suche | 5198 | 237823 |
Katalysierte Reaktion
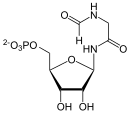
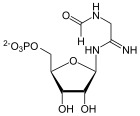
Phosphoribosylformylglycinamid (FGAR) und Glutamin werden zu Phosphoribosylformylglycinamidin (FGAM) und Glutaminsäure umgesetzt.
Einzelnachweise
Weblinks
Wikibooks: Purin-Stoffwechsel – Lern- und Lehrmaterialien
🔥 Top keywords: Wikipedia:HauptseiteSpezial:SucheRobert FicoSpecial:MyPage/toolserverhelferleinconfig.jsNeukaledonienListe der größten AuslegerbrückenPetr BystronMohammed Hassan (Bergträger)Joan CollinsZigeunerlager AuschwitzDamian HardungBridgertonNetiporn SanesangkhomHuhu-KäferChatGPTSlowakeiPfingstenYasukeMontius MagnusHauptseiteMaxton Hall – Die Welt zwischen unsEishockey-Weltmeisterschaft der Herren 202416. MaiNekrolog 2024Fußball-Europameisterschaft 2024Deine JulietWikipedia:Wiki Loves Earth 2024/DeutschlandDatei:Germany adm location map.svgDeutschlandMarinus van der LubbePornhubNatriumazidHarriet Herbig-MattenChristian KohlundBjörn HöckeTabunDavid Copperfield (Zauberkünstler)Nina ChubaRammstein