Hajos-Parrish-Eder-Sauer-Wiechert-Reaktion
Die Hajos-Parrish-Eder-Sauer-Wiechert-Reaktion ist eine Reaktion in der organischen Chemie. Es handelt sich hierbei um eine Prolin-katalysierte asymmetrische Aldol-Reaktion. Die Reaktion wurde benannt nach den Entdeckern bei den Unternehmen Hoffmann-La Roche[1][2] und der Schering AG.[3]
Geschichte
Das ursprüngliche Verfahren wurde von Zoltan Hajos und David R. Parrish in den 1970er Jahren entdeckt und liefert das optisch aktive Aldolprodukt – ein bicyclisches Ketol. Die Eder-Sauer-Wiechert-Modifikation erweitert die Reaktion um einen Kondensationsschritt und man erhält das optisch aktive Endion auf dem Weg dieser asymmetrischen organokatalytischen Reaktion. Die Reaktion und die so erhaltenen chiralen Verbindungen wurden häufig in der Steroid-Synthese genutzt um den C- und D-Ring des Steran-Gerüstes aufzubauen. Die Reaktion war auch oft in der Synthese von anderen optisch reinen Molekülen benutzt worden.[4]

In der ursprünglichen Arbeit wird natürlich vorkommendes Prolin als chiraler Katalysator für eine Aldolreaktion benutzt. Die Ausgangsverbindung ist ein achirales Triketon und es werden nur 3 Mol-% (S)-Prolin benutzt, um ein Ketol mit 93 % Enantiomerenüberschuss herzustellen. Dabei arbeiteten sie bei moderaten Temperaturen und DMF als Lösungsmittel. Im Gegensatz dazu arbeitete die Schering-Gruppe unter nicht-biologischen Bedingungen mit 47 Mol-% (S)-Prolin in einer 1N Perchlorsäure und Acetonitril als Lösungsmittel bei 80 °C. Es wurde daher auch nicht das von Hajos und Parrish gefundene Produkt isoliert, sondern anstatt dessen das ungesättigte Produkt der Aldolkondensation.[5]
Hajos und Parrish haben die absolute Konfiguration für das cis-verknüpfte 7a-Methyl-6,5-bicylische Ketol durch CD-Spektroskopie bestimmt und diese Ergebnisse mit Hilfe der Röntgenstrukturanalyse bestätigt.[6] Die Struktur des Ketols ist demnach die folgende:

Im Jahr 2000 hat eine Untersuchung von Benjamin List et al. gezeigt, dass eine Aldoladdition zwischen einem Keton und einem Aldehyd in Anwesenheit von (S)-Prolin ebenfalls zu einer asymmetrischen Induktion mit deutlichem Enantiomerenüberschuss führt.[7]
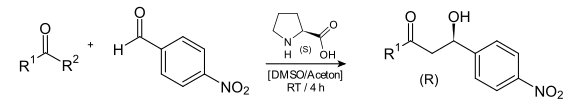
Die Autoren wiesen ausdrücklich auf die Ähnlichkeit zwischen der Prolin-katalysierten asymmetrischen Aldolreaktion und dem Enzym Aldolase A hin, denn beide haben ein Enamin-Intermediat als Übergangszustand.
Reaktionsmechanismus
Es gab bislang eine Reihe von Vorschlägen über den Mechanismus der asymmetrischen Katalyse der Reaktion. Hajos schlug im Jahr 1974 ein Halbaminal als entscheidendes Intermediat vor, gebührend seiner Versuche mit einer stöchiometrischen Menge von H218O Wasser, während Agami im Jahr 1984 ein Enamin als Intermediat bevorzugte. Durch experimentelle Ergebnisse schlug er ein Enamin mit zwei Prolin-Molekülen als Übergangszustand anhand der kinetischen Daten vor.[8] Entsprechend ist auch der von Kendall Houk 2001 vorgeschlagene Mechanismus des Übergangszustandes. Hier reicht ein einzelnes Prolin-Molekül aus um den Übergangszustand mit Hilfe einer Wasserstoffbrückenbindung auszubilden.[9][10]

Der Reaktionsmechanismus, wie ihn 2000 die Gruppe um List vorgestellt hat, basiert auf der Bildung eines Enamins und die beobachtete Stereochemie kann mit Hilfe des Zimmerman-Traxler-Modells erklärt werden.[7]

Im stereogenen Schritt der Reaktion spielen mehrere Faktoren eine Rolle: Die Carboxygruppe des Prolins nähert sich dem Carbonyl-Sauerstoffatom aus demselben Halbraum und aktiviert dieses elektrophil durch eine Wasserstoffbrückenbindung. Der sesselförmige Übergangszustand trägt seine Substituenten entweder axial (Si facial attack) oder äquatorial (Re facial attack). Da der Übergangszustand mit äquatorial positioniertem Substituenten energetisch günstiger ist, setzt sich die Reaktion entsprechend fort.[11]
Herkunft des Namens der Reaktion
Im Jahr 1985 wurde als erstes von C. Agami die Prolin-katalysierte asymmetrische Robinson-Anellierung als Hajos-Parrish-Reaktion bezeichnet.[12] Auch Henri Kagan bezeichnete (zusammen mit Agami) diese Reaktion in einer Veröffentlichung mit diesem Namen.[13] Später im Jahr 2001 publizierte Kagan eine Arbeit und bezeichnete die Reaktion hier als Hajos-Parrish-Wiechert-Reaktion.[14] Im Jahr 2002 wurde dann in einer Veröffentlichung von Benjamin List zwei Namen hinzugefügt und so wird die Reaktion heute praktisch einheitlich in der wissenschaftlichen Literatur als Hajos-Parrish-Eder-Sauer-Wiechert-Reaktion bezeichnet. Das ursprüngliche Verfahren liefert das optisch aktive Aldolprodukt und ist als Hajos-Parrish-Reaktion bekannt.[15][16]