| Mesomerie (Beispiel: Triphenyl- phosphoniummethylid) Ylid (oben), Yliden (unten) |
|---|
 |
Phosphor-Ylide, auch Phosphonium-Ylide oder abgekürzt P-Ylide, sind chemische Verbindungen. Es handelt sich um innere Salze mit Kohlenstoff als Anion und Phosphor als Kation (also ein Zwitterion). In der organischen Synthesechemie sind P-Ylide wichtige Reagenzien zur Herstellung von Alkenen mittels der Wittig-Reaktion.[1]
| Relative Stabilität von Triphenylphosphoniumyliden |
|---|
labiles Ylid |
labiles Ylid |
semistabiles Ylid |
stabiles Ylid |
stabiles Ylid |
Elektronische Struktur von P-Yliden
Ylid bezeichnet eine Grenzstruktur mit Ladungstrennung, wobei die beteiligten Atome jeweils Oktettkonfiguration aufweisen. Lange wurde die unpolaren Ylen-Resonanzstruktur (s. o.) angenommen, in der das Phosphoratom zehn Elektronen trägt, weshalb energetisch hoch liegende d-Orbitale an der Bindung beteiligt sein sollten. Computerchemische Untersuchungen zeigte jedoch, dass die d-Orbitale kaum zur Stabilisierung dieser Verbindungen beitragen. Strukturuntersuchungen sprechen der Ylid-Struktur, also einer zwitterionischen mit positiv geladenem Phosphoratom und negativ geladenem Kohlenstoffatom (Carbanion) den höchsten Anteil zu.[2][3]Weiterhin wird zwischen nicht-stabilisierte Ylide, bei denen an das Phosphoratom eine Alkylidengruppe (z. B. Methylen, =CH2) gebunden ist, und stabilisierten Yliden, in denen die negative Ladung am direkt an das Phosphoratom gebundenen Kohlenstoffatom durch elektronenziehende Gruppen wie COOR, C(=O)R, CN... stabilisiert wird, unterschieden.[4]
Herstellung von Alkylidentriphenylphosphoranen
Als Startmaterial benötigt man ein Phosphoniumhalogenid mit mindestens einem α-ständigen H-Atom. Die Umsetzung dieses Phosphoniumhalogenids (z. B. Methyltriphenylphosphoniumchlorid) mit starken Basen (z. B. Methyllithium) liefert ein P-Ylid.[5]
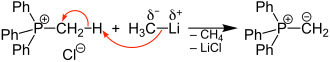
Statt Methyllithium können auch andere starke Basen, wie Butyllithium, Phenyllithium, Natriumamid oder Methylsulfinylcarbanionen zur Abspaltung des α-ständigen H-Atoms verwendet werden.[5]
Reaktivität
Mit einem Keton wie Cyclohexanon reagiert z. B. Methylentriphenylphosphoran zum entsprechenden Alken.[6]

Dies ist ein einfaches Beispiel für eine Wittig-Reaktion. Bei dieser Reaktionen wird Triphenylphosphanoxid (Ph3P=O) in stöchiometrischen Mengen abgespalten.[5] Insofern ist die Atomeffizienz dieser Synthese gering. Trotzdem wird durch eine Wittig-Reaktion in technischen Maßstab Vitamin A hergestellt.[7]