Sorbitdehydrogenase
Sorbitdehydrogenase (Sdh) (Gen: SORD) ist der Name für Enzyme, die Sorbit zu Fructose umwandeln. Dies ist der zweite Schritt im Polyolweg, der von Zellen benutzt wird, um ohne ATP-Verbrauch Fructose aus Glucose herzustellen. Jedes Lebewesen benutzt Sdh. In Säugetieren ist das Enzym in allen Gewebetypen aktiv.[1][2]
| Sorbitdehydrogenase | ||
|---|---|---|
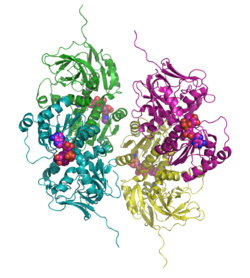 | ||
| Bändermodell des Tetramer, NAD und Zink als Kalotten, nach PDB 1PL8 | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 356 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homotetramer | |
| Kofaktor | Zink, NAD | |
| Bezeichner | ||
| Gen-Name | SORD | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 1.1.1.14, Oxidoreduktase | |
| Reaktionsart | Oxidation | |
| Substrat | Sorbit + NAD+ | |
| Produkte | Fructose + NADH | |
| Vorkommen | ||
| Homologie-Familie | Hovergen | |
| Übergeordnetes Taxon | Lebewesen | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 6652 | 20322 |
| Ensembl | ENSG00000140263 | ENSMUSG00000027227 |
| UniProt | Q00796 | Q64442 |
| Refseq (mRNA) | NM_003104 | NM_146126 |
| Refseq (Protein) | NP_003095 | NP_666238 |
| Genlocus | Chr 15: 45.02 – 45.08 Mb | Chr 2: 122.23 – 122.27 Mb |
| PubMed-Suche | 6652 | 20322 |
Es gibt Hinweise darauf, dass Polymorphismen im SORD-Gen mit Retikulopathie bei Diabetes mellitus Typ 2 assoziiert sind. Sdh-Hemmer (oder auch Aldosereduktase-Hemmer) können das Auftreten neurologischer und ophthalmologischer Probleme bei Diabetes verhindern und sind daher interessant als potenzielle Arzneistoffe.[3][4][5] Darüber hinaus können SORD Mutationen auch eine Neuropathie vom Charcot-Marie-Tooth Typ 2 auslösen.[6]
Struktur und Funktion
Sdh bildet ein komplexes Tetramer, das durch ein Netz von Wasserstoffbrücken seine spezielle Form erhält. Dieser Mechanismus hat sich bei allen Säugetieren erhalten und ist essenziell für die Funktion des Enzyms.[7]
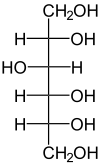
Die katalysierte Reaktion:
D-Sorbit wird zu D-Fructose dehydriert und umgekehrt.