Tetrakis(triphenylphosphin)palladium(0)
Tetrakis(triphenylphosphin)palladium(0) (im Laborjargon üblicherweise als Tetrakis abgekürzt) ist eine Komplexverbindung des Palladiums mit Triphenylphosphin und ein wichtiger Katalysator für verschiedene Reaktionen in der organischen Synthese.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
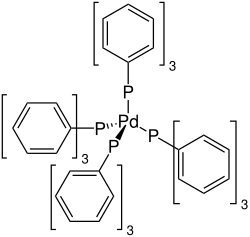 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Tetrakis(triphenylphosphin)palladium(0) | ||||||||||||||||||
| Summenformel | C72H60P4Pd | ||||||||||||||||||
| Kurzbeschreibung | gelbliches bis grünliches Pulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 1155,59 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | fest[2] | ||||||||||||||||||
| Schmelzpunkt | 95–105 °C[2] | ||||||||||||||||||
| Löslichkeit | praktisch unlöslich in Wasser (0,09 g·l−1 bei 20 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Herstellung
Tetrakis(triphenylphosphin)palladium(0) kann auf verschiedenen Wegen hergestellt werden, unter anderem durch eine Reaktion von Triphenylphosphin im Überschuss mit frisch gefälltem Palladiumoxid oder mit einer heißen konzentrierten Lösung von Palladiumnitrat.[3]
Die früheste Synthese stammt von Lamberto Malatesta und M. Angoletta aus dem Jahr 1957. Hier wurde der Komplex durch Reduktion von Palladium(II)-chlorid mit Hydrazin in Gegenwart eines Überschusses Triphenylphosphin hergestellt.[4]
Eigenschaften

Tetrakis(triphenylphosphin)palladium(0) ist luftempfindlich.[3] Es kristallisiert im trigonalen Kristallsystem.[5]
Reaktionen
Durch Reaktion mit Halogenaromaten können Arylreste an das Palladiumzentrum koordiniert werden. Dabei sind Iodaromaten reaktiver als Bromaromaten und diese wiederum reaktiver als Chloraromaten. Iodbenzol reagiert schon bei Raumtemperatur, Brombenzol bei 80 °C. Die Reaktion mit Chlorbenzol ist unmöglich bei Temperaturen, bei denen der Palladiumkomplex thermisch stabil ist. Elektronenziehende Substituenten erhöhen allerdings die Reaktivität, sodass die Reaktion mit 4-Nitrochlorbenzol bei 80 °C funktioniert.[6]
Verwendung
Tetrakis(triphenylphosphin)palladium(0) ist kommerziell erhältlich und wird als Katalysator für diverse Reaktionen in der organischen Synthese verwendet, insbesondere Kreuzkupplungen von Halogenaromaten.[3]
Eine wichtige Namensreaktion, für die die Verbindung als Katalysator verwendet wird, ist die Suzuki-Kupplung.[7] Der Komplex wurde auch zur Imprägnierung 3D-gedruckter Rührern verwendet, mit denen Suzuki-Kupplungen ohne Zusatz von weiterem Katalysator durchgeführt werden können.[8] Weitere Namensreaktionen, in denen die Verbindung als Katalysator verwendet wird, sind die Heck-Reaktion[9] und die Sonogashira-Kupplung.[10]
Der Komplex kann auch als Katalysator für die Allylierung mit von Halogenaromaten mit Allyltributylzinn verwendet werden. Die Reaktion funktioniert am besten mit Bromiden, schlechter mit Chloriden und Iodiden. Außerdem funktioniert die Reaktion besser mit elektronenarmen Aromaten.[11] Analog funktioniert die Alkylierung von Säurechloriden mit Tetramethylzinn oder Tetrabutylzinn oder ihre Vinylierung mit Vinyltributylzinn.[12]
Weitere Reaktionen, die durch Tetrakis(triphenylphosphin)palladium(0) katalysiert werden können, sind die Umsetzung von Brom- und Iodaromaten zu Thioethern mit Thiolaten[13], die Dehalogenierung von Brom- und Iodaromaten mit Natriummethanolat[14], die Entschützung von mit einer Allylgruppe geschützten Kohlenhydraten in Essigsäure[15] und die Tritium-Markierung mittels 3H-Natriumborhydrid.[16]
