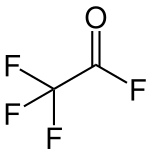
Trifluoracetylfluorid
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Trifluoracetylfluorid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C2OF4 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 116,01 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | gasförmig[1] | ||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit | Hydrolyse in Wasser[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Trifluoracetylfluorid (auch Trifluoressigsäurefluorid) ist eine organisch chemische Verbindung aus der Gruppe der Carbonsäurefluoride, konkret das Fluorid der Trifluoressigsäure.
Vorkommen
Quelltext bearbeitenTrifluoracetylfluorid kommt in der Atmosphäre als Abbauprodukt von fluorierten Verbindungen vor, die als Kältemittel eingesetzt werden, beispielsweise 1,1,1,2-Tetrafluorethan, 2-Chlor-1,1,1-trifluorethan, 2,3,3,3-Tetrafluorpropen oder 1,1,1,2,3,3,3-Heptafluorpropan. Durch Photolyse kann es weiter zu Tetrafluormethan und Kohlenmonoxid zersetzt werden.[4] Durch Hydrolyse entsteht aus Trifluoracetylfluorid Trifluoressigsäure.[5]
Herstellung
Quelltext bearbeitenTrifluoracetylfluorid kann durch die elektrochemische Fluorierung von Acetylchlorid oder Acetanhydrid hergestellt werden.[6] Es entsteht auch durch Umlagerung von Perfluorethylacetat, die zwei Moleküle Trifluoracetylfluorid ergibt.[7]
Verwendung
Quelltext bearbeitenTrifluoracetylfluorid ist ein wichtiges industrielles Intermediat für Trifluoressigsäure, die durch dessen Hydrolyse hergestellt wird.[8]



