Ισολευκίνη
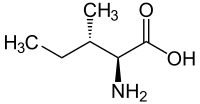
Η ισολευκίνη ή 2-αμινο-3-μεθυλοπεντανικό οξύ (συμβολίζεται με Ile ή I)[1] είναι ένα α-αμινοξύ με σύντομο συντακτικό τύπο CH3CH2CH(CH3))CH(NH2)COOH. Η ισολευκίνη είναι ένα από τα πρωτεϊνογόνα αμινοξέα. Οι τριπλέτες της είναι: AUU, AUC και AUA. Ανήκει στα απαραίτητα αμινοξέα, δηλαδή σε αυτά που δεν μπορεί να βιοσυνθέσει ο ανθρώπινος οργανισμός και πρέπει να λαμβάνονται έτοιμα, με την τροφή. Επειδή το τμήμα του μορίου της από το #2 άτομο άνθρακα και μετά [R = CH3CH2CH(CH3)-, δηλαδή δευτεροταγές βουτύλιο] είναι ένα αλκύλιο, ταξινομείται στα «υδρόφοβα» αμινοξέα. Είναι ένα σημαντικό συστατικό υπομονάδων της φερριτίνης, της αστακίνης και άλλων αμυντικών και μεταφορικών πρωτεϊνών.
| Ισολευκίνη | |
|---|---|
 | |
 | |
| Γενικά | |
| Όνομα IUPAC | 2-αμινο-3-μεθυλοπεντανικό οξύ |
| Άλλες ονομασίες | Ισολευκίνη |
| Χημικά αναγνωριστικά | |
| Χημικός τύπος | C6H13NO2 |
| Μοριακή μάζα | 131,17 amu |
| Σύντομος συντακτικός τύπος | CH3CH2CH(CH3)CH(NH2)COOH |
| Συντομογραφίες | ile, I |
| Αριθμός CAS | 73-32-5 |
| SMILES | CCC(C)C(N)C(=O)O |
| InChI | 1S/C6H13NO2/c1-3-4(2)5(7)6(8)9/h4-5H,3,7H2,1-2H3,(H,8,9)/t4-,5-/m0/s1 |
| Αριθμός EINECS | 200-773-6 |
| Αριθμός UN | 04Y7590D77 |
| PubChem CID | 791 |
| ChemSpider ID | 6067 |
| Ισομέρεια | |
| Ισομερή θέσης | >175 |
| Οπτικά ισομερή | 4 |
| Φυσικές ιδιότητες | |
| Διαλυτότητα στο νερό | διαλυτή |
| Εμφάνιση | λευκό κρυσταλλικό στερεό |
| Χημικές ιδιότητες | |
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |
Ισομέρεια
Με βάση το χημικό τύπο της, C6H13NO2, έχει πολλά ισομερή θέσης, τα σημαντικότερα από τα οποία είναι τα ακόλουθα αμινοξέα:
- 6-αμινεξανικό οξύ
- Λευκίνη
Δομή
| Δεσμοί[2] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C-H | σ | 2sp3-1s | 109 pm | 3% C- H+ |
| C#1'-C#3 | σ | 2sp3-2sp3 | 154 pm | |
| C#5-C#4 | σ | 2sp3-2sp3 | 154 pm | |
| C#4-C#3 | σ | 2sp3-2sp3 | 154 pm | |
| C#3-C#2 | σ | 2sp3-2sp3 | 154 pm | |
| C#2-C#1 | σ | 2sp3-2sp2 | 151 pm | |
| C-N | σ | 2sp3-2sp3 | 152 pm | 6% C+ Ν- |
| Ν-H | σ | 2sp3-1s | 101,7 pm | 17% N- H+ |
| C=O | σ | 2sp2-2sp2 | 132 pm | 19% C+ O- |
| π | 2p-2p | |||
| C-O | σ | 2sp2-2sp3 | 147 pm | 19% C+ O- |
| O-H | σ | 2sp3-1s | 96 pm | 32% O- H+ |
| Κατανομή φορτίων σε ουδέτερο μόριο | ||||
| -O | -0,51 | |||
| -N | -0,40 | |||
| =O | -0,38 | |||
| C#1' | -0,09 | |||
| C#5 | -0,09 | |||
| C#4 | -0,06 | |||
| C#3 | -0,03 | |||
| H(CH) | +0,03 | |||
| C#2 | +0,03 | |||
| H(NH2) | +0,17 | |||
| H(OH) | +0,32 | |||
| C#1 | +0,57 | |||
Παραγωγή
Βιοσύνθεση
Ως ένα βασικό αμινοξύ, η ισολευκίνη δεν μπορεί να συνθεθεί από τα ζώα, και γι' αυτό πρέπει να προσλαμβάνεται έτοιμη με την τροφή, συνήθως ως συνστατικό των πρωτεϊνών. Μπορεί όμως να βιοσυνθεθεί από τα φυτά και από μικροοργανισμούς, μέσω αρκετών σταδίων, αρχίζοντας από το πυροσταφυλικό οξύ και το α-κετογλουταρικό οξύ. Τα ένζυμα που εμπλέκονται στην τυπική βιοσύνθεση της λευκίνης είναι τα ακόλουθα:[3]:
- Ακετογαλακτική συνθετάση.
- Ισομεραναγωγάση των ακετοϋδροξυοξέων.
- Αφυδατάση των διυδροξυοξέων.
- Αμινοτρανσφεράση της βαλίνης.
Άλλες μέθοδοι
Μέσω αλογόνωσης 3-μεθυλοπεντανικού οξέος
Ρακεμικό μίγμα λευκίνης μπορεί να παραχθεί μέσω αλογόνωσης του 3-μεθυλοπεντανικού οξέος:

1. Το α-αλοξύ που προκύπτει έτσι, επιδράται με αμμωνία[4]:

2. Μέσω οργανομαγνησιακών ενώσεων και αλαμίνης με εστεροποίηση για «προστασία»[5] της καρβοξυλομάδας[6]:

3. Με φθαλιμιδικό κάλιο (σύνθεση Gabriel)[7]:
Αντίδραση Stracker
Με επίδραση υδροκυανίου (HCN) και αμμωνίας (NH3) σε 2-μεθυλοβουτανάλη [CH3CH2CH(CH3)CHO)[8]:

Με αναγωγική αμμωνίωση του αντίστοιχου κετοξέος
Με αναγωγική αμμωνίωση 3-μεθυλο-2-οξοπεντανικού οξέος[9]::

Με αναγωγή του αντίστοιχου νιτροξέος
Από 3-μεθυλο-2-νιτροπεντανικό οξύ με αναγωγή[10]:

- Το 3-μεθυλο-2-νιτροπεντανικό οξύ παράγεται από το αντίστοιχο α-αλοπροπανικό οξύ:

Από δευτεροταγές βουτυλομηλονικό οξύ
Από δευτεροταγές βουτυλομηλονικό οξύ με μετροπή σε μονοαμίδιο και αποικοδόμηση-μετάθεση Hofmann[11]:





Από το αντίστοιχο αμινονιτρίλιο
Από 2-αμινο-3-μεθυλοπεντανονιτρίλιο με υδρόλυση:

- To 2-αμινο-3-μεθυλοπεντανονιτρίλιο παράγεται από 2-μεθυλοβουτανάλη με επίδραση χλωριούχου αμμωνίου και κυανιούχου νατρίου[12]

Χημικές ιδιότητες και παράγωγα
Αμφολυτική αυμπεριφορά
1. Η πιο χαρακτηριστική είναι η αμφολυτική διάστασή της:

- Η κεντρική πάνω κατάσταση ισχύει για αδιάλυτη (ή διαλυτή σε απρωτικούς διαλύτες) αλανίνη.
- Σε υδατικά διαλύματα:
- Για pH<pK1 ιονίζεται η αμινομάδα (δεξιά).
- Για pH=pI ιονίζονται και η αμινομάδα και η καρβοξυλομάδα (κένρο κάτω).
- Για pH>pK2 ιονίζεται μόνο η καρβοξυλομάδα (αριστερά).
2. Παραγωγή αλάτων με οξέα και βάσεις. Π.χ.:

και 
Εστεροποίηση
Αντιδρά με αλκοόλες σχηματίζοντας αμινεστέρες. Αποτελεί και μέθοδο «προστασίας»[13] της καρβοξυλομάδας.

Αλκυλίωση
Με επίδραση αλκυλοαλογονιδίων σχηματίζονται δευτεροταγή αμινοξέα:

Ακυλίωαη
Με επίδραση ακυλοαλογονιδίων σχηματίζονται δευτεροταγή αμιδοξέα. Αποτελεί και μέθοδο «προστασίας»[13] της αμινομάδας, αφού τα αμίδια υδρολύονται.

Απαζώτωση
Με επίδραση νιτρώδους οξέος πρακτικά αντικαθίστανται η αμινομάδα με υδροξυλομάδα. Παράγεται 3-μεθυλο-2-υδροξυπεντανικό οξύ:

Αναφορές και σημειώσεις
Πηγές
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999.
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982.


