Ακρυλικό οξύ
Το ακρυλικό οξύ[1] (αγγλικά acrylic acid) είναι οργανική χημική ένωση με μοριακό τύπο C3H4O2, αν και συνηθέστερα παριστάνεται ως CH2=CHCO2H. Πιο συγκεκριμένα, είναι το απλούστερο ακόρεστο καρβοξυλικό οξύ, αποτελούμενο δομικά από μια βινυλομάδα (CH2=CH) άμεσα συνδεμένη με την τερματική καρβοξυλομάδα του (COOH). Το χημικά καθαρό ακρυλικό οξύ, στις «κανονικές συνθήκες περιβάλλοντος», δηλαδή σε θερμοκρασία 25°C και υπό πίεση 1 atm, είναι άχρωμο υγρό με χαρακτηριστική στυφόξινη οσμή. Είναι αναμείξιμο με το νερό, τις αλκοόλες, τους αιθέρες και το χλωροφόρμιο (CHCl3). Παγκοσμίως, παράγονται (βιομηχανικά) ετησίως πάνω από 1.000.000 τόνοι ακρυλικού οξέος[2].
| Ακρυλικό οξύ | |||
|---|---|---|---|
 | |||
 | |||
| Γενικά | |||
| Όνομα IUPAC | Προπενικό οξύ | ||
| Άλλες ονομασίες | Ακρυλικό οξύ Αιθυλενοκαρβοξυλικό οξύ Προπενοξύ Βινυλοφορμικό οξύ | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C3H4O2 | ||
| Μοριακή μάζα | 72,06 amu | ||
| Σύντομος συντακτικός τύπος | CH2=CHCOOH | ||
| Συντομογραφίες | ViCOOH | ||
| Αριθμός CAS | 79-10-7 | ||
| SMILES | C=CC(=O)O | ||
| InChI | 1/C3H4O2/c1-2-3(4)5/h2H,1H2,(H,4,5) | ||
| Αριθμός RTECS | AS4375000 | ||
| Αριθμός UN | J94PBK7X8S | ||
| PubChem CID | 6581 | ||
| ChemSpider ID | 6333 | ||
| Δομή | |||
| Μοριακή γεωμετρία | επίπεδη | ||
| Ισομέρεια | |||
| Ισομερή θέσης | 39 | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | 14 °C | ||
| Σημείο βρασμού | 141 °C | ||
| Πυκνότητα | 1051 kg/m3 | ||
| Διαλυτότητα στο νερό | Αναμείξιμο | ||
| Ιξώδες | 1,3 cP (20 °C) | ||
| Εμφάνιση | άχρωμο καυστικό υγρό | ||
| Χημικές ιδιότητες | |||
| pKa | 4,35 | ||
| Ελάχιστη θερμοκρασία ανάφλεξης | 68 °C | ||
| Επικινδυνότητα | |||
| Φράσεις κινδύνου | R10 R20/21/22 R35 R50 | ||
| Φράσεις ασφαλείας | S26 S36/37/39 S45 S61 | ||
| MSDS | Εξωτ. Σύνδεσμος MSDS | ||
| Κίνδυνοι κατά NFPA 704 | |||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Ισομερή θέσης
Με βάση το μοριακό του τύπο, το ακρυλικό οξύ έχει τουλαχιστον 43 ισομερή θέσης, όχι όλα σταθερά.
Τα κυριότερα από αυτά είναι τα ακόλουθα:
- Μεθανικός βινυλεστέρας (HCOOCH=CH2).
- α-προπιολακτόνη ή μεθυλοξιρανόνη (
 ).
). - β-προπιολακτόνη ή 2-οξετανόνη (
 ) .
) . - 3-οξετανόνη (
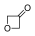 ).
).
Δομή
Είναι το πρώτο μέλος της ομόλογης σειράς των αλκενικών οξέων, δηλαδή των μονοκαρβονικών οξέων που μπορούν να χαρακτηριστούν από την ένωση ενός αλκενύλιου και ενός καρβοξυλίου. Ο διπλός δεσμός του βρίσκεται σε συζυγή θέση (δηλαδή με έναν απλό ενδιάμεσα) με εκείνον του καρβονυλίου του καρβοξυλίου του.
| Δεσμοί[3] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C#2,#3-H | σ | 2sp2-1s | 106 pm | 3% C- H+ |
| C#3=C#2 | σ | 2sp2-2sp2 | 134 pm | |
| π | 2p-2p | |||
| C#2-C#1 | σ | 2sp2-2sp2 | 147 pm | |
| C=O | σ | 2sp2-2sp2 | 132 pm | 19% C+ O- |
| π | 2p-2p | |||
| C-O | σ | 2sp2-2sp3 | 147 pm | 19% C+ O- |
| O-H | σ | 2sp3-1s | 96 pm | 32% O- H+ |
| Γωνίες | ||||
| HCH | 120° | |||
| HCC | 120° | |||
| CCO | 120° | |||
| COO | 120° | |||
| OCO | 120° | |||
| COH | 104,45° | |||
| Στατιστικό ηλεκτρικό φορτίο[4] | ||||
| Ο (OH) | -0,51 | |||
| Ο (=O) | -0.38 | |||
| C#3 | -0,06 | |||
| C#2 | -0,03 | |||
| Η (HC) | +0,03 | |||
| Η (OH) | +0,32 | |||
| C#1 | +0,57 | |||
Παραγωγή
Βιομηχανική παραγωγή
Η σύγχρονη βιομηχανική παραγωγή του γίνεται με οξείδωση προπενίου από οξυγόνο:

Επειδή το ακρυλικό οξύ και οι εστέρες του έχουν μεγάλη οικονομική σημασία, έχουν ανακαλυφθεί και πολλές άλλες μέθοδοι, αλλά οι περισσότερες έχουν εγκαταληφθεί, για οικονομικούς ή περιβαλλοντικούς λόγους.
Ωστόσο, υπάρχει μια σημαντική εναλλακτική μέθοδος με επίδραση μονοξειδίου του άνθρακα και υδρατμών σε αιθίνιο, στα πλαίσια της Χημείας Reppe:

Άλλες μέθοδοι
Με καρβοξυλίωση βινυλαλογονιδίων
Με καρβοξυλίωση με διοξείδιο του άνθρακα (CO2) βινυλαλογονιδίων (CH2=CHX), μέσω οργανομαγνησιακών ενώσεων (αντιδραστήρια Grignard) παράγεται ακρυλικό οξύ[5]::

Με υδρόλυση προπενονιτριλίου
Με υδρόλυση προπενονιτριλίου (CH2=CHCN) σε όξινο περιβάλλον παράγεται ακρυλικό οξύ[6]:

Με προπεν-2-όλης-1 ή προπεν-2-άλης
1. Με οξείδωση προπεν-2-όλης-1 (CH2=CHCH2OH) παράγεται ακρυλικό οξύ[7]:

2. Με οξείδωση προπεν-2-άλης (CΗ2=CHCHO) παράγεται ακρυλικό οξύ[7]:

Από μεθυλενομηλονικό οξύ
Από μεθυλενομηλονικό οξύ [HOOCC(=CH2)COOH] παράγεται ακρυλικό οξύ[8]:

Με αφυδάτωση υδροξυπροπανικού οξέος
Με ενδομοριακή αφυδάτωση 2-υδροξυπροπανικού οξέος ή 3-υδροξυπροπανικού οξέος παράγεται ακρυλικό οξύ. Η αντίδραση ευνοείται σε σχετικά υψηηλές θερμοκρασίες, >150 °C[9]:
1.

2.

- Τα αποτελέσματα είναι καλύτερα αν χρησιμοποιηθεί «προστασία» του καρβοξυλίου.
Με απόσπαση υδραλογόνου από αλοπροπανικό οξύ
Με απόσπαση υδραλογόνου (HX) από 2-αλοπροπανικό οξύ ή 3-αλοπροπανικό οξύ παράγεται ακρυλικό οξύ[10]:
1.

2.

- Τα αποτελέσματα είναι καλύτερα αν χρησιμοποιηθεί «προστασία» του καρβοξυλίου.
Με απόσπαση αλογόνου
Με απόσπαση αλογόνου (X2) από 2,3-διαλοπροπανικό οξύ παράγεται ακρυλικό οξύ[11]:

- Τα αποτελέσματα είναι καλύτερα αν χρησιμοποιηθεί «προστασία» του καρβοξυλίου.
Με μερική καταλυτική υδρογόνωση
Με μερική καταλυτική υδρογόνωση προπινικού οξέος παράγεται ακρυλικό οξύ[12]:

Πηγές
- Ν. Αλεξάνδρου, Γενική Οργανική Χημεία, ΘΕΣΣΑΛΟΝΙΚΗ 1985
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Πολυχρόνη Σ. Καραγκιοζίδη: Ονοματολογία οργανικών ενώσεων, Θεσσαλονίκη 1991, Έκδοση Β΄.
- Ν. Αλεξάνδρου, Α. Βάρβογλη, Δ. Νικολαΐδη: Χημεία Ετεροκυκλικών Ενώσεων, Θεσσαλονίκη 1985, Έκδοση Β΄.
- Δ. Νικολαΐδη: Ειδικά κεφάλαια Οργανικής Χημεία, Θεσαλονίκη 1983.



