Composé organotitane
Un organotitane est un composé organométallique contenant une liaison carbone–titane. Souvent semblables aux composés organozirconiques, ils sont étudiés comme catalyseurs en chimie organique dans le cadre de procédés industriels de premier plan[1].

Propriétés

La configuration électronique de l'atome de titane à l'état fondamental est [Ar] 4s2 3d2, de sorte que l'état d'oxydation +4 est prédominant. L'atome est cependant plus gros que celui de carbone, d'où des liaisons plus longues d'environ 30 %, par exemple 210 pm pour les liaisons C–Ti du tétrabenzyltitane (C6H5CH2)4Ti contre 155 pm pour des liaisons C–C typiques. Les composés de type tétraalkyltitane ne peuvent généralement pas être isolés en raison de la taille de l'atome de titane et la nature déficitaire en électrons des complexes tétraédriques correspondants. Les complexes les plus nombreux et les plus utiles portent plusieurs types de ligands, par exemple des alcoolates et des cyclopentadiényles. Le titane est susceptible de former des complexes de coordinence élevée.
La plupart des composés organotitane sont des complexes de Ti(IV) ou de Ti(III). Les composés de Ti(II) sont plus rares, comme le dicarbonyle de titanocène (η5-C5H5)2Ti(CO)2 et le (CH3)2Ti(dmpe)2. L'hexacarbonyle de titane [Ti(CO)6]2− est un complexe formellement de Ti(–II)[3]. Le dimère [Cp2TiIIICl]2 est un exemple d'organotitane(III)[4]. La faible électronégativité du titane polarise la liaison C–Ti vers le carbone. Les ligands alkyle des composés organotitane sont par conséquent généralement nucléophiles. Le titane est plutôt oxophile, ce qui l'oriente vers les procédés à l'abri de l'air, et explique que les composés alkyltitane soient efficaces pour extraire leurs ligands avec des groupes oxo.
Exemples
Alcoolates et chlorures de composés alkyltitane
Les complexes alkyltitane homoleptiques tels que le tétrabenzyltitane (C6H5CH2)4Ti[5] sont rares. Plusieurs halogénures d'alkyltitane et alcoolates d'alkyltitane mixtes sont utilisés en synthèse organique, bien qu'ils soient souvent mal caractérisés[6]. Les composés organotitane économiquement les plus utiles sont obtenus en combinant le chlorure de titane(III) TiCl3 et le chlorure de diéthylaluminium (CH3CH2)2AlCl. Ces espèces catalysent efficacement la polymérisation de l'éthylène en tant que catalyseurs Ziegler-Natta. Le procédé est hétérogène et aucun intermédiaire organotitane n'a été bien caractérisé pour ce procédé.
De nombreux réactifs organotitane sont produits en combinant du tétrachlorure de titane TiCl4, des tétraalcoolates de titane (RO)4Ti ou des mélanges de ceux-ci avec des organolithiens, des organomagnésiens et des organozinciques. De tels composés trouvent une utilisation occasionnelle comme réactifs stoechiométriques en synthèse organique. Le trichlorure de méthyltitane CH3TiCl3 peut être préparé en traitant du tétrachlorure de titane avec du diméthylzinc (CH3)2Zn dans du dichlorométhane CH2Cl2 à −78 °C. Il fournit des groupes méthyle aux composés carbonylés et aux halogénures d'alkyle. Le « méthyltriisopropylate de titane » est un réactif apparenté[7]. Une espèce dialkyltitane intervient dans les cyclopropanations à catalyseur titane à partir d'un réactif de Grignard et d'un ester ; cette réaction est à la base de la réaction de Kulinkovich[8] :
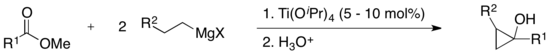
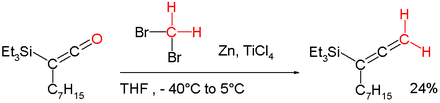
Le « réactif de Lombardo » est utilisé pour réaliser des méthylénations[9]. Il est fonctionnellement apparenté à un autre réactif, le chlorure de dibromométhane-zinc-titane(IV)[10]. Ces réactions pallient un manque des réactifs de Wittig en méthylénant les groupes carbonyle énolisables sans perte d'intégrité stéréochimique (méthylénation Lombardo). Il peut par exemple être également appliqué à la conversion d'un cétène en un allène[6],[11] :
Dérivés de titanocène
Lorsqu'on essaie de produire du « titanocène », c'est-à-dire le (η5-C5H5)2Ti, on obtient un complexe de fulvalène[12],[13]. Le dimère de titanocène a été identifié dans les années 1970[13],[14],[15] mais n'a été caractérisé structurellement qu'en 1992[16] tandis que les recherches ont conduit à de nombreuses innovations sur les complexes de cyclopentadiényle du titane[12]. Ce n'est qu'en 1998 qu'un véritable dérivé du titanocène a été identifié, l'espèce paramagnétique (η5-Me4C5SiMe3)2Ti[17].
Contrairement au titanocène lui-même, le dichlorure de titanocène Cp2TiCl2 et, dans une certaine mesure, le monochlorure de titanocène ont des chimies riches et bien définies. Le réactif de Tebbe, obtenu à partir de dichlorure de titanocène et de triméthylaluminium Me3Al est utilisé comme agent de méthylénation (conversion de R2C=O en R2C=CH2).

Le réactif de Tebbe catalyse l'addition d'alcènes simples pour donner des titanocyclobutanes, qui peuvent être considérés comme des intermédiaires de métathèse d’alcènes stables. Ces composés sont eux-mêmes des réactifs, tels que le 1,1-bis(cyclopentadiényl)-3,3-diméthyltitanocyclobutane, produit d'addition du réactif de Tebbe avec l'isobutylène (CH3)2C=CH2 catalysé par la 4-diméthylaminopyridine[18].
Le réactif de Petasis, ou diméthyltitanocène Cp2Ti(CH3)2 est préparé à partir de dichlorure de titanocène et de méthyllithium CH3Li dans de l'éther diéthylique (CH3CH2)2O. Il est plus facile à préparer et à manipuler que le réactif de Tebbe ; il catalyse également des méthylénations[18].
- Réactif de Petasis.
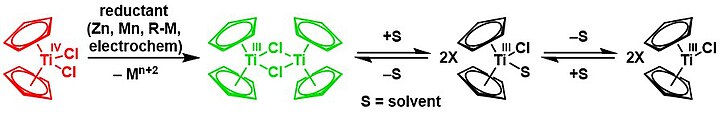
Le chlorure de bis(cyclopentadiényl)titane(III) [(η5-C5H5)2TiIII(µ-Cl)]2[19] (réactif de Nugent-RajanBabu ci-dessous en vert) est un réducteur à un électron utilisé en synthèse organique pour la production d'alcools anti-Markovnikov par ouverture de cycle d'époxydes ; il est produit sous forme de dimère [Cp2Ti(μ-Cl)]2 et utilisé in situ à partir de dichlorure de titanocène Cp2TiIVCl2[4],[20],[21],[22] (ci-dessous en rouge, avec ses espèces à l'équilibre en noir) :
Notes et références
| C-H | He | |||||||||||||||||
| C-Li | C-Be | C-B | C-C | C-N | C-O | C-F | Ne | |||||||||||
| C-Na | C-Mg | C-Al | C-Si | C-P | C-S | C-Cl | C-Ar | |||||||||||
| C-K | C-Ca | C-Sc | C-Ti | C-V | C-Cr | C-Mn | C-Fe | C-Co | C-Ni | C-Cu | C-Zn | C-Ga | C-Ge | C-As | C-Se | C-Br | C-Kr | |
| C-Rb | C-Sr | C-Y | C-Zr | C-Nb | C-Mo | C-Tc | C-Ru | C-Rh | C-Pd | C-Ag | C-Cd | C-In | C-Sn | C-Sb | C-Te | C-I | C-Xe | |
| C-Cs | C-Ba | * | C-Lu | C-Hf | C-Ta | C-W | C-Re | C-Os | C-Ir | C-Pt | C-Au | C-Hg | C-Tl | C-Pb | C-Bi | C-Po | C-At | Rn |
| Fr | C-Ra | * * | Lr | Rf | Db | C-Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| ↓ | ||||||||||||||||||
| * | C-La | C-Ce | C-Pr | C-Nd | C-Pm | C-Sm | C-Eu | C-Gd | C-Tb | C-Dy | C-Ho | C-Er | C-Tm | C-Yb | ||||
| * * | Ac | C-Th | C-Pa | C-U | C-Np | C-Pu | C-Am | C-Cm | C-Bk | C-Cf | C-Es | Fm | Md | No | ||||
| Liaison de base en chimie organique | Nombreuses utilisations en chimie |
| Recherche académique, peu d'usages courants | Liaison inconnue / non évaluée |

