Configuration électronique
En physique des particules comme en chimie quantique, la configuration électronique, également appelée structure électronique ou formule électronique, décrit la distribution des électrons d'un atome, d'une molécule ou d'une espèce chimique dans un ensemble de fonctions d'onde correspondant à des orbitales atomiques ou à des orbitales moléculaires[1]. Par exemple, la configuration électronique à l'état fondamental d'un atome d'oxygène est 1s2 2s2 2p4, tandis que celle d'une molécule de dioxygène O2 est 1σ2
g 1σ2
u 2σ2
g 2σ2
u 1π4
u 3σ2
g 1π2
g, d'où, en spectroscopie, les multiplets 3Σ
g, 1Δ
g et 1Σ+
g.

Une configuration électronique est entièrement déterminée par la connaissance de la spinorbitale de chaque électron, c'est-à-dire de son orbitale et de son spin. Ces configurations décrivent chaque électron comme se déplaçant dans une orbitale de manière indépendante dans un champ moyen généré par les autres orbitales. D'un point de vue mathématique, elles sont calculées à l'aide de déterminants de Slater ou de fonctions d'état de configuration.
Conséquence des lois de la mécanique quantique, une énergie est associée à chaque configuration électronique. Dans certaines conditions, les électrons peuvent passer d'une configuration à une autre moyennant l'émission ou l'absorption d'un quantum d'énergie sous la forme d'un photon.
La connaissance des configurations électroniques permet de comprendre la construction du tableau périodique des éléments. Elle permet également de décrire la liaison chimique dans les molécules, et d'expliquer certaines propriétés des matériaux, comme la liaison métallique, les lasers ou encore la nature des semiconducteurs.
Éléments théoriques
Fonctions d'onde et spinorbitales
Chaque électron 







.
Configurations électroniques et niveaux d'énergie
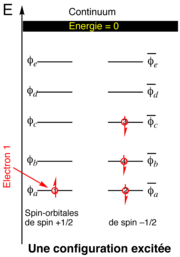
Chaque configuration électronique est associée à un niveau d'énergie, qui résulte à la fois de l'énergie des électrons sur chaque spinorbitale et des énergies d'interaction entre ces électrons, comme les interactions d'échange provenant de la répulsion entre électrons. Un même atome ou une même molécule peuvent présenter plusieurs configurations électroniques, et donc plusieurs états d'énergie. L'état de plus basse énergie est dit état fondamental, tous les autres étant qualifiés d'états excités. Le remplissage des spinorbitales à l'état fondamental se fait par niveau d'énergie croissant et, en cas d'égalité entre niveaux d'énergie de spinorbitales différentes, en remplissant d'abord celle de spin + 12 avant de peupler celles de spin – 12 (règle de Hund).
Multiplicité de spin
La somme des spins de chaque électron donne le spin total S de la configuration. Ce nombre donne directement la multiplicité de spin associé à cette dernière, qui vaut 2S + 1 et en représente le nombre de « micro-états ». Ceux-ci sont caractérisés par la même énergie mais peuvent être discernés par certaines spectroscopies :
- une configuration à deux électrons appariés conduit à un seul micro-état, dit singulet car il n'y a qu'une seule façon de placer deux électrons dans la même orbitale ;
- une configuration à un électron célibataire conduit à un état doublet car il existe deux micro-états : celui où le spin est vers le haut (ms = + 12), et celui où le spin est vers le bas (ms = – 12) ;
- une configuration à deux électrons célibataires correspond à un état singulet si leurs spins sont opposés, et à un état triplet si leurs spins sont parallèles.
Application aux atomes
Dans le modèle quantique d'un atome ou d'une molécule, les électrons ne gravitent pas autour des noyaux atomiques comme dans le modèle planétaire de Rutherford ou le modèle de Niels Bohr, mais se répartissent dans un volume autour de ces noyaux de manière probabiliste. Cette probabilité est évaluée par la fonction d'onde associée à l'électron et se matérialise sous la forme d'une orbitale atomique ou d'une orbitale moléculaire selon qu'on considère un atome isolé ou une molécule.
Nombres quantiques
Dans un atome — la situation est plus complexe dans une molécule ou dans un cristal — l'état quantique d'un électron est entièrement décrit par quatre nombres quantiques :
- le nombre quantique principal n, un nombre entier naturel non nul : n ≥ 1 ;
- le nombre quantique azimutal ℓ, un nombre entier positif ou nul vérifiant 0 ≤ ℓ ≤ n – 1 et lié à la quantification du moment angulaire de l'orbitale ;
- le nombre quantique magnétique mℓ, un nombre entier vérifiant – ℓ ≤ mℓ ≤ ℓ et lié à la quantification de la projection du moment angulaire sur un axe donné ;
- le nombre quantique magnétique de spin ms, lié à la projection du spin de l'électron sur un axe de quantification, et qui vaut – 12 ou + 12, les électrons correspondants étant couramment représentés par les symboles ↓ et ↑ ; il s'agit d'une propriété intrinsèque de l'électron, indépendante des trois autres nombres quantiques.
Couches, sous-couches et orbitales
| s (ℓ = 0) | p (ℓ = 1) | |||
|---|---|---|---|---|
| mℓ = 0 | mℓ = 0 | mℓ = ±1 | ||
| s | pz | px | py | |
| n = 1 |  | |||
| n = 2 |  |  |  |  |
Les termes couche, sous-couche et orbitale sont hérités du modèle de Bohr, qui faisait orbiter les électrons sur des trajectoires circulaires de rayon croissant en formant des couches successives autour du noyau atomique. Ils sont encore très largement employés bien que la réalité physique qu'ils décrivent relève de la mécanique quantique.
- Le nombre quantique principal n seul identifie une couche électronique. Les différentes couches sont aussi désignées par une lettre majuscule : K (n = 1), L (n = 2), M (n = 3), N (n = 4), O (n = 5), P (n = 6) et Q (n = 7).
- Le couple de nombres quantiques (n, ℓ) identifie une sous-couche électronique.
- Le triplet (n, ℓ, mℓ) identifie une orbitale atomique, ou case quantique.
En vertu du principe d'exclusion de Pauli, deux électrons d'un même atome ne peuvent partager le même état quantique[2], ce qui signifie qu'au plus deux électrons de nombres quantiques de spin opposés peuvent occuper une même case quantique : lorsqu'un seul électron occupe une orbitale atomique, on parle d’électron célibataire ; lorsque deux électrons occupent une orbitale atomique, on parle d’électrons appariés.
À chaque couple (n, ℓ) est associée une notation permettant de décrire le type de sous-couche correspondant :
- ℓ = 0 : sous-couche de type s (pour sharp ou simple), notée ns et contenant au plus 2 électrons ;
- ℓ = 1 : sous-couche de type p (pour principal), notée np et contenant au plus 6 électrons ;
- ℓ = 2 : sous-couche de type d (pour diffuse), notée nd et contenant au plus 10 électrons ;
- ℓ = 3 : sous-couche de type f (pour fine ou fundamental), notée nf et contenant au plus 14 électrons ;
- ℓ = 4 : sous-couche de type g, notée ng et contenant au plus 18 électrons.
Les noms s, p, d et f de ces sous-couches proviennent d'un système de catégorisation à partir des raies spectrales fondé sur l'observation de leur structure fine, d'où les qualificatifs sharp, principal, diffuse et fundamental. Quand les quatre premiers types de sous-couches ont été décrits, ils furent associés à ces quatre types de raies spectrales. Les lettres suivant le type f sont définies en fonction de l'ordre alphabétique : g, h, i, etc.
Par construction, une couche électronique n peut contenir au plus 2n2 électrons[a], tandis qu'une sous-couche ℓ peut contenir au plus 2(2ℓ + 1) électrons, répartis entre les différentes orbitales atomiques mℓ de la façon suivante :
Dénombrement des électrons par sous-couches des cinq premières couches électroniques Nombres quantiques Sous-couche Nombre quantique magnétique mℓ Nombre d'électrons Principal Azimutal -4 -3 -2 -1 0 1 2 3 4 Sous-couche Couche n = 1 ℓ = 0 1s ↑ ↓ 2 2 n = 2 ℓ = 0 2s ↑ ↓ 2 8 ℓ = 1 2p ↑ ↓ ↑ ↓ ↑ ↓ 6 n = 3 ℓ = 0 3s ↑ ↓ 2 18 ℓ = 1 3p ↑ ↓ ↑ ↓ ↑ ↓ 6 ℓ = 2 3d ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ 10 n = 4 ℓ = 0 4s ↑ ↓ 2 32 ℓ = 1 4p ↑ ↓ ↑ ↓ ↑ ↓ 6 ℓ = 2 4d ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ 10 ℓ = 3 4f ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ 14 n = 5 ℓ = 0 5s ↑ ↓ 2 50 ℓ = 1 5p ↑ ↓ ↑ ↓ ↑ ↓ 6 ℓ = 2 5d ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ 10 ℓ = 3 5f ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ 14 ℓ = 4 5g ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ 18
Règle de Klechkowski et règle de Hund

La distribution des électrons selon les différentes sous-couches électroniques à l'état fondamental privilégie l'occupation des orbitales atomiques de plus faible énergie. L'énergie d'un électron sur une orbitale peut être calculée à partir des nombres quantiques qui en définissent l'état quantique, en faisant notamment intervenir des déterminants de Slater. En première approche, cette énergie est déterminée par le couple (n, ℓ) : elle croît avec la somme n + ℓ et, en cas d'égalité de cette somme entre couples différents, elle croît avec n. Cette règle, pressentie par Charles Janet en 1929, formulée par Erwin Madelung en 1936[3] et expliquée par Vsevolod Kletchkovski[4], est appelée pour cette raison règle de Klechkowski, et le principe qui en découle pour le remplissage des électrons entre sous-couches électroniques est appelé principe d'Aufbau, d'un mot allemand signifiant « édification ».
La règle de Klechkowski implique donc que les électrons occupent successivement les sous-couches d'un atome dans l'ordre suivant :
- 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
Cette règle découle cependant d'une approximation et doit être affinée afin de rendre compte des configurations électroniques observées. Environ un élément sur cinq présente en effet une distribution des électrons à l'état fondamental qui s'écarte légèrement de celle prédite par la simple application de la règle de Klechkowski. Cela provient du fait que les nombres quantiques n et ℓ ne sont pas seuls à prendre en compte pour déterminer l'énergie d'un électron sur une orbitale atomique. En particulier, une orbitale est d'autant plus stable que le nombre quantique magnétique de spin résultant des électrons qui l'occupent est élevé (règle de Hund). Il s'ensuit que, pour les éléments du bloc d et du bloc f (métaux de transition, lanthanides et actinides), il est énergétiquement moins favorable de suivre la règle de Klechkowski que de favoriser l'occupation impaire des sous-couches les plus externes lorsque la couche d ou f est vide, à moitié remplie ou entièrement remplie, car l'écart d'énergie entre ces sous-couches est inférieur au gain d'énergie induit par la redistribution des électrons maximisant leur nombre quantique magnétique de spin résultant.
Ionisation des éléments de transition
L'ordre dans lequel les électrons remplissent les orbitales atomiques n'est pas le même que l'ordre dans lequel les électrons sont arrachés des atomes pour former des cations. Ainsi, l'ordre des sous-couches affectées par l'ionisation décroissante d'un atome n'est pas l'inverse de l'ordre issu de la règle de Klechkowski — n + ℓ croissant puis n croissant — mais suit un ordre dans lequel les nombres quantiques individuels sont croissants — n croissant puis ℓ croissant.
Par exemple, l'atome de titane Ti et l'ion de fer ionisé quatre fois Fe4+ ont tous deux 22 électrons mais présentent respectivement les configurations [Ar] 4s2 3d2 et [Ar] 3d4. Cela provient du fait que l'ordre relatif des niveaux d'énergie associés aux différentes orbitales ne dépend pas que de leurs nombres quantiques, mais également de la charge électrique du noyau atomique, qui vaut +22 dans le cas du titane mais +26 dans le cas du fer. L'ordre de remplissage des sous-couches d'un cation de moins en moins ionisé est donc :
- 1s → 2s → 2p → 3s → 3p → 3d → 4s → 4p → 4d → 4f → etc.
Notation
Les physiciens et les chimistes utilisent une notation standard pour indiquer la configuration électronique des atomes. Le principe consiste à noter les sous-couches électroniques avec, en exposant, le nombre d'électrons occupant chacune de ces sous-couches. L'atome d'hydrogène ayant un unique électron, sa configuration électronique à l'état fondamental s'écrit ainsi 1s1, ce qui dénote la présence d'un électron sur la sous-couche 1s, correspondant à n = 1 et ℓ = 0. L'hélium, dont l'atome possède deux électrons, présente la configuration électronique 1s2 à l'état fondamental. Le lithium, avec trois électrons, présente, à l'état fondamental, la configuration 1s2 2s1, tandis que l'oxygène, avec huit électrons, présente, à l'état fondamental, la configuration 1s2 2s2 2p4, et que l'aluminium, avec treize électrons, présente, à l'état fondamental, la configuration 1s2 2s2 2p6 3s2 3p1.
Pour les atomes comportant de nombreux électrons, cette notation devient très longue. À l'état fondamental, on utilise alors une notation abrégée en représentant les électrons de cœur par le gaz noble ayant la même configuration. Ainsi, les dix électrons de cœur de l'aluminium, correspondant à la configuration électronique du néon (1s2 2s2 2p6), sont représentés par le symbole chimique de cet élément mis entre crochets, de sorte qu'on n'explicite que les trois électrons de valence : la configuration électronique de l'aluminium à l'état fondamental s'écrit ainsi [Ne] 3s2 3p1.
L'ordre dans lequel les sous-couches sont listées n'est pas fixé, et importe peu dans la mesure où c'est le nombre d'électrons par sous-couche qui importe. Ainsi, la configuration électronique du plomb peut-elle indifféremment être écrite [Xe] 6s2 4f14 5d10 6p2 par énergies croissantes, suivant la règle de Klechkowski pour les atomes électriquement neutres, ou [Xe] 4f14 5d10 6s2 6p2 par nombres quantiques n puis ℓ croissants, suivant l'ordre inverse d'ionisation pour former des cations, observé en spectroscopie.
Configuration électronique des 118 éléments chimiques
La construction du tableau périodique des éléments découle directement du principe d'Aufbau par application de la règle de Klechkowski. Les périodes du tableau sont telles qu'elles se terminent toujours par un élément chimique dont la couche de valence est saturée en électrons, tandis que la succession des sous-couches s, p, d et f définit les blocs homonymes (bloc s, bloc p, bloc d et bloc f).
La configuration électronique des 118 éléments reconnus par l'IUPAC est présentée dans le tableau ci-dessous. Elle peut être expliquée à la fois par la règle de Klechkowski faisant intervenir les nombres quantiques principal n et azimutal ℓ, et la règle de Hund faisant intervenir le nombre quantique magnétique de spin ms ; cette dernière implique que, pour les éléments du bloc d et du bloc f (métaux de transition, lanthanides et actinides), il est énergétiquement moins favorable de suivre la règle de Klechkowski que de favoriser l'occupation impaire des sous-couches les plus externes lorsque la sous-couche d ou f est vide, à moitié remplie ou entièrement remplie, car l'écart d'énergie entre ces sous-couches est inférieur au gain d'énergie induit par la redistribution des électrons maximisant leur nombre quantique magnétique de spin résultant (dans le tableau qui suit, les distributions d'électrons irrégulières sont indiquées en rouge et gras) :
Application aux molécules
Dans le cas des molécules, le calcul des orbitales moléculaires est plus complexe que dans le cas des atomes isolés. Plusieurs méthodes permettent d'établir ces orbitales, comme la combinaison linéaire d'orbitales atomiques, utilisées en chimie numérique pour calculer les structures et les propriétés des espèces chimiques à l'aide d'outils informatiques modélisant les lois de la chimie théorique.
La notation de la configuration électronique d'une molécule repose sur les symétries moléculaires σ, π, δ et φ, correspondant à celles des orbitales atomiques s, p, d et f. On parle ainsi de liaison σ, liaison π, liaison δ et liaison φ. Dans le cas des molécules centrosymétriques, un indice g ou u indique la parité de la liaison, de l'allemand gerade « pair » et ungerade « impair ». Le nombre d'électrons de l'orbitale moléculaire ainsi définie est indiqué en exposant.
Dans le cas de la molécule d'oxygène O2, la configuration électronique peut être écrite indifféremment 1σ2
g 1σ2
u 2σ2
g 2σ2
u 3σ2
g 1π4
u 1π2
g[6],[7] ou 1σ2
g 1σ2
u 2σ2
g 2σ2
u 1π4
u 3σ2
g 1π2
g[1].
Une autre représentation, employée pour les molécules diatomiques, fait intervenir le terme moléculaire noté 2S+1Λ(+/−)
Ω,(g/u), où S est le spin total, Λ la projection du moment cinétique orbital sur l'axe internucléaire (représentée par Σ, Π, Δ et Φ pour Λ valant 0, 1, 2 et 3), Ω la projection du moment cinétique total sur l'axe internucléaire, g/u l'indication d'une symétrie paire/impaire, et +/− la symétrie de réflexion autour d'un plan arbitraire contenant l'axe internucléaire.
Dans le cas de la molécule d'oxygène O2, les termes sont 3Σ
g, 1Δ
g et 1Σ+
g.
Application aux cristaux
Dans un solide, les états électroniques deviennent très nombreux. Ils cessent d'être discrets, et se mélangent ensemble en une étendue continue d'états possibles, comme la bande de valence ou la bande de conduction. La notion de configuration électronique cesse d'être pertinente, et laisse la place à la théorie des bandes.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Electron configuration » (voir la liste des auteurs).
Notes
Références
Voir aussi
Articles connexes
Liens externes
- Orbitales atomiques : Changez n, l, m et cliquez "plot" (java 1.5 requis)
