משתמש:Tsabarn/תעשיית התרופות

תעשיית התרופות מגלה, מפתחת, מייצרת, ומשווקת תרופות כאמצעים לטיפול.[1] חברות התרופות עוסקות בתרופות גנריות או מותגיות ובמכשור רפואי. הן כפופות למגוון של חוקים ותקנות המסדירים פטנטים, בדיקות, בטיחות, בחינת יעילות ושיווק של תרופות.
לתעשיית התרופות המודרנית שני מקורות. הראשון הוא בתי מרקחת מקומיים שהרחיבו את עיסוקם המסורתי בהפצת מוצרים מצמחי מרפא כגון מורפיום וכינין לכדי ייצור סיטוני באמצע המאה ה-19. גילוי תרופות שיטתי מצמחים התפתח במיוחד בעקבות בידוד מורפיום, כתרופה להרגעה ולשינה שהופקה מאופיום, על-ידי שוליית-הרוקח הגרמני פרידריך שרטינר (Sertürner), שכינה אותו כך על שם האל היווני של החלומות, מורפיוס. תאגידים רב לאומיים, כולל מרק, הופמן-לה רוש, בורוז-Wellcome (כיום חלק גלקסו סמית קליין), מעבדות אבוט, אלי לילי ו - אפג'ון (כיום חלק מפייזר) החלו כבתי מרקחת מקומיים באמצע המאה ה-19. לקראת סוף שנות ה-80 של אותה מאה, שיפרו יצרני צבע גרמנים את תהליך הזיקוק של תרכובות אורגניות מזפת פחמית ומעוד מחצבים וכן ביססו שיטות ראשוניות של סינתזה כימית אורגנית.[2] התפתחות שיטות סינתזה כימיות איפשרה למדענים לגוון באופן שיטתי את המבנים של החומרים הכימיים, והתפתחות תורת הפרמקולוגיה הרחיבה את יכולתם להעריך את ההשפעות הביולוגיות של המבנים האלו.
בשנות ה-90 של המאה ה-19, התגלתה ההשפעה העצומה של תמציות בלוטת יותרת הכליה על רקמות שונות, והוחל בחיפוש אחר המנגנון הכימי של העברת האות ובחיפוש דרכים לנצל תצפיות אלה לפיתוח תרופות חדשות. ההשפעות של תמציות בלוטת יותרת הכליה - כיווץ (הצרת) כלי-הדם והעלאת לחץ הדם - עניינו במיוחד מנתחים, אשר השתמשו בהן לצורך עצירת דימום וכטיפול בהלם. מספר חברות פיתחו מוצרים המבוססים על תמציות בלוטת יותרת הכליה שהכילו חומר פעיל במידות שונות של זיקוק. בשנת 1897, ג'ון אבל (John Abel) מאוניברסיטת ג'ון הופקינס זיהה את החומר הפעיל, אפינפרין, אותו בודד מהתערובת כמלח גופרתי. מאוחר יותר, הכימאי התעשייתי יוקישי טקמינה (Jokichi Takamine) פיתח שיטה להשגת אפינפרין טהור, ורשם את הזכויות על השיטה על שם פארקה דיוויס. פארקה דיוויס שיווק אפינפרין תחת השם המסחרי אדרנלין. הזרקת אפינפרין הוכחה כיעילה במיוחד כטיפול מיידי בהתקפי אסתמה, וגירסה למשאף נמכרה בארצות הברית עד 2011 (ערפל Primatene).[3][4] ב-1929 נארז אפינפרין במשאף לשימוש כטיפול נגד גודש באף.
למרות יעילותו, הצורך בהזרקה הגביל את השימוש באדרנלין ולכן חיפשו החוקרים נגזרים שניתן לתת פומית (כלומר, בבליעה). אפדרין, תרכובת הדומה למבנה של אדרנלין (ועוד יותר, לנוראדרנלין), זוהה על ידי כימאים יפנים בצמח מא-הואנג (אפדרה) ושווק על ידי חברת אלי לילי כתרופה פומית לטיפול באסתמה. בעקבות עבודתם של הנרי דייל וג'ורג' ברגר בחברת בורוז-וולקום, סינתז הכימאי האקדמאי גורדון אלס את האמפטמין ובחן אותו בחולי אסתמה בשנת 1929. נמצא שלתרופה השפעה מעטה נגד-אסתמה אבל היא מביאה לתחושות של התרוממות הרוח ודפיקות לב. חברת סמית', קליין ופרנץ' פיתחה משאף אמפטמין נגד גודש באף תחת השם המסחרי בנזדרין. בסופו של דבר, אמפטמין פותח לטיפול בנרקולפסיה ובפרקינסוניזם פוסט-אנצפליטי, להעלאת מצב רוח בדיכאון ולהתוויות פסיכיאטריות נוספות. ב-1937, איגוד הרפואה האמריקני אישר את האמפטמין כ"תרופה חדשה ולא רשמית" לשימושים אלו. אמפטמין נותר בשימוש נרחב כטיפול בדכאון עד לפיתוח נוגדני הדכאון הטריציקליים בשנות ה-60 של המאה-20.

ב-1903, פירסמו הרמן אמיל פישר וג'וזף פון מרינג את תגליתם כי חומצה דיאתיל-ברביטורית, הנוצרת מתגובה של חומצה דיאתיל-מאלונית, אוקסי-כלוריד זרחני ואוריאה, משרה שינה בכלבים. הפטנט על התגלית נרשם על שם חברת התרופות באייר, אשר שיווקה את התרכובת בשם המסחרי ורונאל, לשיפור השינה, החל מ-1904. מחקרים שיטתיים לגבי ההשפעה של שינויי מבנה על הפוטנטיות ועל משך הפעולה, הביאו לגילוי הפנוברביטל בבאייר ב-1911 ולגילוי השפעתו כנגד פרכוס אפילפטי ב-2012. פנוברביטל היה בין התרופות הנפוצות לשימוש כטיפול באפילפסיה בשנות ה-70 של המאה ה-20, ונכון ל-2014, נשאר ברשימת התרופות החיוניות של ארגון הבריאות העולמי. [5][6]בין השנים 1950-1970 הופיעה מודעות גוברת ליכולת הממכרת של ברביטורטים ושל אמפטמינים, שהביאה להגבלות על השימוש ולפיקוח ממשלתי גובר על נותני המרשמים. כיום, השימוש באמפטמין מוגבל בעיקר לטיפול בהפרעת קשב, והשימוש בפנוברביטל מוגבל בעיקר לטיפול באפילפסיה. [7][8]
בסדרת ניסויים שבוצעו סביב תחילת המאה ה-20 נמצא כי סוכרת נגרמת עקב חסרונו של של חומר המיוצר בלבלב. ב-1869, אוסקר מינקובסקי ו-ג'וזף פון מרינג מצאו כי סוכרת יכולה להיגרם בכלבים על-ידי כריתה של הלבלב. בשנת 1921, פרופסור פרדריק בנטינג הקנדי ותלמידו צ'ארלס בסט חזרו על המחקר ומצאו כי הזרקות של תמצית לבלב תיקנו את התסמינים שיצרה כריתת הלבלב. תוך זמן קצר הודגמה פעולת התמצית אצל בני אדם, אבל פיתוח של טיפול באינסולין כטיפול שגרתי נתקל בקשיים בייצור חומר בכמות מספקת ובמידת ניקיון אמינה. החוקרים ביקשו סיוע ושיתוף פעולה של אנשי חברת אלי לילי ושות' לאור ניסיונה בזיקוק בקנה מידה גדול של חומרים ביולוגיים. הכימאי ג'ורג ' וולדן מאלי לילי מצא כי התאמה זהירה של חומציות התמצית איפשרה זיקוק אינסולין ברמה יחסית טובה. תחת לחץ של אוניברסיטת טורונטו, ופוטנציאל למלחמת פטנטים מול מדעני אקדמיה שפיתחו שיטת זיקוק דומה באופן עצמאי, הושג הסכם לבלעדיות-ייצור של אינסולין על ידי מספר חברות. לפני הגילוי והזמינות הנרחבת של אינסולין, תוחלת החיים של חולי סוכרת היתה רק חודשים ספורים.שגיאת ציטוט: תג <ref> לא תקין; להערות שוליים ללא שם חייב להיות תוכן
הפיתוח של תרופות לטיפול במחלות זיהומיות היה מוקד מרכזי של המחקר ומאמצי הפיתוח המוקדמים; ב-1900, דלקת ריאות, שחפת ושלשולים היו שלושת הגורמים המובילים למוות בארצות הברית, התמותה בשנה הראשונה לחיים עלתה על 10%.[9][10]
ב-1911 פיתחו פול ארליך והכימאי אלפרד ברטהיים מהמכון לטיפול ניסיוני בברלין את הארספנמין (arsphenamine), התרופה הסינתטית הראשונה נגד זיהום. התרופה כונתה בשם המסחרי סאלברסאן.[11] ארליך, ששם לב הן לרעילות הכללית של ארסן והן לספיגה הברירנית של צבעים מסוימים על ידי חיידקים, שיער כי צבעים כאלו המכילים ארסן יוכלו לשמש לטיפול נגד זיהומים חיידקיים. ארספנמין יוצר כחלק מיוזמה להפקת סדרה של תרכובות כאלה, ונמצא כי יש לו רעילות ברירנית באופן חלקי. ארספנמין הוא הראשון שהוכח כטיפול יעיל נגד עגבת, מחלה אשר לפני כן הייתה חשוכת מרפא, והובילה באופן בלתי נמנע לכיבי עור חמורים, לנזק מוחי ולמוות.[דרוש מקור]
גישתו של ארליך, שינוי שיטתי של המבנה הכימי של חומרים סינתטיים ומדידת ההשפעות של שינויים אלה על הפעילות הביולוגית, הומשכה באופן נרחב על ידי מדעני התעשייה, כולל מדעני באייר ג'וזף קלרר, פריץ מיצש וגרהרד דומק. עבודה זו, שהתבססה גם על בדיקות של תרכובות זמינות מתעשיית הצבע הגרמנית, הובילה לפיתוח של פרונטוזיל (Prontosil), הנציג הראשון של האנטיביוטיקות מקבוצת הסולפונאמידים (sulfonamide). לעומת הארספנמין, לסולפונאמידים תחום רחב של פעילות והם הרבה פחות רעילים, מה שעושה אותם שימושיים גם כנגד זיהומים הנגרמים על ידי סטרפטוקוקים.[12] ב-1939 קיבל דומק פרס נובל לרפואה על גילוי זה.[13][14] עם זאת, הירידה הדרמטית במספר מקרי המוות ממחלות זיהומיות שהתרחשו לפני מלחמת העולם השנייה היתה בעיקר תוצאה של שיפור אמצעים בריאותיים ציבוריים, כגון מים נקיים ודיור פחות צפוף, בעוד ההשפעה של תרופות אנטיביוטיות ושל חיסונים היתה משמעותית בעיקר לאחר מלחמת העולם השנייה.[15][16]
בשנת 1928, גילה אלכסנדר פלמינג את ההשפעות האנטיבקטריאליות של פניצילין, אבל ניצולן לטיפול במחלות אנושיות המתין עד לפיתוח שיטות זיקוק וייצור בקנה מידה גדול. אלו פותחו על ידי התאגדות של חברות התרופות שהובילו ממשלות ארה"ב ובריטניה במהלך מלחמת העולם השנייה.[17]
במהלך תקופה זו, חלה התקדמות התחלתית לקראת פיתוח חיסונים, בעיקר בדרך של מחקר בסיסי אקדמי או במימון ממשלתי, שהופנה לזיהוי של מחוללי-מחלה האחראים למחלות מדבקות נפוצות. בשנת 1885 יצרו לואי פסטר ופייר פול אמיל רו את חיסון הכלבת הראשון. חיסוני הדיפתריה הראשונים יוצרו בשנת 1914 מתערובת של רעלן דיפטריה ואנטי-טוקסין (מופק מנסיוב של בעלי חיים שהודבקו), אבל בטיחות החיסון היתה גבולית ולא נעשה בו שימוש נרחב. בשנת 1921 נרשמו בארה"ב 206,000 מקרים של דיפתריה וכתוצאה מהם 15,520 נפטרים. בשנת 1923, במקביל למאמצי גסטון רמון ב"מכון פסטר" ואלכסנדר גלני ב"מעבדות מחקר וולקום" (מאוחר יותר חלק מ-GlaxoSmithKline), הובילו לגילוי כי חיסון יכול להיות בטוח יותר על ידי טיפול ברעלן-הדיפטריה עם פורמלין.[18] ב-1944, מוריס הילמן מחברת התרופות סקוויב פיתח לראשונה חיסון נגד דלקת מוח יפנית.[19] מאוחר יותר, עבר הילמן לחברת מרק, שם שיחק תפקיד מפתח בפיתוח חיסונים נגד חצבת, חזרת, אבעבועות רוח, אדמת, צהבת A, צהבת B ודלקת קרום המוח.

לפני המאה ה-20, תרופות יוצרו בדרך כלל על ידי יצרנים בקנה מידה קטן ועם מעט חקיקה אסדרתית על הייצור או על טענות בטיחות ויעילות. כאשר חוקים כאלה היו קיימים, אכיפתם היה רפה. בארה"ב, הדרבון לרגולציה מוגברת של חיסונים ושל עוד תרופות ביולוגיות, נוצר בארה"ב מהתפרצויות טטנוס וממקרי מוות שנגרמו על ידי הפצה של חיסוני-אבעבועות-שחורות ונוגדני-דיפטריה שהיו מזוהמים.[20] חוק הפיקוח הביולוגי מ-1902 קבע כי יידרש אישור ממשלה פדרלי טרם שיווקה של כל תרופה ביולוגית וכן יידרש אישור עבור התהליך ומתקן הייצור של תרופות כאלו.
בשנת 1906 התווסף בארה"ב גם חוק התרופות והמזונות הנקיים, אשר אסר על הפצה בין-מדינתית של מזון ותרופות קלוקלים או מזויפים. תרופות הוגדרו כמזויפות אם הכילו אלכוהול, מורפיום, אופיום, קוקאין, או כל חומר אחר העלול להיות מסוכן או ממכר, ואם התווית שלו איננה מציינת את כמותם או שיעורם של חומרים כאלו. עם זאת, בפסיקת בית המשפט העליון נידחו ניסיונות ממשלתיים להשתמש בחוק גם כדי לתבוע יצרנים על טענות-יעילות שאינן מבוססות.[21]
בשנת 1937, מעל 100 אנשים מתו לאחר בליעת "אליקסיר סולפנילאמיד" שיוצר על ידי חברת S.E. Massengill של טנסי. המוצר הוכן עם דיאתילן גליקול, שהוא ממס רעיל מאוד הנמצא כיום בשימוש נרחב כחומר נגד קיפאון.[22] על פי החוקים שהיו בתוקף באותו זמן, התביעה של היצרן התאפשרה רק בסעיף טכני, כי המוצר נקרא "אליקסיר", אשר משמעותו מומס באתנול. בעקבות ארוע זה, אישר הקונגרס האמריקאי את חוק המזון, התרופות והקוסמטיקה של 1938, אשר בפעם הראשונה דרש הוכחת בטיחות לפני מכירת התרופה וכן אסר במפורש על טענות-יעילות כוזבות.[23]
השנים שאחרי המלחמה, 1945-1970
התקדמות במחקר נגד זיהומים
בסיומה של מלחמת העולם השנייה חלה עליה דרמטית בגילויין של קבוצות חדשות של תרופות אנטי-בקטריאליות[24], שכללה צפלוספורינים (שפותח על ידי אלי לילי על בסיס עבודתם הראשונית של ג'וזפה ברוצו ואדוארד אברהם),[25][26] סטרפטומיצין (שהתגלה במהלך מחקר במעבדת סלמן ווקסמן באוניברסיטת ראטגרס ב-1943, במימון חברת מרק[27]), טטרציקלינים[28] (שנתגלו במעבדות לדרלה, שהן כיום חלק מפייזר), אריתרומיצין (שהתגלתה במעבדות אלי לילי ושות')[29] ושל פיתוחיהן, עם פעילות מתרחבת כנגד מגוון של חיידקים מחוללי-מחלות. סטרפטומיצין היה הטיפול היעיל הראשון נגד שחפת. בזמן התגלית, 'בתי הבראה' לבידוד אנשים נגועי שחפת נמצאו בכל עיר במדינות המפותחות, בהם נפטרו 50% מהחולים בתוך 5 שנים מכניסתם.[30]
דו"ח נציבות הסחר הפדרלית מ-1958 ניסה לכמת את ההשפעה של אנטיביוטיקה על בריאות הציבור האמריקאי. דווח כי בשנים 1946-1955, חלה ירידה של 42% בשכיחות מחלות אשר אנטיביוטיקה יעילה כנגדן, לעומת רק 20% ירידה בשכיחות מחלות אשר אנטיביוטיקה לא יעילה נגדן. מסקנת הדו"ח היתה כי "נראה שהשימוש באנטיביוטיקה, באבחון מוקדם, וכן גורמים אחרים הגבילו את התפשטות המגיפות וכך את מספר המחלות האלו אשר התרחשו". מחקר נוסף בדק את שיעורי התמותה עבור שמונה מחלות נפוצות אשר אנטיביוטיקה הציעה טיפול יעיל נגדן (עגבת, שחפת, דיזנטריה, שנית, שעלת, זיהומים מנינגוקוקליים, דלקת ריאות), ונמצאה ירידה של 56% לעומת התקופה המקבילה.[31] בולטת בין אלה היתה הירידה של 75% בשיעור מקרי מוות עקב שחפת.[32]

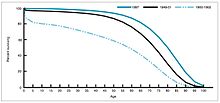
<ref> לא תקין; להערות שוליים ללא שם חייב להיות תוכןבמהלך השנים 1940-1955, הואץ קצב הירידה בשיעור התמותה בארה"ב מ-2% בשנה ל-8% בשנה, ואז חזר לקצב הקודם של 2% לכל שנה. הירידה הדרמטית בשנים שלאחר המלחמה יוחסה להתפתחות המהירה של טיפולים חדשים ושל חיסונים נגד מחלות זיהומיות.פיתוח החיסונים המשיך להאיץ, ובלט במיוחד בתקופה זו פיתוח חיסון הפוליו (1954) על ידי ג'ונאס סאלק במימון הקרן הלאומית של שיתוק הילדים (מוסד ללא כוונת רווח). תהליך החיסון לא נרשם כפטנט, ונמסר לחברות התרופות כך שהתאפשר ייצור בעלות נמוכה כתרופה גנרית. ב-1960, זיהה מוריס הילמן מחברת מרק-שארפ-ודוהם את וירוס ה-SV40, שבהמשך נמצא כגורם גידולים במיני יונקים רבים. מאוחר יותר נקבע, כי SV40 זיהם אצוות חיסוני פוליו שניתנו ל-90% מילדי ארה"ב.[33][34] מקור הזיהום הוא כנראה בתאים המקוריים וברקמות הקוף ששימשו לייצור. ב-2004 הודיע מכון הסרטן של ארה"ב כי הגיע למסקנה ש-SV40 לא קשור בסרטן אצל בני אדם.[35]
חיסונים חדשים בולטים אחרים של התקופה כוללים את חיסוני החצבת (1962, ג'ון פרנקלין אנדרס המרכז הרפואי לילדים של בוסטון, עם שיפור בהמשך על ידי מוריס הילמן מ"מרק"), האדמת (1969, הילמן, "מרק"), חזרת (1967,הילמן, "מרק"). חלה נפילה של מעל 95% בהארעות של אדמת, תסמונת אדמת מולדת, חצבת וחזרת בעקבות החיסון הנרחב.[36] הוערך כי ב-20 השנים שלאחר רישוי החיסון נגד חצבת בארה"ב נמנעו כ-52-מיליון מקרים של המחלה, 17,400 מקרים של פיגור שכלי, ו-5,200 מקרי מוות.[37]
פיתוח ושיווק של תרופות נוגדות יתר לחץ דם
יתר לחץ דם הוא גורם סיכון לטרשת עורקים,[38] אי ספיקת לב,[39] מחלת עורקים כלילית,[40][41] שבץ,[42] מחלת כליות,[43][44] ומחלת עורקים היקפית,[45][46], והוא גורם הסיכון המוכר ביותר לתחלואת הלב וכלי הדם ולתמותה, במדינות המתועשות.[47] לפני 1940, כ-23% מכלל מקרי המוות בקרב אנשים מעל גיל 50 יוחסו ליתר לחץ דם. מקרים חמורים של יתר לחץ דם טופלו על ידי ניתוח.[48]
פיתוחים מוקדמים בתחום של טיפול ביתר לחץ דם כללו חוסמי מערכת עצבים סימפתטית מסוג יוני אמוניום רבעוני, אך תרכובות אלו מעולם לא היו בשימוש נרחב, בשל תופעות הלוואי החמורות שלהם וכיוון שניתנו באמצעות הזרקה.
ב-1952 גילו חוקרי Ciba את מרחיב כלי הדם הראשון הזמין בבליעה: הידרלזין.שגיאת ציטוט: תג <ref> לא תקין; להערות שוליים ללא שם חייב להיות תוכן אך נמצא כי הטיפול בהידרלזין בלבד מאבד את הההשפעה לאורך זמן (טכיפילקסיס). בסביבות 1955 נמצא ופותח כלורותיאזיד (chlorothiazide) על ידי קרל ה. באייר, ג'יימס מ. ספראג, ג'ון א. בר ופרדריק ס. נובלו ממרק ושות'. כלורותיאזיד הינו עדיין התרופה הנפוצה ביותר נגד יתר לחץ דם.שגיאת ציטוט: תג <ref> לא תקין; להערות שוליים ללא שם חייב להיות תוכן נטען כי התפתחות זו הייתה קשורה עם ירידה משמעותית בשיעור התמותה בקרב אנשים עם יתר לחץ דם (אם כי שיעור התמותה ממחלות אחרות ירד עוד יותר באותה תקופה).שגיאת ציטוט: תג <ref> לא תקין; להערות שוליים ללא שם חייב להיות תוכן הממציאים זכו בפרס לסקר לבריאות הציבור בשנת 1975 על "הצלת חייהם של אלפים רבים מספור והקלת סבלם של מיליוני קורבנות של יתר לחץ דם".שגיאת ציטוט: תג <ref> לא תקין; להערות שוליים ללא שם חייב להיות תוכן
בסקירת קוקרן מ-2009 הוסק כי תרופות נוגדות יתר לחץ דם מסוג תיאזידים מפחיתות אצל אנשים עם לחץ דם גבוה את הסיכון למוות (ביחס סיכון של 0.89), לשבץ (0.63), למחלת לב כלילית (0.84), ולאירועי לב וכלי דם (0.70).[49] במשך השנים פותחו סוגים אחרים של תרופות נוגדות יתר לחץ דם ונכנסו לשימוש נרחב גם כטיפול משולב, כולל 'משתני לולאה' (לסיקס/פוזיד, Hoechst 1963),[50] חוסמי בטא (ICI 1964)[51] מעכבי ACE, וחוסמי קולטן אנגיוטנסין. לגבי מעכבי ACE הוסק, בסקירת קוקרן מ-2012, כי הם מפחיתים את הסיכון למחלת כליות חדשה (ביחס סיכון של 0.71) ולמוות (0.84) בחולי סוכרת, אם כי הוערכה מידה גבוהה של פרסום-חלקי או סלקטיבי ב-31% מכלל המחקרים.[52]
גלולות למניעת הריון
לפני מלחמת העולם השנייה, נאסרו אמצעי מניעה במדינות רבות, ובארצות הברית, אפילו עצם הדיון בשיטות מניעה הוביל לעיתים לתביעה לפי חוקי קומסטוק. ההיסטוריה של פיתוח הגלולות למניעת הריון קשורה לכן באופן הדוק לתנועה לאמצעי מניעה ולמאמציהן של הפעילות מרגרט סאנגר, מרי דנט, ואמה גולדמן. בהתבסס על מחקר בסיסי שבוצע על ידי גרגורי פינקוס, ועל שיטות סינתטיות לייצור פרוגסטרון שפותחו על ידי קרל דג'רסי ב-Syntex ועל ידי פרנק קולטון מג.ד. סירל ושות', פותחה הגלולה הראשונה למניעת היריון, אנבוייד, על ידי ג.ד. סריל ושות'. ואושרה על ידי ה-FDA ב-1960. בנוסחה המקורי שולבו מינוני יתר גדולים של הורמונים, וגרמה לתופעות לוואי חמורות. עם זאת, עד 1962, 1.2 מיליון נשים אמריקאיות נטלו את הגלולה, ועד 1965 עלה מספרן ל-6.5 מיליון.[53][54][55][56] הזמינות של אמצעי זמני ונוחה למניעת הריון הובילה לשינויים דרמטיים בנורמות החברתיות, כולל הרחבת מרחב סגנונות- החיים העומדים בפני נשים, הפחתת ההסתמכות של נשים על גברים במניעת הריון, עידוד עיכוב הנישואין ועליה בשכיחות מגורים-משותפים טרם הנישואין.[57]
תלידומיד ותיקוני קפאובר-האריס

בעקבות שימוע בקונגרס שערך ב-1959 הסנטור אסטס קיפאובר מטנסי, נוצרה דחיפה לתיקונים של חוק המזון-התרופות-והקוסמטיקה של ארצות הברית. השימוע כיסה מגוון רחב של בעיות, ביניהן פרסומים מטעים, ספקות לגבי תועלת של תרופות והצורך בהגברת הפיקוח על התעשיה. בזמן שבו תנופת החקיקה החדשה נחלשה זמנית עקב ויכוח נרחב, התבררו פרטי האסון שהדגישו את הצורך ברגולציה מקיפה יותר וסיפקו את הכוח המניע להעברתם של חוקים חדשים.
ב-12 בספטמבר 1960, הגישה חברת ויליאם ס. מרל מסינסינטי בקשה לאישור תרופה חדשה לתלידומיד (Kevadon), חומר הרגעה ששווק באירופה מאז 1956. פרנסס קלסי, קצין הרפואה של מנהל המזון והתרופות (FDA) שמונה לבדוק את החומר, האמין כי הנתונים התומכים בבטיחות התלידומיד היו חלקיים. החברה המשיכה ללחוץ על קלסי ועל מנהל-התרופות לאשר את הבקשה עד נובמבר 1961, אז הוצאה התרופה מהשוק הגרמני בשל הקשר שלה עם מומים מולדים חמורים. אלפי תינוקות באירופה ובמקומות אחרים סבלו מתופעות לואי טרטוגניות של תלידומיד. החברה הפיצה את התלידומיד בלי אישור ה-FDA, במסווה של מחקר, ליותר מ-1,000 רופאים ומעל 20,000 אמריקאים קיבלו תלידומיד במסגרת ה"מחקר", ביניהם 624 מטופלות בהריון. 17 ילודים בארה"ב סבלו מהשפעות התרופה.[דרוש מקור]http://www.sciencedirect.com/science/book/9780123878151[דרוש מקור]
אסון התלידומיד "הקים לתחייה" את הצעת החוק של קיפאובר שהייתה תקועה בקונגרס, תיקון קיפאובר-האריס הפך לחוק ב-10 באוקטובר 1962. מאז, על היצרנים להוכיח ל-FDA כי התרופות שלהם יעילות וגם בטוחות לפני שהם יכולים לשווק אותן בארצות הברית. ה-FDA קיבל גם את הסמכות להסדיר את הפרסום של תרופות המרשם ולבסס את שיטות הייצור טוב. החוק דרש, כי על כל התרופות שהוספו בין 1938 וב-1962 יש להוכיח יעילות. מחקר משותף ל-FDA ולאקדמיה הלאומית למדעים הראה כי כ-40% ממוצרים אלה לא היו יעילים. מחקר דומה בהיקפו לגבי תרופות-ללא-מרשם החל עשר שנים מאוחר יותר.[1]
1970–1980
סטטינים
אינסולין
תרופות מסוכנות ותחילת אסדרת התעשייה
ב-1971, זיהה אקירה אנדו, ביוכימאי יפני מחברת התרופות סנקיו (Sankyo), מולקולה בשם מבסטאטין (mevastatin, ML-236B). מבסטאטין, המיוצר על ידי הפטריה הרעילה Penicillium citrinum, מעכב את האנזים HMG-CoA רדוקטאז, שהוא אנזים חיוני המשמש את הגוף לייצר כולסטרול. ניסויים בבעלי חיים הראו הפחתה משמעותית ברמת הכולסטרול יחד עם השפעות רעילות, כולל גידולים, פגיעה בשריר ולפעמים מוות של כלבי המעבדה. כתוצאה מכך מבסטאטין לא שווק לשימוש בבני אדם.
פ. רוי וג'לוס, המדען הראשי ומאוחר יותר מנכ"ל Merck & Co, התעניין ואף נסע מספר פעמים ליפן החל מ-1975. בשנת 1978, בודדה חברת מרק את החומר מבינולין (lovastatin (mevinolin, MK803 מהפטריה אספרגילוס טראוס, אשר שווק ב-1987 בשם המסחרי מבאקור (Mevacor).[2][3][4]
סטטינים
מאמצע המאה ה-19 ועד 1945: מצמחי מרפא לתרופות הסינתטיות הראשונות
השנים שלאחר המלחמה, 1945-1970
באפריל 1994, הוכרזו תוצאות מחקר שבוצע במימון חברת מרק, בשם מחקר ההישרדות עם סימבסטאטין של סקנדינביה ( Scandinavian Simvastatin Survival Study - 4S). החוקרים בדקו סימבסטטין, שמאוחר יותר נמכר על ידי חברת מרק בשם Zocor, על חולים עם כולסטרול גבוה שאינם סובלים מתפקוד לב ירוד. מתוך 7027 מטופלים שגויסו למחקר, 4444 התאימו (הסיבות העיקרית לאי התאמה למחקר – ירידת כולסטרול (או עליה חריגה) לאחר הדרכה לדיאטה - 1300 פציינטים; טריגליצרידים גבוהים – 864 פציינטים).רובם הגדול (81%) היו גברים.רובם היו לאחר אוטם שריר הלב (79%).רובם הגדול ללא סכרת (95%) וללא יתר-לחץ-דם (74%) וגילם הממוצע היה 58 שנים. אחרי חמש שנים, נמצאה הפחתה בתמותה (ביחס לקבוצת הביקורת) מ-12% ל-8% [ PMID 7968073]. בשנת 1995, הכניסו מכירות Zocor ו Mevacor מיליארד דולר לחברת מרק. לאקירה אנדו הוענק ב-2006 פרס יפן, וב-2008 פרס המחקר הרפואי על שם לסקר-דה-בייקי, על "מחקר חלוצי לסוג חדש של מולקולות להורדת הכולסטרול."תבנית:Fragment[5][6]
מחקר ופיתוח
גילוי ופיתוח של ברביטורטים
היסטוריה
גילוי תרופות הוא התהליך שבו תרופות פוטנציאליות מזוהות או מתוכננות. בעוד שבעבר, רוב התרופות התגלו על ידי בידוד המרכיב הפעיל שבתרופות מסורתיות או על ידי גילוי מקרי. הביוטכנולוגיה מודרנית מתמקדת לעתים קרובות בהבנת תהליכים מטבוליים הקשורים למצבי מחלה או לגורמי-מחלה, ובשינוי התהליכים שלהם על ידי שימוש בביולוגיה מולקולרית או בביוכימיה. חלק גדול מהשלבים המוקדמים של גילוי-תרופות בוצע על ידי אוניברסיטאות ומוסדות מחקר.
תלידומיד ותיקוני החוק של קיפאובר-האריס
פיתוח תרופות מתייחס לפעילויות שבוצעו לאחר שזוהה חומר עם פוטנציאל תרופתי, כדי לבסס את התאמתו כתרופה. מטרות פיתוח התרופות הן לקבוע פורמולציה ומינון, כמו גם כדי לבסס את הבטיחות. המחקר בתחומים אלה כולל בדרך כלל שילוב של מחקרי מבחנה, מחקרי in vivo וניסויים קליניים. העלות הגבוהה של שלבי הפיתוח המאוחרים, ממומנת בדרך כלל על ידי חברות התרופות הגדולות.[7]
עלות מחקר ופיתוח
גילוי ופיתוח תרופות הם יקרים מאד. מבין כל התרכובות הנחקרות לשימוש בבני אדם, יאושרו בסופו של דבר (על ידי המוסדות רפואיים או הועדות הממשלתיות ברוב מדינות) רק חלק קטן. בשנת 2010 אושרו 18 מולקולות חדשות (NMEs) ו-3 תרופות ביולוגיות על ידי ה-FDA, או 21 בסך הכל, ובשנים 2006 עד 2009 אושרו 22, 18, 24 ו-26, עם ממוצע שנתי של 22.9 לשנה מאז 2001, לפי המרכז להערכה וחקר תרופות.[8]החוקרים לייט ולקסצ'ין דיווחו ב-2012, כי שיעור האישור של תרופות חדשות היה יציב יחסית בשיעור ממוצע של 15 עד 25 במשך עשרות שנים.[75] אישורים אלו מגיעים רק לאחר השקעה כבדה בפיתוח טרום-קליני וקליני, כמו גם מחויבות מתמשכת לניטור בטיחות. בגילוי ובפיתוח תרופות אשר לא השלימו את התהליך הזה כרוכות עלויות גדולות לעיתים קרובות, ללא הכנסות בתמורה. כאשר נלקחה בחשבון עלות התרופות שנכשלו, עלות פיתוח מוצלח של התרופה החדשה (ישות כימית חדשה, NCE), הוערכה ב כ-1.3 מיליארד דולר[9](לא כולל הוצאות השיווק). <<< [10]
המלצות
אפינפרין, נוראדרנלין, אמפטמין
1970–1989
גלולות למניעת הריון
פיתוח ושיווק של תרופות נוגדות יתר לחץ דם
התקדמות נוספת בחקר האנטיביוטיקה
מחקר אנטיביוטי מוקדם: סאלברסאן, פרונטוסיל, פניצילין וחיסונים
בעוד עלות המחקר בארצות הברית היתה 34.2 מיליארד דולר בין 1995 ל-2010, ההכנסות עלו מהר אף יותר - ב-200.4 מיליארד דולר בתקופה זו. [75 >>>] הוצאות תעשיית התרופות הכוללות על מחקר ועל השקעות (כמו שיווק) הגיעו לשיא של $65.3 מיליארד דולר ב-2009.[11] <<<.
במחקר של חברת היעוץ ביין ושות' דווח כי עלויות הגילוי, הפיתוח והשיווק של תרופה חדשה (יחד עם התרופות שנכשלו בתהליך) טיפסו בתקופה של 5 שנים לקרוב ל-1.7 מיליארד ב-2003. [12] לפי פורבס, עלויות הפיתוח הכוללות ב-2010 נעו בין 4-11 מיליארד דולר לתרופה. לגבי משמעות חלקן של הוצאות השיווק בעליה זו, ראו דיון בהמשך.[13]
[14]X חלק מהתרופות המאושרות, כגון אלו המבוססות על פורמולציה מחדש של מרכיב פעיל קיים (ומכונות גם 'הארכות-קו') הן זולות בהרבה לפיתוח.
Controversies
קיימת נטיה מוכחת להימנע מפירסום תוצאות מחקרים שאינן רצויות על ידי חברות התרופות שמימנו את המחקרים.[15] הבנה זו הביאה להידוק הפיקוח בנושא על ידי קבוצות עצמאיות וממשלתיות כאחד. בעקבות מספר מקרים בהם לא פורסמו נתונים 'לא רצויים' ממחקרים שנתמכו על ידי חברות תרופות, פירסם גם איגוד הסחר של החוקרים ויצרני התרופות של אמריקה הנחיות חדשות המדרבנות את החברות לדווח על כל הממצאים ולהגביל את המעורבות הכספית של חברות התרופות עם החוקרים.[16] בקונגרס האמריקאי נחקק חוק הדורש רישום ניסויים קליניים (שלב II ושלב III) על-ידי היוזם באתר clinicaltrials.gov המנוהל על ידי המכון הלאומי האמריקאי לבריאות (NIH). חוק זה תקף מ-26 בדצמבר 2007 [1].
בישראל, חובת רישום מחקרים רפואיים באתר ה-NIH חלה משנת 2014, והחל מ-15.3.17 מותנה אישור לביצוע מחקר רפואי חדש ברישום שלו במאגר משרד הבריאות [2]. יחד עם זאת, חובת פרסום תוצאות המחקרים אינה נאכפת ביעילות.[17]
גם כאשר חוקרי התרופות אינם מועסקים ישירות על ידי חברות התרופות, רבים נעזרים בהן על ידי קבלת מענקים, וחברות מרבות להעזר בחוקרים כאלו כדי להציג את מוצריהן כעדיפים. חוקרים מתוגמלים בעקיפין על ידי חברות התרופות גם בתמיכה בעלויות כנסים וכדומה. תכני הרצאות וואפילו מאמרים שמוצגים על-ידי חוקרים אקדמיים עשוי למעשה להיכתב על ידי "סופרי רפאים" מטעם חברות התרופות.[18]
בתחקיר של פרופבליקה נמצאו לפחות 21 רופאים שקיבלו מיצרני תרופות יותר מ-500,000 דולר עבור הרצאות וייעוץ מאז 2009. מחצית בעלי השכר הגבוה היו פסיכיאטרים, וסך התשלומים לרופאים עבור שירותים כאלה היה כ-2 מיליארד דולר. החברות אסטרא-זנקה, ג'ונסון & ג'ונסון ו- איליי לילי שילמו מיליארדי דולרים בעסקות טיעון בעקבות האשמות על תשלום לרופאים לצורך קידום תרופות לשימושים לא מאושרים. במספר בתי ספר בולטים לרפואה התהדקו מאז הכללים לגבי קבלה של תשלומים מחברות התרופות על ידי סגל.[19]
לעומת תפיסה זו, מאמרים שהופיעו ב-New England Journal of Medicine ממאי 2015, כולל מאמר מערכת, הדגישו את חשיבות יחסי הגומלין של תעשיית התרופות והרופאים לפיתוח של טיפולים חדשים. במאמרים נטען כי הזעם המוצדק על פשעי התעשייה הוביל רבים להפריז בחשיבותם של ניגודי עניינים. המאמר ציין כי ארגוני בריאות גדולים כמו המרכז הארצי לקידום תרגום-מדע (ליישום) של המכון הלאומי לבריאות, מועצת יועצי הנשיא למדע והטכנולוגיה, הפורום הכלכלי העולמי, קרן גייטס, קרן ולקם ומינהל המזון והתרופות האמריקאי עודדו יחסי-גומלין בין הרופאים לבין התעשייה לטובת חולים.[20][21]
לאישור מוצר
בארצות הברית, ניו מוצרים פרמצבטיים צריכים להיות מאושרים על ידי מנהל מזון והתרופות (ה-FDA) כמו להיות בטוח וגם יעיל. תהליך זה בדרך כלל כרוך הגשת Investigational תרופה חדשה תיוק עם מספיק מראש נתונים קליניים כדי לתמוך שתמשיך עם ניסויים בבני אדם. בעקבות אישור IND, שלושה שלבים גדול יותר בהדרגה קליניים בבני אדם ניסויים יכולים להתבצע. שלב אני בדרך כלל מחקרים רעילות באמצעות מתנדבים בריאים. שלב II יכול לכלול פרמקוקינטיקה ואת מינון בחולים, השלב השלישי הוא גדול מאוד מחקר של יעילות המיועד האוכלוסייה המטופלת. בעקבות השלמה מוצלחת של שלב III בדיקה, תרופה חדשה היישום שהוגש ל-FDA. ה-FDA סקירה של נתונים, אם המוצר נתפס כבעל חיובי של תועלת-הערכת סיכונים, אישור לשווק את המוצר בארה " ב הוא מובן מאליו.[22]
הרביעי הוא שלב של פוסט-אישור מעקב הוא גם לעתים קרובות נדרש בשל העובדה כי אפילו הגדול ביותר, ניסויים קליניים לא יכול לחזות ביעילות את השכיחות של נדיר תופעות לוואי. Postmarketing מעקב מבטיח כי לאחר שיווק הבטיחות של התרופה פיקוח הדוק. במקרים מסוימים, זה סימן אולי צריכה להיות מוגבלת המטופל המסוים קבוצות, ואחרים החומר הוא נסוג מן השוק לחלוטין.
בבריטניה, תרופות, מוצרי בריאות תקינה הסוכנות מאשרת סמים לשימוש, למרות ההערכה נעשה על ידי סוכנות התרופות האירופית, סוכנות של האיחוד האירופי המבוסס בלונדון. בדרך כלל אישור בבריטניה ובמדינות נוספות באירופה מגיע מאוחר יותר מאשר בארה " ב. אז זה המכון הלאומי לבריאות וטיפוח מצוינות (נחמד), אנגליה, ויילס, אשר יחליט אם וכיצד את שירות הבריאות הלאומי (NHS) יאפשר (במובן של לשלם עבור) השימוש שלהם. את הבריטי הלאומי התרופות הליבה מדריך עבור רוקחים ומטפלים.
תרופות יתום
מכירות גלובלי
ב-2011, גלובלי ההוצאות על תרופות מרשם עקף $954 מיליארד דולר, גם הצמיחה הואט במקצת באירופה ובצפון אמריקה. ארה " ב מהווה יותר משליש הגלובלי של שוק התרופות, עם $340 מיליארד דולר מכירות שנתיות ואחריו האיחוד האירופי ויפן.[23] שווקים מתפתחים כגון סין, רוסיה, דרום קוריאה ומקסיקו עקף את השוק הזה, גדל ענקית 81%.[24][25]
עשרת הנמכרים ביותר סמים של 2013 הסתכם ב-75.6 מיליארד דולר במכירות, עם אנטי-דלקתיות סמים Humira להיות הטוב ביותר-מכירת סמים ברחבי העולם ב-10.7 מיליארד דולר במכירות. השני והשלישי הנמכר ביותר היו Enbrel ו-Remicade, בהתאמה.[26] שלוש הראשונות הנמכר ביותר של תרופות בארה " ב ב-2013 היו Abilify ($6.3 מיליארד,) Nexium (6 מיליארד דולר) Humira ($5.4 מיליארד דולר).[27] את הטוב ביותר-מכירת סמים, אי-פעם, ליפיטור, בממוצע 13 מיליארד דולרים מדי שנה, הרוויחה $141 מיליארד סה " כ במהלך תקופת חייו לפני פייזר הפטנט פג בחודש נובמבר 2011.
פטנטים התרופות הגנריות
בהתאם למספר שיקולים, חברה יכולה לבקש וגם לקבל פטנט על התרופה, או התהליך של ייצור הסם, הענקת זכויות בלעדיות בדרך כלל במשך כ-20 שנים.[28] עם זאת, רק לאחר מחקר קפדני ובדיקות, אשר לוקח בין 10 ל-15 שנים בממוצע, רשויות ממשלתיות להעניק הרשאה עבור החברה לשווק ולמכור את התרופה.[29] הגנת פטנט מאפשר הבעלים של פטנט כדי לשחזר את העלויות של מחקר ופיתוח באמצעות שולי הרווח גבוהה עבור ממותגים סמים. כאשר הגנת פטנט על התרופה יפוג, תרופה גנרית הוא בדרך כלל מפותח ונמכר על ידי חברה מתחרה. פיתוח ואישור של התרופות הגנריות הוא פחות יקר, ומאפשר להם להיות נמכר במחיר נמוך יותר. לעתים קרובות הבעלים של ממותגים התרופה תציג גרסה הגנרית לפני הפטנט יפוג כדי להתחיל את כללי השוק.[30] ארגון מחדש ועל כן הפך לשגרה, מונע על ידי פקיעת פטנטים של מוצרי פתחו במהלך של התעשייה "עידן הזהב" בשנת 1990 וחברות הכישלון לפתח מספיק שובר קופות החדש מוצרים להחליף אובדן הכנסות.[31]
מרשמים
בארה " ב, הערך של המרשמים גדל במשך התקופה 1995 ל-2005 על ידי 3.4 מיליארד דולר מדי שנה, ב-61%. המכירות הקמעונאיות של תרופות מרשם קפץ 250% מ - $72-מיליארד $250 מיליארד דולר, בעוד המחיר הממוצע של מרשמים יותר מאשר הוכפל בין $30 ל-68 דולר.[32]
שיווק
פרסום נפוץ בטיפול רפואי כתבי עת, כמו גם דרך יותר מיינסטרים מדיה מסלולים. במדינות מסוימות, בעיקר בארה " ב הם רשאים לפרסם ישירות לקהל הרחב. חברות התרופות, בדרך כלל, להעסיק אנשי מכירות (לעתים קרובות בשם "סמים נציגי' או מבוגר, המונח 'פרט גברים') לשווק באופן ישיר והן באופן אישי רופאים וספקי שירותי בריאות אחרים. במדינות מסוימות, בעיקר ארה " ב, חברות התרופות גם מעסיקים לוביסטים כדי להשפיע על פוליטיקאים. שיווק של תרופות מרשם בארה " ב מוסדר על ידי הפדרל תרופות מרשם שיווק מעשה 1987.
ישיר לצרכן פרסום
מאז 1980 שיטות חדשות של שיווק תרופות מרשם לצרכנים צריך להיות חשוב. ישיר לצרכן מדיה פרסום חוקיים ב הנחיות ה-FDA עבור התעשייה על הצרכן מכוון שידור פרסומות.
מחלוקת על סמים שיווק ושתדלנות
גוברת המחלוקת סביב שיווק תרופות והשפעה. היו האשמות ממצאים של השפעה על רופאים ואנשי מקצוע בריאות אחרים באמצעות סמים הרמות, כולל הוראה קבוע של שיווק מתנות ומוטה מידע מקצוע בריאות;[33] מאוד נפוץ פרסום בכתבי עת וכנסים; מימון עצמאי, ארגוני בריאות, בריאות קידום מסעות פרסום; שתדלנות רופאים ופוליטיקאים (יותר מאשר בכל תעשייה אחרת בארה"[34]); מימון של בתי ספר לרפואה או אחות הכשרה; מתן חסות של המשך חינוכי אירועים, עם השפעה על תכנית הלימודים;[35] וגיוס רופאים כמו תשלום יועצי רפואה לוחות מייעצת.
רגולציה
Ben Goldacre טען כי הרגולטורים – כגון תרופות, מוצרי בריאות תקינה סוכנות (MHRA) בבריטניה, או את מנהל המזון והתרופות (FDA) בארה " ב – לקדם את האינטרסים של חברות התרופות יותר מאשר את האינטרסים של הציבור בשל הדלת המסתובבת חילופי עובדים בין הרגולטור לבין חברות, ידידות לפתח בין הרגולטור לבין עובדי החברה.[36] הוא טוען כי הרגולטורים אינם דורשים תרופות חדשות להציע שיפור מה הוא כבר זמין, או אפילו כי הם להיות יעילים במיוחד.
אחרים טענו כי יתר ויסות מדכא חדשנות טיפולית, וכי העלות הנוכחית של הרגולטור-נדרשים ניסויים קליניים מונע את ניצול מלא של ניו גנטיים וביולוגיים הידע על הטיפול של מחלות אנושיות. 2012 דו " ח על-ידי מועצת יועצי המדע והטכנולוגיה, מספר המלצות מפתח כדי להפחית את נטל הרגולציה לניו פיתוח תרופות, כולל 1) הרחבת ה-FDA את השימוש של האצת תהליכי אישור, 2) יצירת מזורז לאישור נתיבי הסמים מיועד לשימוש מוגדר באופן צר אוכלוסיות, ו-3) התחייבות פרויקטי פיילוט שנועד להעריך את הכדאיות של חדש, הסתגלות סמים תהליך האישור.[37]
תרופות הונאה
תרופות הונאה כולל הטעיות אשר תביא לרווח כספי חברת תרופות. זה משפיע על יחידים ועל הציבור ואת פרטי הביטוח. ישנן מספר ערכות שונות[38] נהג להונות את מערכת הבריאות אשר מסוים על תעשיית התרופות. אלה כוללים: תרגול טוב ייצור (GMP) הפרות, את התווית שיווק, המחיר הטוב ביותר הונאה, CME הונאה, Medicaid מחיר דיווח, ומיוצר מתחם סמים.[39] מתוך סכום זה 2.5 מיליארד דולר נמצאה דרך תביעות כזב במקרים פ. י 2010. דוגמאות של מקרי הונאה כולל GlaxoSmithKline , 3 מיליארד דולר יישוב, פייזר 2.3 מיליארד דולר ההתנחלויות, Merck & Co. $650 מיליון התיישבות. נזקים של הונאה יכול להיות התאושש על ידי השימוש תביעות כזב, לרוב תחת טאם qui הוראות אשר מזכה את הפרט להיות "טרי", או relator (החוק).[40]
להלן רשימה של ארבע ההתנחלויות הגדולים הגיעו עם חברות תרופות מ-1991 עד 2012, דרגה הורה על ידי הגודל של סך כל הסדר. תביעות משפטיות נגד תעשיית התרופות יש מגוון נרחב במהלך שני העשורים האחרונים, כולל Medicare ו-Medicaid הונאה, בהתוויה קידום, לא מתאימות שיטות ייצור.[41][42]
[[קטגוריה:פרמקולוגיה]][[קטגוריה:מדעי הרוקחות]]