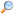Protosejt
A protosejt (más néven protobionta önszerveződő, endogén rendeződésű, gömbölyű lipidcsoport, mely feltehetően az élet eredetéhez vezető lépcső.[1][2] Az evolúció egyik fontos kérdése az egyszűerű protosejtek létrejötte és szaporodásuk különbségei, melyek lehetővé tették a biológiai evolúciót. Bár laboratóriumban még nem hoztak létre élő protosejtet, a folyamat megértése közel lehet.[3][4][5][6]
Áttekintés
Az elkülönülés fontos volt az élet eredetében.[7] A membránok zárt térrészeket alkotnak, melyek a külső környezettől függetlenek, a sejtnek speciális funkciójú vizes tereket adva. Mivel a membránok lipid kettős rétege a legtöbb hidrofil (vízoldékony) molekulának impermeábilis, a sejteknek membrántranszportrendszereik vannak, melyek a tápanyagokat be-, a felesleges anyagokat kiviszik.[8] Nagyon nehéz a protosejtek létrehozása molekulák összeillesztésével. Fontos lépés ebben a sejtfunkciókhoz fontos vezikulumok, például a membránforgalom és az önreprodukció elérése amfifil molekulákkal, melyek a sejtek felé vezető út első része lehettek.[9][10] A vezikulumtól a protosejtig vezető lépés maguktól szaporodó vezikulumokhoz vezethetett metabolikus rendszerekkel.[11]
A protosejtek másik megközelítése a „kemotonról” szól, mely Gánti Tibor elméleti biológus absztrakt modellje az élet alapegységére.[12] Ez a protosejt legrégebbi ismert modellje. Gánti az alapötletet 1952-ben fogalmazta meg, a koncepciót 1971-ben adta ki Az élet alapelveiben. A kemotont minden szervezet közös ősének mondta, vagyis az utolsó univerzális ősnek.[13]
A kemotonmodell alapfeltételezése, hogy az életnek három alaptulajdonság kell: a metabolizmus, az önreplikáció és a bilipid membrán.[14] A metabolikus és replikációs funkciók együtt az élet alapfunkcióihoz szükséges autokatalitikus alrendszert alkotnak, és a membrán választja el ezt az alrendszert a környezettől. Így bármely rendszer e tulajdonságokkal élőnek tekinthető, a természetes kiválasztódás hat rá, és önfenntartó sejtinformációt tartalmaz. Egyesek szerint ez a modell jelentős közreműködés az élet eredetében, ugyanis evolúciós egységek filozófiáját jelenti.[15] Lehet, hogy a lúgos hidrotermális kürtőkben vagy más környezetekben élt protosejteknek egyszerű Wood–Ljungdahl-útjuk volt. A vasmeteoritokról ismert, hogy tartalmazzák a Wood–Ljungdahl-út elemeit.[16]
Szelektivitás az elkülönülés felé

Az önszerveződő vezikulumok a primitív sejtek fontos részei.[1] A termodinamika második törvénye szerint az univerzumban az idő előrehaladtával a rendezetlenség (entrópia) növekszik, de az élet nagy fokon szerveződik. Ezért az életfolyamatok egy határral elkülönítendők az élettelen anyagtól.[17] Az összes földi élőlény összes sejtjében közös egyetlen szerkezet a sejtmembrán.[18]
A vizes környezetben, melyben minden ismert sejt működik, vízmentes határnak kell körülvennie és a környezetétől elválasztania a sejtet.[19] Hogy a környezetétől megkülönböztethető legyen, a szabad diffúziónak határ kell. Az alrendszer termodinamikai izolációja az élet alapfeltétele.[19] Ezt mintegy 10−8 méter vastag amfifil kettős rétegek érik el.
Egyes kutatók, többek közt Irene A. Chen és Jack W. Szostak bemutatták, hogy a protosejtek egyszerű fizikokémiai tulajdonságai a sejtek fontos viselkedéseinek, például a darwini versengés és az energiatárolás egyszerűbb változatait is lehetővé tehetik. Az ilyen interakciók a membrán és annak tartalma közt jelentősen egyszerűsítheti a másolódó molekulákból a valódi sejtekbe való átmenetet.[4] A membránmolekulákért való verseny stabil membránokat részesít előnyben, mely a keresztkötéses zsírsavaknak és a foszfolipideknek jelentett evolúciós előnyt.[4] Ez a mikrokapszuláció lehetővé tette a membránon belüli anyagcserét, a kis molekulák cseréjét és a nagyok áthaladásának akadályozását.[20] A kapszuláció előnyei többek közt az anyag nagyobb oldhatósága és az energia kémiai gradiensek formájában való létrehozatala. Az energiáról így gyakran mondják, hogy a sejtek szénhidrátok, lipidek és fehérjék formájában tárolják, melyekből energia szabadul fel, ha az oxigénnel reagálnak a sejtlégzéskor.[21][22]
Energiagradiens
A NASA Jet Propulsion Laboratory 2014. márciusi tanulmánya az élet eredetének új kutatási módját választotta: az üzemanyagcellákat.[23] Ezek hasonlítanak a biológiaiakra abban, hogy elektronok is átmennek molekulákra és molekulákról. Ez mindkét esetben energiát és elektromosságot termel. A tanulmány szerint fontos volt, hogy a tengerfenéken a Föld elektromos energiát terlme. „Ez az energia kezdhette el és tarthatta fenn az életet megjelenése után. Most módunk van különböző anyagok és környezetek tesztelésére, melyek segíthették az élet létrejöttét nemcsak a Földön, hanem talán a Marson, az Europán és a Naprendszer más helyein.”[23]
Vezikulumok, micellák és membrán nélküli cseppek
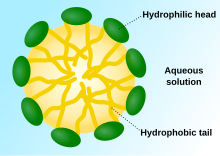
Ha foszfolipidek kerülnek vízbe, a molekulák úgy rendeződnek el, hogy „farkaik” a víztől elmutatnak, kettős rétegek, vezikulumok és micellák képződéséhez vezetve.[2] A modern sejtekben a vezikulumok az anyagcserében, a transzportban, a felhajtóerő-irányításban[24] és az enzimtárolásban vesznek részt. Ezenkívül természetes reakciókamraként is működhetnek. Egy tipikus vezikulum vagy micella vizes oldatban a hidrofil „fej” részekkel alkot aggregátumot a környező oldószer körül, a hidrofób farki részeket a központba helyezve. Ezt az egyfarkú lipidek viselkedése okozza. Bár a protocelluláris önszerveződés, mely spontán egyrétegű lipidvezikulumokat és micellákat hozott létre, hasonlít az evolúció kezdetén létezhetett primordiális vezikulumokra vagy protosejtekre, ezek nem olyan összetettek, mint a ma élő szervezetek kétrétegű membránjai.[25]
Szemben a foszfolipidekkel, a korai membránok egy- vagy kétrétegű zsírsavakból is képződhettek, melyek prebiotikus környezetben könnyebben létrejöhettek.[26] Számos prebiotikus körülmény közt szintetizáltak zsírsavakat, és megtalálták őket meteoritokon is, valószínűsítve a nem élet általi természetes szintézisüket.[4]
Az olajsav-vezikulumok az élet előtt létezhetett membránprotosejtek jó modelljei.[27]
Rövid, pozitív töltésű hidrofób, legfeljebb hét aminosavból álló peptidek által indukált elektrosztatikus kölcsönhatások kapcsolhatnak RNS-t az alapvető sejtmembránhoz, a vezikulummembránhoz.[28][29]
Megfelelő prebiotikus környezetek
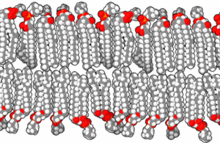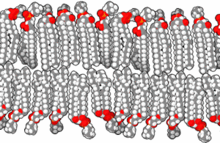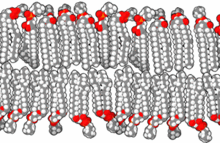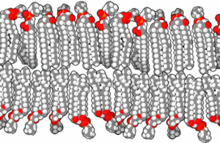
Korábbi feltételezések szerint az élet a mélytengeri hidrotermális kürtőkben kezdődött, de egy 2012-es tanulmány szerint a hévforrások körülményei felelnek ennek meg.[30] A következtetés főképp a modern sejtek kémiáján alapul, ahol a citoplazma káliumban, cinkben, mangánban és foszfátban gazdag, mely nem gyakori a tengerben. Az ilyen feltételek a kutatók szerint csak ott találhatók, ahol a forró hidrotermális folyadék az ionokat a felszínre hozza – például gejzírek, fumarolok, iszapos tócsák és más geotermikus források. E füstölgő, buborékos helyeken összegyűlhetett cink- és mangánionokban gazdag víz, mely lehűlt és sekély medencékben folyadékká vált.[30] Azonban a tengervíznél alacsonyabb nátriumtartalmú lúgos hidrotermális kürtők felfedezése alapján a tengerben is megtalálható magas káliumkoncentráció.[31]
Egy 1990-es évekbeli kutatás szerint a montmorillonitagyag segíthette akár egymáshoz spontán egy RNS-molekulaként csatlakozó RNS-láncok létrehozását.[5] Később, 2002-ben felfedezték, hogy zsírsavmicella-oldathoz montmorillonitot adva az agyag a vezikulumképződést 100-szorosára gyorsította.[5]
Egyes ásványok képesek a zsírsavak szénhidrogénrészei előállításának katalizálására hidrogénből és szén-monoxidból, melyek a hidrotermális kürtőkből és a gejzírekből szabadulhattak fel. A különböző hosszúságú zsírsavak végül a környező vízbe kerültek,[26] de a vezikulumképződés magasabb zsírsav-koncentrációt igényel, így a protosejtképződés édesvízi környezetben történt, ahol a víz párolgása az oldott anyag koncentrációját növeli.[5][32][33]
2019-ben Nick Lane és társai kimutatták, hogy sós vízben 6,5-12 közti pH, illetve 70 °C körüli hőmérsékleten vezikulumok képződnek. Ez megfelel a lúgos hidrotermális kürtők körülményeinek felel meg, ahol lipidkeverékek is voltak,[34] azonban a keverékek prebiotikus forrása tisztázatlan. Az egyszerű amfifil vegyületek a tengervízben nem állnak össze vezikulumokká az ionvegyületek nagy koncentrációja miatt. A hévforrások körülményei közt, ahol kisebb ezek koncentrációja, a vezikulumok összeállnak.[35] A kutatók ezenkívül a lúgos hidrotermális kürtők körülményei közt RNS-oligomerizációt is sikeresen végeztek. Bár 4 egység hosszúnak becsülték, ez azt jelenti, hogy ilyen körülmények közt jöhettek létre az első RNS-polimerek.[36] A hévforrásoknál végzett kísérletek a laboratóriumiaknál magasabb arányban adtak RNS-szerű polimereket. A polimerek rehidratációkor zsírsavvezikulumokba záródtak, tovább támogatva az abiogenezis hévforrás-elméletét.[37] Az UV-kitettségről is kimutatták, hogy a stabil biomolekulák, például nukleotidok képződését segíti.[38][39] Kutatások szerint továbbá a vezikulumokhoz kötnek és azokat stabilizálják a prebiotikus aminosavak sók és magnéziumion jelenlétében, ami a szárítás–rehidratáció ciklusok számának növekedésével tovább erősödik.[40]
Ha a korai sejtek a lúgos hidrotermális kürtőkből származnak, a protongradienseket a fehér füstölők lúgos vize és a savas óceán megtarthatja, miközben a sziklaüregben szervetlen membránszerkezet van.[41][42] Ha a korai sejtek szárazföldi vizekben, például hévforrásokban éltek, a meteoritokban, például a Murchison-meteoritban lévő kinonok a protongradiensek létrejöttét támogatta kapcsolt redoxireakciókkal, ha az elektronakceptor vas(III)-cianid a vezikulumban volt, és az elektrondonor, például egy kénvegyület a lipidmembránon kívül volt.[35][43] A „vízprobléma” miatt egy egyszerű ATP-szintáz és más biomolekulák hidrolizálnának, mivel a hidrotermális kürtőkben nem lennének szárítás–nedvesítés ciklusok, szemben a szárazföldi vizekkel.[35] Más kutatók szerint szervetlen gélekben lévő hidrotermális pórusrendszerek lehettek a membránszerkezetek alternatívája, segítve a biopolimerek biokémiai reakcióit és megoldva a „vízproblémát”.[44][41] David Deamer és Bruce Damer szerint a biomolekulák e pórusrendszerekben csapdázódtak volna polimerizációkor, és nem történt volna kombinatorikus szelekció.[35] A katalitikus FeS és NiS falak a lúgos hidrotermális kürtőkben szintén a polimerizációt segíthették.[45] Más kutatók szerint a hidrotermális vulkanikus tavakban kezdődő, UV-sugárzásnak, cink-szulfid-fotokatalízisnek kitett élet és a folyamatos szárítás–nedvesítés ciklusok nem hasonlítanának a biokémiára.[46][47][48] Kimutatták, hogy a maximális ATP-szintézis magas vízaktivitásnál és alacsony ionkoncentrációnál történik. Ennek ellenére a hidrotermális kürtőket továbbra is lehetséges környezetnek tekintik, mivel egyes sekély hidrotermális kürtők édesvizet bocsátanak ki, így a hadaikumi óceánokban a kétértékű kationok koncentrációja valószínűleg a mainál alacsonyabb volt. Nick Lane és társai szerint „a lúgos hidrotermális környezetekben a Ca2+ és Mg2+ ionokat aragonitként és brucitként csapódtak le, így koncentrációik általában sokkal kisebbek az átlagos óceáni értékeknél. A hadaikumi rendszerekkel kapcsolatos modellek szerint a Ca2+ és Mg2+ hidrotermális koncentrációja valószínűleg kisebb volt 1 mM-nál, mely itt a foszforilációt segítő tartományban volt. A további körülmények, például a sótartalom és a magas nyomás csak korlátozottan hatottak az ATP-szintézisre a tenger alatti hidrotermális rendszerekben (ahol a jellemző nyomás 100-300 bar). A lúgos hidrotermális rendszerek ezenkívül Fe3+-t is előállíthattak in situ az ADP-foszforilációhoz. A termodinamikai modellek szerint a lúgos hidrotermális folyadékok tengervízzel való keveredése tenger alatti rendszerekben folyamatos ciklust hozhattak létre a Fe2+ és a Fe3+ közt, mely oldékony hidratált vas(III)-kloridokat hozhatott létre, mely a kísérletek szerint a vas(III)-szulfáttal azonos hatást váltott ki”.[49]
Montmorillonitbuborékok
Egy másik csoport szerint az egyszerű sejtek szervetlen agyagból lévő mikrorészecskékben jöttek létre, melyek az összetett szerves vegyületek szintézisének és elkülönítésének ideális helyek lehettek.[50] Agyaggal körbevett buborékok jönnek létre, ha montmorillonitrészecskék gyűlnek össze a víz alatt a levegőbuborékok külső felszínén. Ez szemipermeábilis vezikulumot hoz létre a környezetben könnyen elérhető anyagokból. A szerzők megemlítik, hogy a montmorillonitról ismert, hogy kémiai katalizátorként működik, segítve a lipidek membránképzését és a nukleotidok RNS-sé való összeállását. A korai szaporodás az agyagbuborékok robbanásakor történhetett, amikor a lipidmembránkötött termék a környező közegbe került.[50]
Membrán nélküli cseppek
Az egyszerű elkülönült részek további módja, mely szintén protosejt képződéséhez vezethetett, a membrán nélküli poliészter szerkezetek, melyek képesek biológiai vegyületeket (fehérjéket, RNS-t) tárolni és a lipidszerkezeteket alátámasztani.[51][52] Bár e cseppekből el tud szivárogni örökítőanyag, ez egyszerűsíthette a progenótahipotézist.[53]
Membrántranszport

A sejtes élőlényekben az egyes molekulák membránhatárok közti transzportja fontos a környezettel és más élőlényekkel való anyagcseréhez. Például a más élőlényekkel való anyagcsere lehetővé teszi a horizontális géntranszfert, ami a sejtes élet fejlődésében fontos.[54] Míg a mai sejtek összetett fehérjéket használnak e fontos folyamatok katalízisére, a protosejteknek egyszerűbben kellett ezt elérni.
A zsírsavakból álló protosejtek[55] környezetükkel könnyen tudtak cserélni kis molekulákat és ionokat.[1] A zsírsav membránok permeabilitása viszonylag nagy a nukleozid-mono- (NMP), -di- (NDP) és -trifoszfátok (NTP) felé, és millimol nagyságrendű Mg2+ koncentráció mellett is működhetnek.[56] Az ozmózisnyomás is jelentős szerepet játszhat a passzív transzportban.[1]
A környezeti hatások feltehetően a DNS-hez és RNS-hez hasonló nagyobb molekulák protosejtek membránjai közti transzportját lehetővé tették. Például a villámlás okozta elektroporáció lehetővé tett ilyen transzportot.[57] Az elektroporáció a kettős réteg permeabilitásának a membrán körüli elektromos mező miatti növekedése. Ekkor a lipidek a membránban elmozdulnak, pórust nyitva, ahol a hidrofób anyagok, például nukleinsavak áthaladhatnak a membránon.[58] Egy hasonló protosejtek közti és a környezetbe történő anyagtranszfert okozhatott fagyás és ezt gyorsan követő olvadás. Ez például olyan környezetben történhetett meg, ahol a nappal és az éjszaka ciklusa ismétlődő fagyást okozott. Laboratóriumi kísérletek szerint e feltételek lehetővé tették protosejt-populációk közti genetikaiinformáció-cserét.[59] Ezt megmagyarázhatja a membránok magas permeabilitása kevéssel a fázisváltási hőmérséklet alatt. Ha a fagyás–olvadás ciklus során eléri e pontot a membrán, még nagy és többszörösen töltött molekulák is áthaladhatnak a protosejt membránján.
Egyes részecskék túl nagyok vagy túl hidrofilek a kettős rétegen való áthaladáson ekkor is, de áthatolhatnak fúzióval vagy a vezikulumból való kiemelkedéssel.[60] events which have also been observed for freeze-thaw cycles.[61] This may eventually have led to mechanisms that facilitate movement of molecules to the inside of the protocell (endocytosis) or to release its contents into the extracellular space (exocytosis).[60]
A kemiozmózis az élet eredete szempontjából fontos volt. A protosejtek protongradienseit feltehetően a savas óceán és a fehér füstölőknél a porózus rendszerekben lévő lúgos hidrotermális tengervíz biztosította. Ha nem mélytengeri eredetű, a meteorokból származó kinonokhoz kapcsolt redoxireakciók okozhatták ezt, melyet impermeábilis foszfolipid membrán tartott fenn a szárazföldi vizekben.[42][35]
Ivaros szaporodás
Eigen és társai[62], valamint Woese[63] feltételezték, hogy a korai protosejtek genomjai egyszálú RNS-ből alakultak ki, és az egyes gének eltérő RNS-szakaszoknak feleltek meg, nem pedig végponttól végpontig csatlakoztak, mint a mai DNS-genomok. Egy haploid (egy génmásolat) protosejt sérülékeny volt, hiszen bármely RNS-szakasz sérülése halálos lehetett (például replikáció akadályozásával vagy egy létfontosságú gén gátlásával).
A protosejtek sérülékenységét csökkenti, ha minden RNS-szakaszból egynél több van bennük (di- vagy poliploiditás). A genomredundancia lehetővé teszi a sérült RNS-szakasz cseréjét homológja újabb replikációjával. Egy ilyen egyszerű élőlényben az örökítőanyag alkotja az összes erőforrás nagy részét. Korlátozott erőforrások esetén a protosejt szaporodási képessége a ploiditással fordítottan arányos, és a redundancia csökkenti a protosejt rátermettségét. Így a sérült gének javítása a redundancia költségeinek minimalizációja mellett a korai protosejtek fontos problémája lehetett.
Egy költség–haszon elemzés a redundancia költségeit hasonlította össze a genomsérüléséivel.[64] Ez ama következtetéshez vezetett, hogy számos körülmény közt a protosejtek választott stratégiája, hogy haploidak legyenek, de egy másik haploid protosejttel egyesülve átmeneti diploid sejtet alkossanak. A haploid állapot megtartása maximálja a növekedési arányt. Az időszakos egyesülések lehetővé teszik az ellenkező esetben halálosan károsodott protosejtek reaktivációját. Ha minden génből legalább egy sértetlen példány megvan az átmeneti diploidban, életképes utód képződhet. Hogy két életképes utódsejt legyen, egy tetszőleges, az egyesült protosejt osztódása előtt sérült génhez homológ sértetlen gén további replikációja kell. A haploid reprodukció, a diploid állapotba való egyesülés és a haploid állapotba való osztódás tekinthető az ivari ciklus legegyszerűbb változatának.[64][65] E ciklus nélkül egy fontos génben levő sérüléssel rendelkező protosejtek egyszerűen elhalnának.
E korai ivaros szaporodásról szóló modell hipotézis, de hasonlít a szegmentált RNS-vírusok ismert ivaros viselkedésére, melyek a legegyszerűbb szervezetek egyike. Az influenzavírus, melynek genomja 8 egymástól fizikailag elkülönülő egyszálú RNS-szakaszból áll,[66] is például ilyen vírus. A szegmentált RNS-vírusokban a „párzás” akkor történhet meg, ha a gazdasejtet legalább két vírus fertőzi meg. Ha ezek halálos károsodással rendelkező RNS-szakaszt tartalmaznak, a többszörös fertőzés reaktivációhoz vezethet, amennyiben minden vírusgénnek megtalálható legalább egy sértetlen változata a sejtben. Ez a „multiplicitásreaktiváció”. Ez influenzavírus-fertőzéskor is jelen van UV-[67] és ionizáló sugárzás okozta RNS-károsodás esetén is.[68]
Mesterséges modellek
Langmuir–Blodgett-depozíció
Egy molekulák szilárd felszínre való leadásához gyakran használt módszer, a Langmuir–Blodgett-depozíció használatával tetszőlegesen komplex foszfolipidmembránok helyezhetők el rétegenként.[69][70] E mesterséges membránok tisztított és in situ expresszált membránfehérjék funkcionális beillesztését is segítik.[70] Ez segíthet az első élő sejtek eredetének megértésében.[69]
Dzsivanu-protosejtek

A dzsivanu-protosejtek szintetikus anyagrészecskék sejtszerű szerkezettel és látszatra néhány funkcionális élő tulajdonsággal.[71] Először 1963-ban állították elő napfénynek kitett ásványokból és egyszerű szerves vegyületekből, és később is metabolikus képességeiről, szemipermeábilis membránjáról, aminosavjairól, foszfolipidjeiről, szénhidrátjairól és RNS-szerű molekuláiról számoltak be.[71][72] A dzsivanuk természete és tulajdonságai még nem ismertek.[71][72][73]
Egy hasonló szintézisben víz, metanol, ammónia és szén-monoxid szilárd keverékét tették ki ultraibolya sugárzásnak. E keverék sok, a vízben globulákat vagy vezikulumokat alkotó szerves anyagot eredményezett.[74] A kutató ezeket az élet kémiáját elzáró és összpontosító sejtmembránokhoz hasonlította, melyek a belső és külső világukat elválasztja. A globulák 10-40 µm-esek voltak, vagyis egy vörösvérsejthez hasonló méretűek. A globulák UV-fénynek kitéve fluoreszkáltak. Az UV-fény ilyen nemű láthatóvá alakítását egy egyszerű sejt energiatermelésének lehetséges módjának tekintették. Ha e globulák az élet eredetében játszottak szerepet, a fluoreszcencia az egyszerű fotoszintézis elődje lehetett. Ezenkívül e fluoreszcencia a napfénnyel szemben is védhetett, lehetővé téve az UV-sugárzás okozta károsodás csökkentését. E védő funkció a korai Földön létfontosságú lehetett, amíg az ózonréteg, mely a Nap által kibocsátott káros UV-sugarak egy részét el nem nyelte, ki nem alakult, míg a fotoszintézis oxigént nem termelt.[75]
Életszerű szerkezetek
Három fajta „dzsivanu” szintéziséről számoltak be, ebből kettő szerves, egy szervetlen volt. Más hasonló szervetlen szerkezeteket is előállítottak. A vizsgáló kutató, V. O. Kalinenko „életszerű szerkezeteknek” és „mesterséges sejteknek” nevezte őket. Desztillált vízben és agar-agar gélben elektromos mező hatására jönnek létre, azonban nincsenek bennük aminosavak, fehérjék, purin- vagy pirimidinbázisok, és bizonyos enzimaktivitások. A NASA kutatói szerint „a biológia és biokémia jelenleg ismert tudományos elvei nem tudnak élő szervetlen egységeket megmagyarázni”, és „ezen élő egységek feltételezett léte nem bizonyított”.[73]
Etika és viták
A protosejtkutatás vitákat és ellentétes véleményeket keltett, például a „mesterséges élet” pontatlan definícióinak kritikáit.[76] Az élet alapegységének létrehozása a legfontosabb etikai kérdés, azonban a protosejtekről szóló legelterjedtebb aggodalom az egészségre és környezetre jelentett feltételezett veszély irányítatlan replikációjuk által.[77]
Jegyzetek
Fordítás
Ez a szócikk részben vagy egészben a Protocell című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.