Z-DNS
A Z-DNS a DNS egyik kettőshélix-szerkezete. E szerkezet balos, vagyis a hélix balra fordul cikcakkos mintában, nem jobbra, mint a gyakoribb B-DNS és az A-DNS. A Z-DNS feltehetően az A- és B-DNS-hez hasonlóan biológiailag aktív.

Története
A balra forgató DNS-t először Robert Wells és társai javasolták az inozin–citozin polimer szerkezetére.[1] „Fordított” körkörös dikroizmust észleltek e DNS-ekre, és ezt – helytelenül – a szálak balos egymásra fordulásának tekinteték. A Z- és a gyakoribb B-DNS kapcsolatát Pohl és Jovin mutatták ki,[2] akik kimutatták, hogy a poli(dG–dC) ultraibolya körkörös dikroizmusa 4 M-os NaCl-oldatban megfordult, és hogy a poli-d(I–C)·poli-d(I–C) szerkezete jobbra forgató D-DNS volt. Azt a feltételezést, hogy ez B-DNS-ről Z-DNS-re való átalakulás eredménye volt, az oldatok és a Z-DNS-kristályok Raman-spektrumának vizsgálata igazolta.[3] Ezután a „Z-DNS” kristályszerkezetét is közölték, mely az első egykristály-röntgenszerkezet volt DNS-részletről (a d(CG)3 önkomplementer DNS-hexameré). Erről kiderült, hogy ez balra forgató kettős hélix két antipárhuzamos lánccal, melyeket Watson–Crick-bázispárok tartottak össze. Ezt Andrew H. J. Wang, Alexander Rich és társai mutatták ki 1979-ben a MIT-nél.[4] A B–Z-DNS kapcsolat 2005-ös kristályosítása[5] lehetővé tette a Z-DNS sejtekben játszott szerepének jobb megismerését. Z-DNS-szakasz keletkezésekor B–Z kapcsolatoknak kell lenni a két végén, a genom többi részén lévő B-DNS-hez kapcsolva azt.
2007-ben a Z-DNS RNS-változatát, a Z-RNS-t is előállították, melyet az A-RNS balra forgatóvá alakított változataként írtak le.[6] Az A-ból Z-RNS-be való átmenetet azonban már 1984-ben leírták.[7]
Szerkezet
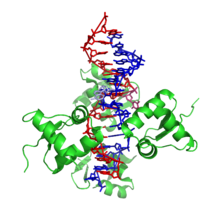
A Z-DNS jelentősen eltér a jobbra forgató változatoktól. Gyakran a Z-DNS-t a B-DNS-sel hasonlítják össze a főbb különbségek illusztrálásához. A Z-DNS-hélix balra forgat, szerkezete két bázispáronként ismétlődik. A nagy és kis bemélyedések szélessége az A- és B-DNS-től eltérően kevéssé tér el. E szerkezet keletkezése általában kedvezőtlen, de bizonyos helyzetek elősegíthetik, például váltakozó purin-pirimidin sorozatok (különösen a poli(dGC)2), a negatív DNS-szupertekeredés, a magas sótartalom és bizonyos kationok (fiziológiás hőmérsékleten (37 °C) és 7,3–7,4-es pH-n). A Z-DNS B-DNS-hez kapcsolódhat egy bázispár kiemelésével.[8] A Z-DNS-konformáció tanulmányozása nehéz, mivel a kettős hélixben nem stabil. Ehelyett ez átmeneti szerkezet, melyet néha a biológiai aktivitás indukál, majd gyorsan eltűnik.[9]
Z-DNS-szerkezet előrejelzése
Egy DNS-szekvencia Z-DNS-szerkezet-alkotásának valószínűsége előrejelezhető. A DNS B-ből Z-formába alakulásának valószínűségét jósló algoritmust, a ZHuntot P. Sing Ho írta 1984-ben a MIT-nél.[10] Később ezt Tracy Camp, P. Christoph Champ, Sandor Maurice és Jeffrey M. Vargason továbbfejlesztették genomszintű elemzésre (Ho a vezető vizsgáló).[11]
Z-DNS keletkezése B-DNS-ből
A Z-DNS 1979-es felfedezése és kristályosítása óta nem ismert a B-DNS Z-DNS-sé alakulásának módja.[12] A B-DNS Z-DNS-sé alakulásának módja atomi szinten nem volt ismert, de 2010-ben számítógépes szimulációval igazolták a B→Z átalakulás korábban feltételezett összehangolt mechanizmusnál alacsonyabb aktivációs energiáját.[13] Ennek számítási bizonyítása után ez még kísérletileg is bizonyítandó a további igazoláshoz, Lee és társai cikkükben ezt írják: „A jelenlegi [számított] eredmény egymolekulás FRET (smFRET) kísérletekkel ellenőrizhető később”.[13] 2018-ban a B-DNS Z-DNS-sé való átalakulását smFRET-assay-kkel igazolták.[14] Ezt DNS-hez kötött donor és akceptor fluoreszcens festékek (fluoroforok) közti egymáshoz viszonyított intenzitás mérésével igazolták elektronátvitel közben.[15][16] A fluoroforok távolsága felhasználható a festékek helyzetének és a DNS változásainak mennyiségi elemzéséhez. Egy nagy affinitású Z-DNS-kötő fehérjét, a hZαADAR1-et[17] használtak különböző koncentrációban a B-DNS Z-DNS-sé alakulását.[14] Az smFRET-assay-k B* köztes állapotot mutattak, melyek a B-DNS-hez kötött hZαADAR1 növekedésekor stabilizálták azt.[14] Ez a nagy kapcsolati energia elkerülésére történik, így a B-DNS Z-DNS-sé tud alakulni nagy, zavaró energiaváltozás nélkül. Ez egybeesik Lee és társai munkájával, mely alapján a mechanizmus lépésenként történik, és célja a B-DNS Z-DNS-sé alakulásának aktivációs energiájának csökkentése.[13] A kötőfehérjék nem stabilizálják a Z-DNS-t keletkezése után, hanem csak a Z-DNS B* állapotból való kialakulását segítik, amelyet a nagy affinitású fehérjék B-DNS-hez kötődése alakít ki.[14]
Biológiai jelentősége
A Z-DNS az I-es típusú interferonválaszokat szabályozza, ezt 3 ismert ritka örökletes betegség tanulmányaiban (dyschromatosis symmetrica hereditaria (OMIM 127400)), Aicardi–Goutières-szindróma (OMIM 615010) és kétoldali striatalis nekrózis/disztónia) erősítették meg. A haploid ADAR-transzkriptom lehetővé teszi a Zα-változatok betegséghez kapcsolását, ez alapján a genetikai információt a DNS-ben a szekvencia és az alak is kódolja.[18] Az I. típusú interferonválaszok rákban való szabályzását az is megalapozza, hogy egy tumortípus 40%-a az ADAR enzimtől függött.[19]
Korábbi tanulmányok a Z-DNS-t összekapcsolták az Alzheimer-kórral és a szisztémás lupus erythematosusszal. Ennek illusztrálására a hippocampusban lévő normál, közepesen és erősen érintett DNS-t vizsgáltak. Körkörös dikroizmussal kimutatták a Z-DNS jelenlétét az erősen érintett DNS-ben.[20] A tanulmány szerint a közepesen érintett DNS-ben voltak nagyobb B–Z köztes konformációjú DNS-részek. Ez azért fontos, mert ebből kiderült, hogy a B→Z-DNS átmenet függ az Alzheimer-kór állapotával.[20] Ezenkívül a Z-DNS összefügg a szisztémás lupus erythematosusszal (SLE) a természetes antitestek révén. Jelentős mennyiségű anti-Z-DNS antitest található SLE-s betegekben, más reumatoid betegségekben ezek nem voltak jelen.[21] Ezen antitestek két típusban fordulnak elő. Radioimmunassay-ben kimutatták, hogy egyikük a Z- és a denaturált DNS felszínén lévő bázisokkal, a másik csak a cikcakkos Z-DNS-vázzal reagál. Az Alzheimer-kórhoz hasonlóan a betegség állapotától függnek az antitestek, a legaktívabb SLE-szakaszokban van a legtöbb ilyen antitest.
Z-DNS a transzkripcióban
A Z-DNS torziós feszültsége feltehetően csökken transzkripció során, és a negatív szupertekeredéssel függ össze.[5][22] Azonban míg a szupertekeredés a transzkripcióval és a replikációval is összefügg, a Z-DNS-keletkezés a transzkripció sebességével függ össze.[23]
A humán 22. kromoszóma tanulmányozása korrelációt mutatott a Z-DNS-képző részek és az I. magi faktor promoterei közt. Így egyes humán gének transzkripcióját a Z-DNS-képzés és az I. magi faktor aktivációja szabályozhatja.[11]
A promoterek előtti Z-DNS stimulálja a transzkripciót. A legnagyobb aktivitásnövekedés a promoterszekvencia után 3 fordulattal lévő Z-DNS esetén van jelen. Továbbá micrococcalis nukleáz-keresztkötéssel[24] a Z-DNS valószínűleg nem hoz létre nukleoszómát, mely gyakran a Z-DNS-szakasz előtt vagy után van. Ezért a Z-DNS feltehetően a nukleoszóma-elhelyezés határát kódolja. Mivel a nukleoszómák helye befolyásolja a transzkripciós faktorok kötését, a Z-DNS fetehetően a transzkripció sebességét szabályozza.[24]
Az RNS-polimerázhoz hasonlóan negatív szupertekeredéssel és aktív transzkripcióval létrehozott Z-DNS növeli a genetikai instabilitást, a promoterekhez közeli mutagenezis valószínűségét növelve.[25] Egy Escherichia colin végzett tanulmány szerint a deléciók spontán történnek a Z-DNS-alkotó szekvenciát tartalmazó plazmidrészeken.[26] Az emlőssejtekben az ilyen szekvenciák jelenléte nagy deléciókat okoz a kromoszomális kettősszál-törések miatt. Mindkét genetikai módosulás géntranszlokációkkal hozható összefüggésbe, melyek a rákok, például a leukémia és a limfóma esetén jellemzők, mivel a tumorsejtek törési helyei Z-DNS-alkotó szekvenciák körül vannak.[25] A baktériumplazmidok kisebb deléciói replikációs csúszást okoznak, míg az emlőssejtek nagyobb delécióit a nem homológ végösszeillesztés okozza, mely hibákra hajlamos.[25][26]
Az etídium-bromid Trypanosoma-fajokra gyakorolt mérgező hatását a kinetoplasztisz-DNS Z-formává alakítása okozza. Ezt az interkalációja okozza, melyet a DNS-szerkezet lazulása követ, mely a DNS szétválását, Z-formává alakulását és a replikáció gátlását okozza.[27]
A Zα domén felfedezése
Az első nagy affinitással Z-DNS-hez kapcsolódó domént az ADAR1-ben fedezték fel Alan Herbert módszerével.[28][29] Krisztallográfiai és NMR-tanulmányok megerősítették a biokémiai eredményeket, melyek szerint a domén nem szekvenciaspecifikusan kötődik Z-DNS-hez.[30][31][32] Hasonló doméneket fedeztek fel számos más fehérjében szekvenciahomológia révén.[29] A Zα domén azonosítása lehetővé tett más krisztallográfiai eredményeket, melyek a Z-RNS és a B–Z kapcsolat felismerését tették lehetővé. Feltehetően az ADAR1 Z-DNS-kötő doménje az új RNS szekvenciáját módosító enzimet aktív transzkripciós helyekre teheti.[33][34] A Zα, a Z-DNS és a Z-RNS genomvédelmi szerepe az Alu retroelemekkel szemben a dsRNS-sel szembeni nem specifikus immunválaszok szabályzásává fejlődött. A Zα-mutációk humán interferonopátiákatt, például Aicardi–Goutières-szindrómát okozhatnak.[35][18]Továbbá a Zα domének a stresszgranulákban is jelen lehetnek nem specifikus nukleinsavkötő képességük révén, és a különböző Zα domének eltérően kötődnek a Z-nukleinsavhoz, fontos lehetőségeket biztosítva a gyógyszerfejlesztésben.
A Z-DNS Vaccinia-E3L-hez kapcsolódásának következményei
A Z-DNS intenzívebb kutatása során kiderült, hogy a Z-DNS Z-DNS-kötő fehérjékhez kapcsolódhat London-diszperziós erőkkel és hidrogénkötésekkel.[36] Az E3L gén terméke, az Vaccinia-E3L fehérje például Z-DNS-kötő, működése egy Z-DNS-kötő emlősfehérjéhez hasonló.[37][38] Az E3L nemcsak köt a Z-DNS-hez, hanem felhasználható a Vaccinia himlővírus virulenciájának méréséhez egerekben. A virulenciát meghatározó két fontos része az N- és a C-terminus. Az N-terminális szekvencia a Zα, más néven adenozin-deamináz z-α fehérjéhez hasonlít, míg a C-terminális kétszálú RNS-kötő részből áll.[37] Kim, Y. és társai által a Massachusettsi Műegyetemen végzett kutatások alapján az E3L fehérje N-terminusának Zα-ra való cseréje a vírus patogenitását kevéssé befolyásolta.[37] Ezzel szemben az összes Z-DNS-kötő aminosav eltávolítása a virulenciát csökkentette.[37] Ezek alapján a hasonló Z-DNS-kötő aminosavak a virulenciát meghatározó legfontosabb tényezők, a Z-DNS-kötésben részt nem vevő aminosavak kevéssé befolyásolják azt. Továbbá az E3L Vaccinia-vírust tartalmazó vakcinák általi Z-DNS-affinitás-csökkentése csökkenti a humán negatív reakciókat is a vírusra.[37]
Ezenkívül Alexander Rich és Jin-Ah Kwon kimutatták, hogy az E3L a humán IL-6, NF-AT és p53 transzaktivátora. Eredményeik alapján az E3L-tartalmú HeLa sejtekben a humán IL-6, NF-AT és p53 gének jobban kifejeződnek, és egyes Z-DNS-kötő aminosavak mutációi vagy deléciói ezt csökkentik.[36] A Tyr 48 és a Pro 63 mutációi e gének transzaktivációját csökkentik a hidrogénkötés eltűnése és az E3L és a Z-DNS közti London-diszperziós erők miatt.[36] Így ezen eredmények alapján a Z-DNS és a Z-DNS-kötő fehérjék kölcsönhatásának csökkenése csökkenti a virulenciát és a génexpressziót, megmutatva a Z-DNS és az E3L-kötő fehérje közti kötések szükségességét.
A leggyakoribb DNS-ek összehasonlítása


| Geometria | A-DNS | B-DNS | Z-DNS |
|---|---|---|---|
| Hélixállás | jobbra forgat | jobbra forgat | balra forgat |
| Ismétlődő egység | 1 bázispár | 1 bázispár | 2 bázispár |
| Forgás/bázispár | 32,7° | 34,3° | 60°/2 |
| Átlagos bp/fordulat | 11 | 10 | 12 |
| Bázispár-inklináció | +19° | −1,2° | −9° |
| Tengelymenti emelkedés/bp | 2,6 Å (0,26 nm) | 3,4 Å (0,34 nm) | 3,7 Å (0,37 nm) |
| Fordulatonkénti emelkedés | 28,6 Å (2,86 nm) | 35,7 Å (3,57 nm) | 45,6 Å (4,56 nm) |
| Átlagos csavarodás | +18° | +16° | 0° |
| Glikozilszög | anti | anti | pirimidin: anti, purin: szin |
| Nukleotidok foszfát-foszfát távolsága | 5,9 Å | 7,0 Å | C: 5,7 Å, G: 6,1 Å |
| Cukorbemélyedés | C3'-endo | C2'-endo | C: C2'-endo, G: C3'-endo |
| Átmérő | 23 Å (2,3 nm) | 20 Å (2,0 nm) | 18 Å (1,8 nm) |
Jegyzetek
Fordítás
Ez a szócikk részben vagy egészben a Z-DNA című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.