Reakcja Baylisa-Hillmana
Reakcja Baylisa-Hillmana (znana też jako reakcja Morita–Baylisa–Hillmana lub reakcja MBH[1]) – reakcja chemiczna aldehydu i α,β-nienasyconej grupy elektronoakceptorowej katalizowana za pomocą DABCO (1,4-diazabicyklo[2.2.2]oktanu), w wyniku której otrzymuje się alkohol allilowy[2]. Nazwę swą zawdzięcza chemikom: Ken’ichi Moricie japońskiego pochodzenia, Anthony B. Baylisowi brytyjskiego pochodzenia oraz Melville E. D. Hillmanowi pochodzenia niemieckiego.

Reakcja ta może być także katalizowana za pomocą nukleofilowych amin, np. DMAP, DBU, a także przez fosfiny.
Mechanizm reakcji
Poprzez addycję nukleofilową DABCO 2 do α,β-nienasyconego ketonu 1 powstaje jon obojnaczy 3, który przyłącza się do elektrofilowego aldehydu dając keto-alkohol 4. W wyniku eliminacji DABCO otrzymuje się alkohol allilowy 5 jako ostateczny produkt reakcji.

Im większe jest pKa zasady tym większa jest szybkość reakcji, dlatego chinuklidyna jest bardziej efektywna od DABCO. Rozpuszczalniki protonowe takie jak metanol, trietanolamina, formamid czy woda także przyspieszają reakcję[3].
Dla niektórych aldehydów zaproponowano alternatywny mechanizm[4][5][6]. Uwzględnia on potwierdzoną eksperymentalnie addycję drugiej cząsteczki aldehydu, w wyniku której powstaje hemiacetal 4. Następnie zachodzi przeniesienie protonu 5 (najwolniejszy, decydujący o szybkości reakcji etap). Dopiero wtedy następuje eliminacja aldehydu, co prowadzi do powstania alkoholu allilowego 7 ostatecznego produktu reakcji.
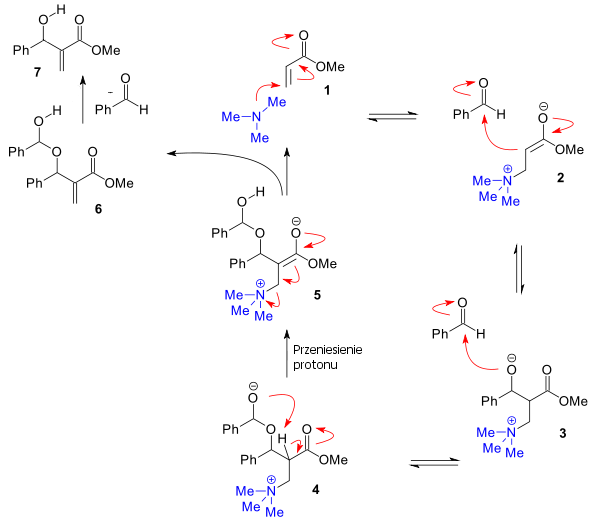
Badania in silico potwierdzają powyższy mechanizm[7] oraz tłumaczą wzrost szybkości reakcji wobec protonowych rozpuszczalników, które ułatwiają przeniesienie protonu.
Odkryta wcześniej od reakcji Baylisa-Hillmana, podobna, choć mniej znana, reakcja z zastosowaniem fosfin zamiast DABCO, nosi nazwę reakcji Rauhut-Curriera.
Możliwości
Ogólnie rzecz biorąc reakcja Baylisa-Hillmana zachodzi pomiędzy dowolnymi ubogoelektronowymi alkenami oraz elektrofilami o hybrydyzacji sp² takimi jak aldehydy, ketony czy proste iminy, katalizowane nukleofilem. W ściśle określonych warunkach jako reagent elektrofilowy może posłużyć halogenek alkilowy[8]. W tym przypadku zamiast nukleofilu aminowego stosuje się fosfiny trialkilowe, które nie reagują bezpośrednio z halogenkami. W drugim etapie reakcji dodaje się mocną zasadę, dzięki której zachodzi eliminacja do enonu.
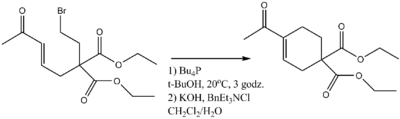
W reakcji aza-Baylisa-Hillmana jako elektrofil stosuje się iminę[9].
W ostatnich latach Namboothiri oraz Deb[10] opracowali nowatorską technikę syntezy podstawionych α-hydroksyalkilowanych nitroalkenów, stosując reakcję Baylisa-Hillmana wobec DMAP/MeCN oraz imidazolu/THF jako katalizatora. Jako elektrofilu użyli takich związków jak pirgronianu trifluorometylu, metyloglioksalu, etyloglioksalu, dietyloketomalonianu. Natomiast jako substraty posłużyły aromatyczne i heteroaromatyczne nitroalkeny.
Ograniczenia
Reakcja MBH ketonu fenylo-winylowego z benzaldehydem katalizowana przez DABCO wobec DMF prowadzi do powstania monoadduktu, który reaguje dalej z drugą cząsteczką ketonu, tworząc produkt uboczny[11].