Morfolino
Em biologia molecular, um morfolino é uma molécula com determinadas características estruturais, que se usa para modificar a expressão genética. Os oligómeros morfolino (oligos) são uma tecnologia anti-sentido usada para bloquear o acesso de outras moléculas a sequências específicas dum ácido nucleico. Os morfolinos bloqueiam pequenas regiões (~25 bases) na superfície onde tem lugar o emparelhamento de bases dum ARN.

Este artigo centra-se só nos oligos anti-sentido morfolino, que são análogos de ácidos nucleicos. A palavra "morfolino" pode aparecer noutros termos químicos, referindo-se a substâncias químicas que contêm um anel (molécula cíclica) morfolino de seis membros. Para evitar a confusão com outras moléculas que contêm morfolinos, quando se descrevem os oligos "morfolino" estes normalmente escrevem-se com maiúscula como se fosse um nome comercial, ainda que este uso nem sempre seja coerente na literatura científica. Os morfolinos denominam-se por vezes PMO, um acrónimo inglês que significa phosphorodiamidate morpholino oligo.
Os morfolinos são geralmente utilizados como ferramentas para a investigação em genética inversa para interferir na expressão genética (knockdown) de um determinado gene. Isto é conseguido impedindo as células de fabricar uma proteína específica[1] ou modificando o splicing do pré-ARNm.[2] Bloquear a expressão genética é um método muito potente para poder conhecer qual é a função duma determinada proteína; de maneira semelhante, fazer com que um exão específico seja eliminado no splicing pode ajudar a determinar a função do resíduo proteico codificado nesse exão. Estas moléculas foram também utilizadas em estudos de vários organismos-modelo, como o rato, peixe-zebra, o anfíbio Xenopus, e o ouriço-do-mar.[3]
Os morfolinos estão também a ser desenvolvidos como fármacos terapêuticos dirigidos contra organismos patogénicos como bactérias[4], vírus[5] e para a melhora de pacientes com doenças de origem genética.[6] Estes oligos sintéticos foram ideados por James E. Summerton (Gene Tools, LLC) e desenvolvidos em colaboração com Dwight D. Weller (AVI BioPharma Inc.).[7]
Estrutura
Os morfolinos são moléculas sintéticas que resultam do redesenhar da estrutura dos ácidos nucleicos naturais.[8] Geralmente possuem um comprimento de 25 bases e ligam-se a sequências complementares do ARN por emparelhamento de bases modelo. Estruturalmente, a diferença entre os morfolinos e o ADN é que para além de os morfolinos terem as bases modelo dos ácidos nucleicos, as ditas bases estão ligadas a anéis morfolino em vez de a anéis de desoxirribose e enlaçadas por grupos fosforodiamidato em vez de por fosfatos.[8] Isto pode ser mais fácil de visualizar fazendo referência à primeira figura desta página e comparando as estruturas das duas cadeias mostradas, uma de ARN e a outra de morfolino. A substituição dos aniões fosfato pelos grupos fosforodiamidato sem carga elimina a ionização na taxa normal de pH fisiológico, pelo que os morfolinos nos organismos ou nas células são moléculas não carregadas. O esqueleto completo de um morfolino é constituído por estas subunidades modificadas. Os morfolinos são utilizados principalmente como oligos monocatenários, embora se possa utilizar heterodúplex formados por uma cadeia de morfolino e uma cadeia complementar de ADN em combinação com reactivos catiónicos que facilitam na sua passagem para o citosol.[9]
Função
Diferentemente do que fazem muitos tipos estruturais anti-sentido (por exemplo, fosforotioatos, siRNA), os morfolinos não degradam as moléculas de ARN com as quais se unem. Pelo contrário, os morfolinos actuam por "bloqueio estérico", unindo-se a determinadas sequências alvo dum ARN e simplesmente colocando-se no caminho de outras moléculas que poderiam doutro modo interactuar com o ARN.[1] Os oligos morfolino são frequentemente utilizados para investigar a função dum transcrito específico de ARNm nos embriões. Os biólogos que estudam o desenvolvimento embrionário injectam oligos morfolino em ovos ou embriões de peixes-zebra (Danio rerio),[10] sapos Xenopus,[11] ouriços-do-mar,[12] ou peixes Fundulus heteroclitus produzindo embriões morfantes (morphant, ou seja, com a expressão de genes bloqueada por tratamento com morfolinos), ou introduzem morfolinos por electroporação em células de embriões de frangos em fase inicial de desenvolvimento.[13] Usando sistemas apropriados que facilitem na sua passagem ao citosol, os morfolinos podem funcionar nos cultivos celulares.[9][14] Os morfolinos estão a ser desenvolvidos como produtos farmacêuticos com o nome comercial "NeuGenes" pela AVI BioPharma Inc. Foram utilizados em mamíferos como o rato[15] e alguns estão a ser actualmente experimentados em ensaios clínicos para o tratamento da distrofia muscular de Duchenne em humanos.[16]
Expressão genética normal em eucariotas
 Ver artigo principal: Expressão genética
Ver artigo principal: Expressão genética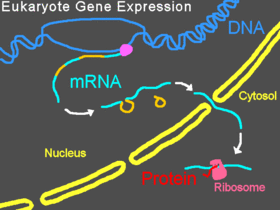
Nos eucariotas, o pré-ARNm transcreve-se no núcleo, eliminam-se os intrões, e posteriormente o ARNm maduro é exportado para o citoplasma. A subunidade menor do ribossoma normalmente liga-se a uma extremidade do ARNm e a ela ligam-se vários factores de iniciação, formando o complexo de iniciação. O complexo de iniciação desloca-se sobre o filamento de ARNm até que se estabelece no codão de iniciação, e depois a subunidade maior do ribossoma junta-se com a menor e começa a tradução da proteína. A todo este processo denomina-se-lhe expressão genética; é o processo por meio do qual a informação de um gene, codificada como uma sequência de bases do ADN, converte-se na sequência de aminoácidos duma proteína. Um morfolino pode modificar o splicing ou bloquear a tradução, dependendo da sequência de bases do morfolino.[17]
Bloqueio da tradução

Os morfolinos ligados à região 5'UTR dum ARN mensageiro podem interferir com a progressão com o complexo de iniciação ribossómica desde o cap 5' do ARNm ao codão de iniciação. Isto impede a tradução da região codificante do transcrito alvo (dando-se-lhe o nome de knocking down da expressão genética). Isto é muito útil a nível experimental quando se deseja saber qual é a função duma determinada proteína na célula; os morfolinos proporcionam um meio adequado para realizar o knockdown da expressão da proteína e descobrir como esta alteração afecta a célula ou o organismo. Alguns morfolinos bloqueiam a expressão de um jeito tão efectivo que, depois da degradação das proteínas preexistentes, as proteínas objectivo chegam a ser indetectáveis pela técnica de Western blot.[18]
Em 2016 descobriu-se que um péptido-conjugado sintético PMO (PPMO) é capaz de inibir a expressão da New Delhi Metallo-beta-lactamase, uma enzima que muitas bactérias resistentes a medicamentos utilizam para destruir carbapenemas.[19][20]
Modificação do splicing do ARNm

Os morfolinos podem interferir com o processamento do pré-ARNm ou impedindo que os complexos de ribonucleoproteínas snRNP que dirigem o splicing se unam aos seus alvos no início dos intrões num filamento de pré-ARNm; ou bloqueando a adenina nucleofílica e impedindo que se forme o laço (lariat) do splicing; ou interferindo com a união das proteínas reguladoras do splicing como os silenciadores de splicing[21] e os amplificadores de splicing.[22] Impedir durante o splicing a união da snRNP U1 (no sítio doador) ou U2/U5 (no resíduo de polipirimidina e sítio aceitador) pode modificar o splicing, normalmente excluindo exões do ARNm maduro. Tomando como alvos alguns lugares de junção (splice) pode provocar a inclusão de um intrão no ARNm maduro, enquanto que a activação de sítios ocultos de junção pode originar inclusões ou exclusões parciais.[23] Os sítios de ligação das snRNP U11/U12 também podem ser bloqueados.[24] A modificação pode ser convenientemente comprovada por reacção em cadeia da polimerase com transcritase inversa (RT-PCR) e põe-se em evidência como uma mudança de banda depois de se fazer uma electroforese em gel de produtos da RT-PCR.[2]
Bloqueio doutros sítios do ARNm
Os morfolinos foram também utilizados para bloquear a actividade do micro-ARN[25][26] e a sua maturação.[27] Podem também bloquear a actividade de ribozimas.[28] As funções das snRNP U2 e U12 podem ser inibidas com morfolinos.[29] Os morfolinos que visam sequências "escorregadias" de ARNm (slippery) em regiões codificantes de proteínas podem induzir a alterações no quadro de leitura durante a tradução.[30] Os morfolinos podem bloquear a edição de ARN.[31] As actividades dos morfolinos contra toda esta variedade de objectivos sugere que o morfolinos podem utilizar-se como uma ferramenta de uso geral para bloquear a interacção de proteínas ou ácidos nucleicos com o ARNm.[17]
Especificidade, estabilidade e efeitos não-anti-sentido
Os morfolinos converteram-se numa ferramenta padrão de bloqueio genético em sistemas embrionários de animais, os quais apresentam um grau de expressão genética mais amplo do que os tecidos adultos e podem ser muito afectados por interacções "fora do objectivo". Após as injecções iniciais em embriões de rã ou peixes na fase duma só célula ou de poucas células, os efeitos dos morfolinos podem medir-se nos cinco dias seguintes,[32] depois de passarem a maioria dos processos de organogénese e diferenciação celular, observando-se fenotipos coerentes com o bloqueio do gene alvo. Os oligos de controlo com sequências irrelevantes normalmente não produzem alterações no fenótipo do embrião, o que é uma prova da especificidade da sequência dos oligos morfolinos e da falta de efeitos não-anti-sentido. A dose requerida para o bloqueio (knockdown) pode ser reduzida pela injecção simultânea de vários oligos morfolino dirigidos contra o mesmo ARNm, sendo uma estratégia efectiva para reduzir ou eliminar as interacções com ARN fora do objectivo dependendo da dose.[33]
Os experimentos de resgate de ARNm geralmente podem restaurar o fenótipo selvagem dos embriões e proporcionar testes da especificidade dum morfolino. Num resgate de ARNm, injectam-se em simultâneo um morfolino e um ARNm que codifica a mesma proteína que o morfolino deve bloquear. Porém, o ARNm de resgate possui uma região 5'-UTR modificada para que o ARNm de resgate não contenha alvos para o morfolino. A região codificante do ARNm de resgate codifica a proteína que interessa. A tradução do ARNm de resgate substitui a produção da proteína que fora bloqueada pelo morfolino. Como o ARNm de resgate não afecta as alterações fenotípicas devido à modulação da expressão genética fora do objectivo feita pelo morfolino, este retorno ao fenótipo selvagem é mais uma evidência da especificidade dos morfolinos.[32] Em alguns casos, a expressão ectópica do ARN de resgate torna impossível a recuperação do fenótipo selvagem.
Por terem esqueletos moleculares completamente artificiais, os morfolinos não são reconhecidos pelas proteínas celulares. As nucleases não degradam morfolinos,[34] nem tampouco são degradados no soro ou nas células.[35] Os morfolinos não activam receptores do tipo Toll, pelo que não activam respostas imunitárias como a indução do interferão ou a resposta inflamatória mediada pelo NF-κB. Os morfolinos não modificam a metilação do ADN.
Um motivo para preocupação no uso de morfolinos é o seu potencial de produzir efeitos "fora do objectivo". Cerca de 18% dos morfolinos parecem produzir fenótipos fora do objectivo, incluindo a morte celular no sistema nervoso central e tecidos dos somitos dos embriões de peixe-zebra.[36] A maioria destes efeitos parece que se devem à activação da apoptose por meio da proteína p53, e podem ser suprimidos pela injecção simultânea dum morfolino anti-p53 e do morfolino experimental.[37] Parece que estes efeitos são específicos da sequência; já que em muitos casos, quando um morfolino se associa com efeitos fora do objectivo, um morfolino com uma sequência de 4 bases não-complementares não desencadeia estes efeitos.
A questão de se um fenótipo morfante observado se deve ao bloqueio genético desejado ou a uma interacção fora do alvo é muitas vezes abordada em embriões levando a cabo outro experimento para confirmar que o fenótipo morfante observado é um resultado do bloqueio do alvo pretendido. Isto pode ser feito recapitulando o fenótipo morfante com um segundo morfolino que não se sobreponha em sequência direccionado contra o mesmo ARNm[32] ou confirmando os fenótipos observados usando um mutante ou métodos dominantes negativos. Como antes mencionado, o resgate de fenótipos observados injectando simultaneamente um ARNm de resgate é, sempre que factível, um teste confiável sobre especificidade dum morfolino.[32][38]
Entrada na célula
Para que um morfolino seja efectivo deve penetrar na célula atravessando a membrana celular. Uma vez no citosol, os morfolinos difundem-se livremente entre o citosol e o núcleo, conforme se demonstra através da actividade de modificação do splicing exibida pelos morfolinos observada depois da micro-injecção no citosol das células. Usam-se diferentes métodos para introduzi-los em embriões, células cultivadas ou em animais adultos.[39] Para a sua introdução em embriões utiliza-se um aparelho de micro-injecção, e as injecções são feitas normalmente na fase embrionária duma célula ou de poucas células;[40] um método alternativo para a sua introdução em embriões é a electroporação (descargas eléctricas que criam poros na membrana), que pode facilitar a entrada dos oligos nos tecidos de fases embrionárias posteriores.[41] As técnicas comuns para a introdução em células cultivadas são o uso do péptido Endo-Porter (que faz com que o morfolino seja libertado dos endossomas),[14] o "Sistema Especial" de introdução (que usa um heterodúplex morfolino-ADN e um reagente de penetração polietilenimina etoxilado),[9] a electroporação,[42] ou o scrape loading (carga por raspado).[43]
Normalmente é muito difícil a introdução em tecidos adultos, embora existam alguns sistemas que permitem a absorção de oligos morfolino não modificados (entre os quais se incluem as células musculares, por si só muito permeáveis, características da distrofia muscular de Duchenne[44] ou das células do endotélio vascular stressadas durante uma angioplastia[45]). Embora sejam permeáveis aos líquidos intercelulares, os PMOs (morfolinos) não conjugados distribuem-se de forma muito restrita no citosol e núcleo nos tecidos saudáveis quando administrados por via IV. A administração sistémica em muitas células nos organismos adultos pode ser feita usando conjugados covalentes dos oligos morfolino, que levam péptidos penetradores da célula unidos, e, apesar de ter sido associada toxicidade com o uso de doses moderadas de conjugados de péptidos,[46][47] foram utilizados com efectividade in vivo para a introdução de oligos em doses inferiores às que causam toxicidade.[5][48] Um dendrímero octa-guanidínio ligado à extremidade de um morfolino pode fazer penetrar o oligo modificado (chamado morfolino-Vivo) desde o sangue até ao citosol celular.[39][49] Os morfolinos com capacidade de penetração, como os conjugados com péptidos ou morfolinos-Vivos, são muito prometedores para usos terapêuticos em doenças virais e genéticas.[50]
Referências
Bibliografia
- Wiley-Liss, Inc. Special Issue: Morpholino Gene Knockdowns of genesis Volume 30, Issue 3 Pages 89-200 (July 2001)[ligação inativa]. This is a special issue of Genesis that consists of a series of peer-reviewed short papers using morpholino knock downs of gene function in various animal and tissue culture systems.
- Moulton Jon (2007). John Wiley & Sons, Inc. - New Jersey, ed. Current Protocols in Nucleic Acid Chemistry. Using Morpholinos to Control Gene Expression (Unit 4.30). [S.l.]: Beaucage Serge. ISBN 978-0-471-24662-6
