Правило Марковникова
Пра́вило Марко́вникова — правило в органической химии, используемое для предсказания региоселективности реакции присоединения протонных кислот и воды к несимметричным алкенам и алкинам.

Наиболее часто данное правило формулируют следующим образом:
«При присоединении протонных кислот и воды к несимметричным алкенам и алкинам атом водорода присоединяется к наиболее гидрогенизированному атому углерода».
Впервые правило было предложено русским химиком В. В. Марковниковым в 1869 году[1].
История

Наблюдения В. В. Марковникова по поводу региоселективности присоединения к алкенам были опубликованы в 1870 году на немецком языке в журнале «Justus Liebigs Annalen der Chemie». Однако ещё долгое время правило Марковникова игнорировалось современниками. Тому было несколько причин. Во-первых, данные о региоселективном присоединении находились в приложении к 26-страничной статье Марковникова, посвящённой изомерным масляным кислотам. Текст статьи характеризуют как путаный, к тому же данные по масляным кислотам уже публиковались Марковниковым двумя годами ранее, поэтому, вероятно, в то время статья имела низкую популярность[2].
Во-вторых, Марковников позиционировал своё правило как естественное продолжение открытий русского химика А. М. Бутлерова, который показал, что при бромировании алканов наиболее активно замещается атом водорода при третичном атоме углерода[2].
Наконец, Марковников привёл слишком мало экспериментальных доказательств. В 1870 году было трудно провести присоединение галогеноводорода к алкену в контролируемых условиях и определить основной продукт реакции. Основными методами установления структуры веществ являлись определение температуры кипения и плотности, что предполагало наличие данных по чистым веществам для сравнения. Кроме того, Марковников допускал в статье грубые ошибки при цитировании работ других химиков, например, для двух работ он привёл не тот галогеноводород, который использовался авторами на самом деле[2].
«Я не могу здесь вдаваться в подробное рассмотрение различных фактов, которые позволяют нам установить такой закон».
Оригинальный текст (нем.)«Ich kann hier nicht ausfuhrlich in die Betrachtung der verschiedenen Thatsachen eingehen, welche uns erlauben, ein soloches Gesetz aufzustellen.»— Markownikoff W., Justus Liebigs Annalen der Chemie, 1870, 153(2), 228–259
Правило Марковникова как таковое установилось лишь в 1924 году благодаря работе О. Маасса (англ. O. Maass), который растворял безводные галогеноводороды и алкены в гексане и наблюдал образование продуктов, предсказанных Марковниковым[3]. В частности, он первым провёл классический иллюстративный эксперимент — присоединение бромоводорода к пропену, в котором достоверно образовался 2-бромпропан[2].
Формулировки
Приводимые в различных источниках формулировки правила Марковникова отличаются друг от друга[4].
В оригинальной работе В. В. Марковников писал:
Когда несимметричный алкен соединяется с галогеноводородной кислотой, галоген присоединяется к атому углерода, содержащему меньше атомов водорода, то есть к атому углерода, на который больше влияют другие атомы углерода[2].
Далее, когда Марковников рассматривал присоединение галогеноводородов к алкенам, содержащим галоген при двойной связи, он добавлял, что «атом галогена присоединяется к атому углерода, уже содержащему атом галогена»[2].
В современных российских[5] и зарубежных[2] изданиях чаще появляется обратная формулировка, в которой обращается внимание на присоединение атома водорода:
При присоединении галогеноводорода к несимметричному алкену атом водорода присоединяется к более гидрогенизированному атому углерода.
В 1875 году Марковников переформулировал правило, расширив его и распространив на присоединение полярных молекул в общем:
Когда ненасыщенная молекула CnHmX присоединяется к другой молекулярной системе YZ при низкой температуре, более отрицательный элемент или группа Y соединяется с менее гидрогенизированным атомом углерода или с тем, который уже был соединён с каким-либо отрицательным элементом; но при более высоких температурах именно элемент Z присоединяется к менее гидрогенизированному атому углерода»[6].
В данном варианте правило стало предусматривать также обратную региоселективность присоединения при высоких температурах, которую в 1933 году объяснили М. Караш и Ф. Майо (эффект Караша)[6].
В том же году А. М. Зайцев развил правило Марковникова, включив в него случаи присоединения к алкенам, в которых двойная связь находится между двумя атомами углерода, гидрогенизированными в одинаковой степени, а при одном из них находится метильная группа. Дополнение Зайцева гласило, что атом галогена присоединяется к атому углерода, соединённому с метильной группой. Данный факт был позже объяснён при помощи понятия гиперконъюгации[4].
Позже стали применяться термины, описывающие образующиеся продукты или протекание реакции как марковниковские и анти-марковниковские, то есть совпадающие либо несовпадающие с предсказаниями правила Марковникова. Выражение «анти-марковниковский» обязано популярностью Г. Ч. Брауну, который при помощи данного слова подчёркивал синтетическую полезность реакций гидроборирования—окисления, дающих продукты, отличные от тех, что получались при обычной гидратации. Примечательно, что гидроборирование происходит именно в соответствии с расширенной формулировкой правила Марковникова, поскольку отрицательно заряженный атом водорода в молекуле борана присоединяется к менее гидрогенизированному атому углерода, и лишь последующая реакция окисления, приводящая к образованию спирта создаёт кажущийся парадокс несоответствия правилу Марковникова[6].

После того, как был изучен механизм реакций электрофильного присоединения, правило Марковникова стало приобретать ещё одну, современную форму:
Присоединение электрофила к двойной связи происходит с образованием более устойчивого карбокатиона»[7].
Некоторые авторы считают[6], что данную формулировку некорректно называть правилом Марковникова, поскольку она хотя и сохраняет те же выводы, имеет под собой совершенно другую основу, которая в конце XIX века ещё не могла быть известна.
Механистическая трактовка

Для объяснения преобладания более замещённого галогенида над менее замещённым в продуктах реакции обычно прибегают к рассмотрению механизма электрофильного присоединения к алкенам.
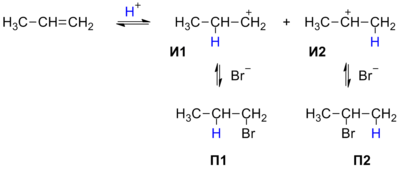
Реакция протекает в две стадии. На первой, медленной, стадии происходит присоединение протона H+ к двойной связи: при этом протон может связываться с одним из двух атомов углерода, образующих двойную связь. Образующиеся карбокатионы И1 и И2 имеют различную энергию (устойчивость), поскольку положительный заряд в них делокализуется с разной эффективностью. По этой причине вторичный карбокатион И2 является более устойчивым, и соответствующий ему бромид П2 образуется в большем количестве.
При более строгом рассмотрении необходимо сравнивать устойчивости не интермедиатов, а двух альтернативных переходных состояний на стадии образования карбокатионов, то есть энергии активации двух параллельных процессов. Для некоторых реакций различие этих величин достигает 25—30 кДж/моль[1].
Однако, согласно постулату Хэммонда, для эндотермических реакций энергия переходного состояния близка к энергии интермедиата, поэтому принимаемое в данном случае упрощение оказывается приемлемым[5].
Формальные исключения
Алкены с электроотрицательными заместителями
Вскоре после публикации правила Марковникова стали известны примеры, когда присоединение к алкенам достаточно простого строения приводило к неверному результату (анти-марковниковским продуктам) даже при низкой температуре. В то время, как эмпирическое правило Марковникова неспособно объяснить данные исключения, рассмотрение механизма позволяет достаточно просто показать, что образование таких продуктов согласуется с относительной устойчивостью карбокатионов[5].
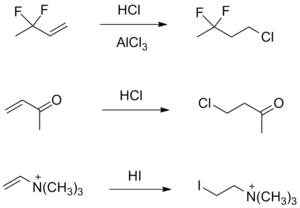
Радикальное присоединение
Другой тип исключений относится к реакциям, протекающим по радикальному механизму и также дающим анти-марковниковские продукты. Такие случаи учитывались в расширенной формулировке правила Марковникова как реакции «при более высоких температурах». Позже М. Караш и Ф. Майо показали, что в основе аномального результата таких реакций лежит их радикальный механизм[8].

Критика
В данное время закономерности электрофильного присоединения к алкенам и алкинам были изучены достаточно подробно. Это позволяет объяснять региоселективность реакций на основании их механизмов. Данный подход, в отличие от правила Марковникова, имеющего ряд исключений, является достаточно универсальным и удобным. В связи с этим, в настоящее время в зарубежных методических публикациях появляются предложения отказаться от преподавания правила Марковникова и перейти к более универсальным механистическим представлениям об органических реакциях[6][9].
Также признаётся существенная разница между классической формулировкой правила Марковникова, по сути являющейся гипотезой, и современной формулировкой, представляющей собой теорию[10].
См. также
Примечания
Литература
- Markownikoff W. I. Ueber die Abhängigkeit der verschiedenen Vertretbarkeit des Radicalwasserstoffs in den isomeren Buttersäuren (нем.) // Justus Liebigs Annalen der Chemie. — 1870. — Bd. 153, Nr. 2. — S. 228—259. — doi:10.1002/jlac.18701530204.
