CRISPR
CRISPR(IPA:/ˈkrɪspər/;DJ:/ˈkrispə/;KK:/ˈkrɪspɚ/)1987年日本科學家在大腸桿菌的基因組發現有特別的規律序列,某一小段DNA會一直重複,重複片段之間又有相等長的間隔,此序列稱為 CRISPR (clustered, regularly interspaced, short palindromic repeats)。它是存在於细菌中的一種基因,該類基因組中含有曾經攻擊過該細菌的病毒的基因片段。細菌透過這些基因片段來偵測並抵抗相同病毒的攻擊,並摧毁其DNA。這類基因組是細菌免疫系统的關鍵組成部分。透過這些基因组,人類可以準確且有效地編輯生命體内的部分基因,也就是CRISPR/Cas9基因編輯技術。
| Cascade (CRISPR相關病毒防禦複合體) | |
|---|---|
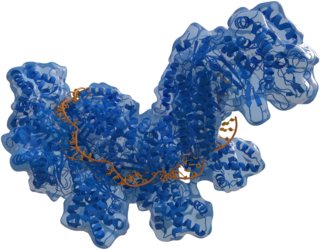 | |
| Structure of crRNA-guided E. coli Cascade complex (Cas, 藍色) bound to single-stranded DNA (橘色). | |
| 标识 | |
| 生物 | |
| 符号 | CRISPR |
| Entrez | 947229 |
| PDB | 4QYZ |
| RefSeq (蛋白质) | NP_417241.1 |
| UniProt | P38036 |
| 其他数据 | |

CRISPR/Cas系統,為目前發現存在於多數細菌與絕大多數的古菌中的一種後天免疫系統[2],以消滅外來的质粒或者噬菌體[3][4],並在自身基因組中留下外來基因片段作為“記憶”[5]。臺灣翻譯全名為常間回文重複序列叢集/常間回文重複序列叢集關聯蛋白系統,中國大陸則為规律间隔成簇短回文重复序列/规律间隔成簇短回文重复序列相关蛋白系统(或相关核酸酶系统)(Clustered Regularly Interspaced Short Palindromic Repeats/CRISPR-associated proteins)。
目前已發現三種不同類型的 CRISPR/Cas系統,存在於大約40%和90%已定序的细菌和古菌中[6][7]。其中第二型的組成較為簡單,以Cas9蛋白以及嚮導RNA(gRNA)為核心的組成。
Cas9是第一個被廣泛應用的CRISPR核酸酶,其次是Cpf1,其在新澤西弗朗西斯菌的CRISPR/Cpf1系统中被發現[8][9]。其它這樣的系統被認為存在[10]。
由於其對DNA干擾(DNAi)的特性(參見RNAi),目前被積極地應用於遺傳工程中,作為基因體剪輯工具,與鋅指核酸酶(ZFN)及類轉錄活化因子核酸酶(TALEN)同樣利用非同源性末端接合(NHEJ)的機制,於基因體中產生DNA的双链断裂以利剪輯。第二型 CRISPR/Cas 經由遺傳工程的改造應用於哺乳類細胞及斑馬魚的基因體剪輯[11][12]。其設計簡單以及操作容易的特性為最大的優點,目前已逐步應用在各種不同的模式生物當中。
發現歷史
聚簇DNA重複的發現始於世界三個地區的三個獨立地點。我們今天稱為CRISPR的基因組重複群集,即原核生物擬核DNA鏈中的丛生重复序列,在1987年一份由大阪大学的石野良純領銜的大腸桿菌研究报告中被首次描述[13]。2000年,相似的重复序列在其它真细菌和古细菌中被发现,并被命名为短间隔重复序列(Short Regularly Spaced Repeats,SRSR)[14]。2002年SRSR被重命名为CRISPR,其中一部分基因编码的蛋白为核酸酶和解旋酶,这些关联蛋白(Cas, CRISPR-associated proteins)与CRISPR组成了CRISPR/Cas系统[15]。
Cas9
科学家还研究了来自化脓性链球菌的更简单的CRISPR系统,其依赖于蛋白Cas9。Cas9内切核酸酶是包含两个小RNA分子的四组分系统[16]。
詹妮弗·杜德纳、埃马纽埃尔·卡彭蒂耶及張鋒各自独立的探索CRISPR关联蛋白,了解细菌如何在它们的免疫防御使用间隔(spacer)。他们共同研究一个比较简单的依赖于称为Cas9蛋白的CRISPR系统。
Cpf1
在2015年,核酸酶Cpf1被发现在新泽西弗朗西斯菌的CRISPR/Cpf1系统[8][9]。其他这样的系统被认为存在[10]。Cpf1与Cas9的有几个关键差异,包括:1. DNA 斷裂方式不同:导致双链DNA中的“交错”或“黏性(sticky end)”切割,而不是由Cas9产生的“钝的 (Blunt end)”切割。2. 相邻間隔原基序(PAM)不同:Cpf1辨認“富含T碱基”的PAM,而 Cas9 辨認 NGG 為PAM,可为 Cas9 提供替代的標靶序列。3. 仅需要 CRISPR RNA(crRNA)用于成功標定(使用Cas9同时需要crRNA和一个反向活化crRNA(tracrRNA))。
Cas9n
Cas9n是SpCas9的D10A突变体,只保留了SpCas9两个核酸酶结构域(RuvC和HNH)中的一个来产生DNA切口而不是DSB。因此,需要两个靶向相反的Cas9n才能在靶DNA内产生DSB,这种方法大大提高了靶标特异性,因为不太可能产生两个离靶切口。
評價
在2012年和2013年,CRISPR是《科学》年度突破的第二名。
在2014年和2016年被《麻省理工科技評論》评为10项突破技术之一[17][18]。
在2020年 艾曼紐爾.夏本提爾(Emmanuelle Charpentier) 與珍妮佛.道納(Jennifer Doudna) 藉CRISPR的研究榮獲2020年諾貝爾化學獎的桂冠