Fischer卡宾
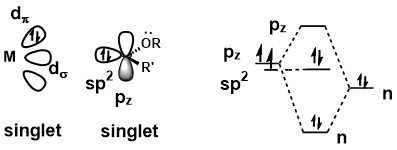
Fischer卡宾是二价的有机金属配合物卡宾。Fischer卡宾的中心碳原子将其 sp2杂化轨道上的电子提供给中心金属的d轨道中,而中心金属以反馈键的方式将一对电子提供给碳原子上空的π轨道中。Fischer卡宾的中心金属的π反馈键通常较弱,金属价态较低,因此总体上Fischer卡宾是亲电性的。
Fischer卡宾的命名来源于恩斯特·奥托·菲舍尔。
结构
Fischer卡宾是一种单线态卡宾,卡宾上取代基的孤对电子离域提高了碳pz轨道的能量,从而使得卡宾的两个电子保持成对。卡宾和中心金属的成键包括一个强的sp2提供给金属d轨道的σ键,和从中心金属处接受至pz轨道的弱π键。[1]
由于这种成键方式,Fischer卡宾通常有以下特征:
1、低价态的中心金属
3、能够接受π电子的配体
制备
Fischer卡宾的最常见合成方法是金属羰基化合物与烃基锂反应,生成酰基金属羰基配合物。此过程中得到的近似烯醇锂的结构高度稳定,因此需要用高亲电性的烷基化试剂(如Meerwein盐)。[2]以碘甲烷作烷基化试剂可以通过相转移体系完成。[3]此种方式合成的Fischer卡宾为电中性卡宾。锂可以以四烷基铵离子代替,以得到活性更强的烯醇。得到的中性四烷基铵盐可以酰化得到具有高亲电性的酰基配合物,可通过与醇发生亲核取代得到Fischer卡宾[4],此种方式合成的Fischer卡宾为阳离子卡宾。
通过羰基金属阴离子和甲酰胺可以制备含α-氢的的Fischer卡宾,需要加入过量的TMSCl。[4]
去氢
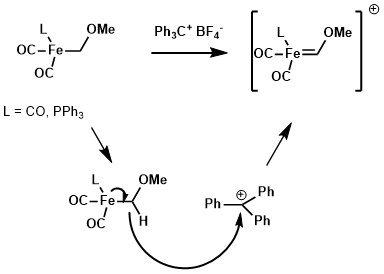
使用合适的提氢试剂,如三苯甲基阳离子试剂,金属配合物烷基配体上的氢能被夺走并得到Fischer卡宾。[2]
脱羰
相关反应
类羰特性
Fischer卡宾是亲电性的,经常表现出和羰基化合物相似的反应性。许多反应可以以羧基等价结构来理解,如酯交换反应、Michael加成和羟醛缩合。如图Cr(CO)5部分是一个强吸电子基团,使卡宾α-H有酸性。有甲基侧链的甲氧基铬卡宾在乙腈水溶液中的pKa为12.5(体积比1:1)。[6][7] 作为参考,乙酸甲酯的pKa为25.6,证明Cr(CO)5有较强的吸电子能力。
Diels-Alder反应
Fischer卡宾的亲电性也能体现在许多反应中。例如,丙烯酸甲酯和异戊二烯的Diels-Alder反应在室温下需要7天完成,且对/间位的选择性低。但是,对应的Fischer卡宾反应在室温下3小时即可完成,并且有更高的对位选择性。[8]
Michael加成
乌洛托品是一种弱的亲核试剂,能够参与到炔基Fischer卡宾的Michael加成反应中,得到一种有趣的双重加合产物。[9]
烷基化
通过Fischer卡宾的去质子化获得的类烯醇结构可以烷基化。然而,因为碳负离子高度稳定,所以需要活性的烷基化试剂,例如氟磺酸甲酯或溴乙酸甲酯。[10][11]
羟醛缩合
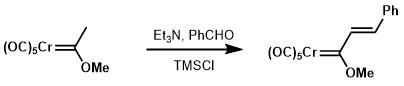
相比羰基而言,Fischer卡宾的羟醛缩合反应可以通过使用更弱的碱来发生,如三乙胺。[12] [13]
脱去金属
Fischer卡宾能够使用温和的氧化剂,如硝酸铈铵,脱去金属得到对应的羰基化合物。[2]
如果Fischer卡宾的侧链上有α-H,他可以与弱碱发生反应,如吡啶。这可以得到氢化铬类物质,经还原消除后得到顺式烯醇醚。[14]
Dötz反应
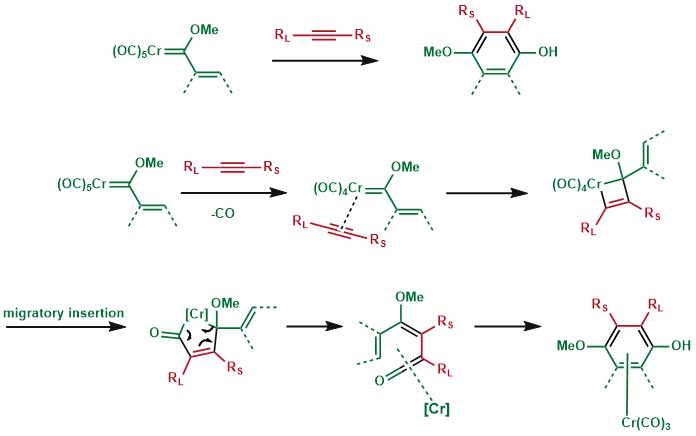
含烯基侧链的Fischer卡宾与炔烃反应,能得到苯酚结构,酚基碳来源于CO配体,其上α,β-不饱和部分可能来自富电子芳环体系,最终得到多环芳香结构。该反应首先由Karl Heinz Dötz发现,并由他的小组和William D. Wulff推广发展,因此得名。[15]
Dötz反应中的半夹心配合物可以脱去金属得到对应的芳基产物,他可以通过进一步的亲核加成合成高度取代的芳环产物。[16]
Dötz反应已被用作许多天然产物合成的关键步骤,下图是该反应的应用展示。[17] [18]
半Dötz反应
某些环境中,如果试剂的反应性不足或Dötz反应机理发生的条件不满足时,Dötz反应产物会被中断,得到以烯酮中间体为主的产物。例如,如果炔烃上的取代基太大,可能会得到环丁烯结构。[19]
如果炔酮结构两侧的取代基R和R’空间体积不大时,产物可能以8电子π环化的构象为主,如所示得到稠合双环内酯结构。[20] [21] [22]
炔烃反应物侧链上的烯烃或亲核部分可以分别通过[2+2]环加成或亲核加成来捕获生成的烯酮。该反应被用于合成广谱的抗霉素,如Blastmycinone(一种三取代内酯)及Antimycinone。[23][24][25]
有α-H的Fischer卡宾可以通过类似于葆森–侃德反应得到环戊烯酮结构。[26]
如果Fischer卡宾中含有不共轭的烯烃结构,则可以得到环丙烷化的桥烃,该反应被用于天名精内酯酮的合成中。[27][28]
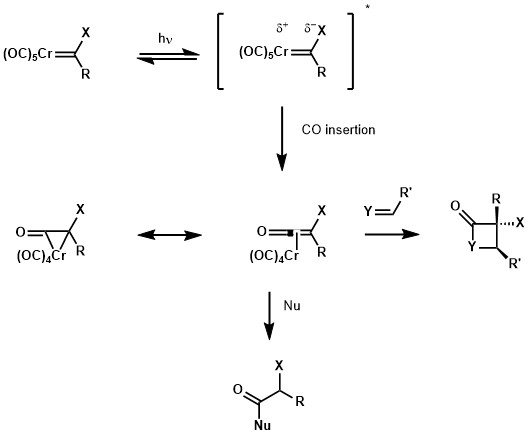
光化学性质
Fischer卡宾的UV-Vis光谱在近紫外区显示出金属到配体的电荷转移带。一方面,电子从金属轨道激发至配体轨道能够让卡宾碳更富电子化。另一方面,由于金属的羰基配体而已经缺电子的中心金属变得更加缺电子,促进了CO配体的迁移插入。这种迁移插入得到了铬环丙酮,铬化的乙烯酮共振形式。由于有着烯酮的反应性,该物质可以被亲核试剂(如醇或胺)所捕获,或者与烯烃、亚胺或醛发生[2+2]环加成反应,得到对应的环丁烷、β-内酰胺和β-内酯加合物。[29]