Multipel sklerose
Multipel sklerose eller Multipel sclerose (forkortet MS, kaldes også encephalomyelitis disseminata, dissemineret sklerose, dissemineret sclerose, sclerosis disseminata eller blot sklerose/sclerose) er en kronisk, uhelbredelig neurologisk sygdom, som rammer centralnervesystemet, det vil sige hjernen og rygmarven. Mere præcist er det en sygdom i hvilken myelinskeder omkring hjernens og rygsøjlens axoner bliver beskadigede, hvilket fører til demyelinering og ardannelse såvel som et bredt spektrum af tegn og symptomer.[1] De mest almindelige er nedsat førlighed, dårligt syn, lammelser og koordinationsvanskeligheder; men patienterne har forskellige symptomer alt efter hvor i hjernens eller rygmarvens myelin, betændelserne opstår. Sygdommen viser som regel sine første tegn hos unge voksne, og den er mest almindelig hos kvinder.[1] Dens udbredelse ligger mellem 2 og 150 per 100.000.[2] MS blev første gang beskrevet i 1868 af Jean-Martin Charcot.[3]
| Multipel sklerose Klassifikation | |
|---|---|
 Myelin-nedbrydning (Engelsk ledsagetekst: Photomicrograph of a demyelinating MS-Lesion. Immunohistochemical staining for CD68 highlights numerous macrophages (brown)) | |
| Information | |
| Navn | Multipel sklerose |
| Medicinsk fagområde | neuromedicin |
| Genetisk association | MET, RNASEL, HLA-DRA, PVR, SYK, CD86, CXCR5, STAT3, MAPK1, ZFP36L1, CBLB, CD6, CD58, CYP24A1, MLANA, IL2RA, IL7R, MGAT5, RPS6KB1, BREB1, TLL1, TNFRSF1A, VAV2, YWHAG, EVI5, TNFSF14, SAE1, MPHOSPH9, DLEU1, MERTK, BATF, RGS14, C6orf10, MALT1, SP140, KIF1B, PLCL2, CLEC16A, TRIM2, EGFL6, DKKL1, PDZRN4, AHI1, CHST12, MYNN, BTNL2, ZMIZ1, HACE1, EPS15L1, BACH2, CLSTN2, CSMD1, NDFIP1, MPV17L2, FCRL3, ALPK2, TAGAP, ZBTB46, VTI1A, CLECL1, NLRP11, SUMF1, SAMD12, CUEDC1, SGCD, RELN, C1GALT1, GPC5 |
| SKS | DG35 |
| ICD-10 | G35 |
| OMIM | 612594, 612596, 612595 |
| DiseasesDB | 8412 |
| MedlinePlus | 000737 |
| ICD-9-CM | 340 |
| Patientplus | multiple-sclerosis-pro |
| MeSH | D009103 |
| Information med symbolet | |
MS påvirker nervecellerne i hjernen og rygsøjlens mulighed for at kommunikere med hinanden. Nerveceller kommunikerer ved at sende elektriske signaler kaldet aktionspotentialer langs fibre kaldet axoner, som er pakket ind i en isolerende substans kaldet myelin. I MS angriber og skader ens eget immunforsvar myelinen. Når myelin går tabt kan axonerne ikke længere effektivt give signaler videre.[4] Navnet multipel sklerose henviser til ar (sclerose—bedre kendt som plak eller læsioner) i den hvide substans i hjernen og rygsøjlen, som hovedsageligt består af myelin.[3] Selvom man ved meget om mekanikkerne i sygdommens progression, forbliver årsagen til sygdommen uvis. Teorier herom inkluderer genetik eller infektioner. Forskellige miljømæssige risikofaktorer er også blevet påvist.[4][5]
Næsten ethvert neurologisk symptom kan forekomme som følge af sygdommen, og disse symptomer udvikler sig ofte til fysiske og kognitive handicap[4] og neuropsykiatriske lidelser.[6] MS kan antage flere former, hvor nye symptomer enten viser sig som diskrete angreb (relapserende former) eller langsomt ophober sig over tid (progressive former).[7] Mellem angrebene kan symptomerne forsvinde helt, men ofte opstår permanente neurologiske problemer, specielt som sygdommen skrider frem.[7]
Der er ingen kendt kur mod MS. Behandlinger forsøger at genskabe neurologiske funktioner efter angreb, forebygge mod nye angreb og undgå handicap.[4] MS-medicin kan have modsatrettede effekter eller mange bivirkninger, og mange patienter forsøger sig med alternativ behandling på trods af manglende videnskabelig opbakning dertil. Prognosen for en sygdomsramt er svær at forudsige; den afhænger af typen af MS, den individuelles sygdomskarakteristik og graden af forværring patienten oplever over tid.[8] Den forventede levealder for patienter er næsten den samme som for den uberørte del af befolkningen.[8]
Tegn og symptomer
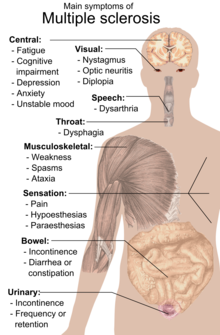
En person med MS kan lide under næsten alle neurologiske symptomer eller tegn, inklusiv ændringer i fornemmelser (hypæstesi og paræstesi), muskelsvaghed, muskelkramper eller besvær ved bevægelser; vanskeligheder med koordination og balance (ataksi), problemer med talen (dysartri) eller synkebesvær (dysfagi), synsforstyrrelser (nystagmus, optisk neuritis[9] eller dobbeltsyn), træthed, akut eller kronisk smerte samt blære- og tarmproblemer.[1] Kognitiv svækkelse i varierende grad og emotionelle symptomer på depression eller ustabilt humør er også almindeligt.[1] Uhthoffs fænomen, en forværring af eksisterende symptomer grundet udsættelse for temperaturer, der er højere end normalt, og lhermittes tegn, en elektrisk følelse, der løber langs ryggen, når man bøjer nakken, er særligt karakteristiske for MS, men er ikke udelukkende tilknyttet sygdommen.[1] Det primære kliniske mål for handicappenes progression og symptomernes alvor er Expanded Disability Status Scale (EDSS).[10]
Symptomer på MS optræder som oftest i episodiske perioder med akut forværring (kaldet attakker, tilbagefald eller angreb), i en gradvist fremskridende forværring af neurologiske funktioner eller i en kombination af begge.[7] Multipel sklerose-attakker er ofte uforudsigelige og fremkommer uden forvarsel og uden åbenlyse igangsættende faktorer med en hyppighed normalt under 1 og en halv per år.[1] Før nogle angreb vises dog nogle typisk forekommende tegn. Attakker kommer oftere i foråret og sommeren.[11] Virale infektioner så som almindelig forkølelse, influenza eller gastroenteritis øger risikoen for tilbagefald.[1] Stress kan også udløse attakker.[12] Graviditet påvirker disponeringen for angreb med færre angreb for hvert trimester af graviditeten. De to første måneder efter fødslen er der dog større risiko for angreb.[1] Overordnet set synes graviditet dog ikke at påvirke graden af handicap. Mange potentielle udløsere er blevet undersøgt, men i mange tilfælde er disse blevet tilbagevist, idet de ikke viste nogen påvirkning på angrebsraten. Der er ikke noget bevis for at hverken vaccination og amning,[1] fysisk traume[13] eller Uhthoffs fænomen[11] er udløsere for attakker.
Årsager
MS indtræffer højst sandsynligt som et resultat af en eller anden kombination af både miljømæssige og genetiske faktorer.[1][14] Epidemiologiske MS-studier har givet antydninger af hvilke mulige årsager, der er til sygdommen. Teorier forsøger at kombinere de kendte data til plausible forklaringer, men ingen af disse er endeligt bevist.
Genetik

MS betragtes ikke som en arvelig sygdom. På trods af dette er en række genetiske variationer, der øger risikoen for at udvikle sygdommen, blevet fundet.[15]
Risikoen for at udvikle MS er højere iblandt slægtninge til en person med sygdommen, end i resten af befolkningen, især hvad angår søskende, forældre og børn.[4] Sygdommen gentager sig inden for familien i omkring 20% af tilfældene.[1] Hvad angår enæggede tvillinger optræder sammenfald kun i omkring 35% af tilfældene, mens det kun ligger på 5% hos søskende og endda lavere hos halvsøskende. Dette indikerer, at modtageligheden kun er delvist polygenisk drevet.[1][4]
Foruden familieundersøgelser er specifikke gener blevet sat i forbindelse med MS. Forskelle i det humane leukocytantigen (HLA)-system – en gruppe gener i kromosom 6, der tjener som major histocompatibility complex (MHC) i mennesker – øger sandsynligheden for at lide af MS.[1] Det mest konsekvente resultat er sammenhængen mellem MS og alleler af MHC defineret som DR15 og DQ6.[1] Andre loci har vist en beskyttende effekt, heriblandt C554 og DRB1*11.[1]
Miljømæssige faktorer
Forskellige miljømæssige faktorer, både af infektiøs og ikke-infektiøs art, er blevet foreslået som risikofaktorer for MS. Selvom nogle er delvist modificerbare, kan kun videre forskning – i særdeleshed kliniske undersøgelser – afsløre, om elimineringen af dem kan forhindre sygdomsudbrud.[16]
MS er mere almindelig i folk, der bor langt fra ækvator, selvom der findes mange undtagelser herfra.[1] Nedsat udsættelse for sollys er blevet forbundet med en højere risiko for MS.[16] Nedsat vitamin D-produktion og -optag er blevet brugt som den primære biologiske mekanisme i forklaringen af den højere risiko blandt dem, der udsættes for mindre sollys.[16][17]
Alvorlig stress kan måske også være en risikofaktor, selvom bevismaterialet er tyndt.[16] Herudover er det også påvist, at rygning er en uafhængig risikofaktor i udviklingen af MS.[17] Forbindelse med arbejdsbetinget eksponering og giftstoffer – hovedsageligt solventer – er blevet vurderet, men ingen tydelige konklusioner er opnået.[16] Vacciner blev også betragtet som årsagsfaktorer for sygdommen; De fleste undersøgelser viste dog ingen forbindelse mellem MS og vacciner.[16] Adskillige andre mulige risikofaktorer, såsom diæt og hormonindtag, er blevet undersøgt; Mere bevismateriale er dog nødvendig for at bekræfte eller afvise deres relation til sygdommen.[17]
Hos patienter med MS forekommer Gigt i mere begrænset omfang, end hvad man statistisk kunne forvente, og lave niveauer af urinsyre er konstateret i forhold til det normale niveau. Dette førte til den teori, at urinsyre beskytter mod MS, selv om dens præcise betydning forbliver ukendt.[18]
Infektioner
Genetisk disponering kan forklare nogle af de geografiske og epidemiologiske variationer i MS-tilfælde, blandt andet den høje forekomst blandt nogle familier eller risikofald med genetisk afstand, men redegør ikke for andre fænomener, såsom de ændringer i risikoen, der forekommer som følge af migration i en tidlig alder.[5]
En forklaring på denne epidemiologiopdagelse kunne være, at en form for infektion produceret af en udbredt mikrobe snarere end en sjælden patogen, er oprindelsen til sygdommen.[5] Forskellige hypoteser har uddybet den mekanisme, hvormed dette kan forekomme. Hygiejnehypotesen foreslår, at eksponering til flere infektiøse agenser tidligt i livet beskytter med MS. MS ville være en autoimmun reaktion udløst i udsatte individer af flere infektiøse mikroorganismer.[1] Prævalenshypotesen foreslår, at sygdommen skyldes et patogen, der er mere almindelig i regioner med høj MS-udbredelse. Dette patogen er meget almindeligt, og forårsager en asymptomatisk vedvarende infektion i de fleste individer. Kun i få tilfælde, og mange år efter infektionen fandt sted, forårsager det demyelinering.[5][19] Hygiejnehypotesen har fået mere opbakning end prævalenshypotesen.[5]
Bevis for virus som årsag inkluderer tilstedeværelsen af oligoklonale bånd i hjernen og cerebrospinalvæsken hos de fleste patienter, tilknytningen af flere virus med human demyelinerende encefalomyelitis og induktion af demyelinering i dyr gennem viral infektion.[20] Human herpesvirus er en kandidatgruppe af virus tilknyttet MS;[21] Personer der aldrig har været inficeret med Epstein-Barr virus har mindre risiko for at have sygdommen og blandt inficerede har de der var inficeret som unge voksne større risiko end personer inficeret i en yngre alder.[5][1] Dette taler mod hygiejnehypotesen, eftersom de ikke-inficerede formentligt har haft en mere hygiejnisk opvækst.[5] Andre agenser, der også er blevet forbundet med MS, er humant endogent retrovirus og Chlamydia pneumoniae.[22][23][24]
Patofysiologi

Læsioner
Navnet "multipel sklerose" henviser til ar-lignende aflejringer (bedre kendt som plaques eller læsioner), der dannes i centralnervesystemet. Læsionerne ses oftest i den hvide substans omkring ventriklerne, lillehjernen, hjernestammen, basalganglierne, rygmarven og synsnerven. Formålet med cellerne i den hvide substans er at formidle signaler fra den grå substans til resten af kroppen. Det perifere nervesystem er sjældent involveret i MS.[4]
Mere specifikt ses der i MS tab af oligodendrocytter, som er involveret i dannelse og vedligeholdelse af nervecellernes myelinskeder, som effektiviserer videreformidlingen af disses elektriske signaler (aktionspotentialer).[4] Dette fører til en fortynding eller fuldkomment tab af myelinskederne og yderligere nedbrydning af nervecellernes aksoner som sygdommen skrider frem. Når myelinet tabes er det ikke længere muligt for cellen effektivt at videreformidle elektriske signaler.[4] En reparationsprocess kaldet remyelinering finder sted i sygdommens tidlige stadie, men oligodendrocytterne er ikke tilstrækkelige til at få genopbygget cellernes myelinskeder.[25] Gentagne anfald medfører mindre effektiv remyelinering, indtil en arlignende aflejring (plaque eller læsion) dannes omkring det skadede akson.[25] Forskellige læsionsmønstrer er blevet observeret i MS.[26]
Autoimmunologi
MS menes at være en immun-medieret lidelse, som opstår på baggrund af kompleks interaktion med individets genetiske baggrund og uidentificeret miljørelateret årsager.[4] Skaderne i CNS menes at være forårsaget af angreb fra individets eget immunforsvar. Nogle af de cellulære komponenter som immunsystemet angriber (autoantigener) menes at være "myelin basisk protein" (MBP) og "proteolipid protein" (PLP). Det ofte ordinerede MS-medikament glatiramer acetate blev designet til at efterligne MBP, og fungere som afledningsmanøvre for autoreaktive immunceller, hvorved angreb på nervecelleaksonerne ville undgås. MBPs rolle i MS-patogenesen er dog omdiskuteret, da proteinet er lokaliseret inde i myelinskeden (frem for på overfladen), hvor immuncellerne ikke er i stand til at erkende det.
Nyere studier peger på myelinlipiders involvering i MS.[27] Historisk har det altid været antaget at myelin komponenten som skabte den autoimmune reaktion måtte være et protein, selvom myleinskeden indeholder over 80% lipider. Yderligere argumentation for at lipider kunne være årsag til den autoimmune reaktion, er baseret på en anden autoimmun lidelse kaldet Guillain Barre syndrom.
Uanset om den cellulære autoantigen er et protein eller et lipid, kan reaktionen opstå som følge af, immuncellerne genkender et fremmed antigen, og efterfølgende krydsreagerer med organismens egne komponenter (kaldet selv antigener), da disse minder om det fremmede antigen - et fænomen kaldet molekylære mimicry.[4][28]
Inflammation
Inflammation er udover demyelinering det andet hovedsygdomstegn ved MS. Ifølge immunologiske teorier vedrørende MS patogenesen er den inflammatoriske reaktion forårsaget af T-celler, (en lymfocyt type involveret i kroppens immunsystem).[4] T-celler opnår adgang til hjernen gennem "sprækker" i blod-hjerne-barrieren. Undersøgelser af dyremodeller har også vist, at B-celler spiller en mulig rolle.[29]
T-cellerne genkender myelinet som fremmed, og angriber dette, som var det en indtrængende virus. Herved igangsættes en inflammatorisk reaktion, der stimulerer andtre immunceller, og opløselige faktorer som cytokiner og antistoffer. Processen leder til yderligere lækage af blodhjerne-barrieren, som leder til en række andre skadende effekter såsom opsvulmen, aktivering af makrofager og yderligere aktivering af cytokiner og andre skadelide proteiner.[4]
Blod-hjerne-barrieren er en del af det kapillære system, som hindrer passage af T-celler ind i centralnervesystemet.[4] Denne kan dog blive gennemtrængeligt for disse celletyper, som følge af viral eller bakteriel infektion.[4] Når blod-hjerne barrieren opheles efter destruktion af den infektiøse agens vil T-cellerne være fanget inde i centralnervesystemet.[4]
Diagnose
MS kan være svært at diagnosticere, eftersom dets tegn og symptomer kan være lignende ved andre medicinske problemer.[1][30] Medicinske organisationer har lavet diagnostiske kriterier for at lette og standardisere diagnosticeringsprocessen for praktiserende læger, specielt i de første stadier af sygdommen.[1] Historisk var både Schumacher- og Poser-kriterierne populære.[31] I øjeblikket anvendes McDonald-kriterierne, der fokuserer på bevis ved hjælp af kliniske, laboratorie- og radiologiske data for udbredelsen af MS-læsioner i tid og rum.[1][32][33]
Kliniske data alene kan være tilstrækkelige for en diagnose af MS, hvis en person har været ramt af separate episoder af neurologiske symptomer, der er karakteristiske for MS.[32] Eftersom nogle søger lægehjælp efter kun et angreb, kan andre tests fremskynde og lette diagnosen. De mest almindeligt anvendte diagnostiske værktøjer er neuroradiologi, analyse af cerebrospinalvæske og evokerede potentialer. Magnetresonanstomografi af hjernen og rygrad viser områder med demyelinering (læsioner eller plak). Gadolinium kan administreres intervenøst som kontrast til at fremhæve aktiv plak og ved eliminering til at påvise eksistensen af historiske læsioner, der ikke er associerede med symptomer på tidspunktet for evalueringen.[32][34]
Testning af cerebrospinalvæsken fra en lumbalpunktur kan give dokumentation for kronisk betændelse i centralnervesystemet. Cerebrospinalvæsken er blevet testet for oligoklonale bånd, som er en betændelsesmarkør fundet i 75–85% af mennesker med MS.[32][35] Eftersom ingen kendte tests er fuldstændig specifikke i forhold til MS, kan en fuldstændig sikker diagnose kun stilles med biopsier eller obduktioner.
Nervesystemet hos en person med MS svarer ofte mindre aktivt på stimulering af synsnerven og sensornerverne grundet demyelinering af axonerne. Disse hjernereaktioner kan undersøges ved hjælp af visuelle og sensorevokerede potentialer.[36]
Klassificering

Flere typer af sygdommen, eller mere præcist mønstre for sygdommens forløb, er blevet beskrevet. Når typen skal fastlægges, benytter man sig af udviklingen hidtil med det formål at forudsige det videre forløb. Det er vigtigt at fastslå typen, ikke blot for at kunne opstille prognoser men også for at kunne beslutte, hvordan sygdommen skal håndteres. I 1996 standardiserede USA's National Multiple Sclerosis Society de fire typers definitioner:[7]
- relapserende-remitterende,
- sekundær progressiv,
- primær progressiv og
- progressiv relapserende.
Den relapserende-remitterende type er karakteriseret ved uforudsigelige attakker efterfulgt af perioder på måneder eller år, hvor sygdommen forholder sig nogenlunde rolig (remission) uden nye tegn på sygdomsaktivitet. Problemer opstået under angreb kan enten forsvinde eller efterlade følgesygdomme, hvor det sidstnævnte dog er mere almindeligt som en funktion af tid.[1] 85-90% af alle patienter med MS, har et begyndende sygdomsforløb, der kan beskrives af den relapserende-remitterende type.[7] Når problemerne altid forsvinder mellem attakker, kaldes typen nogle gange for godartet MS.[37] Den relapserende-remitterende type begynder som regel med et klinisk isoleret syndrom (CIS). I CIS har patienten angreb, der tyder på demyelinering, men opfylder ikke alle kriterierne for MS.[1][38] Dog udvikler kun 30 til 70% af personer, der oplever CIS, MS.[38]
Sekundær progressiv MS beskriver omkring 65 % af de, der indledningsvist har haft relapserende-remitterende MS, men som begynder at have progressive neurologiske problemer mellem akutte angreb uden nogen egentlig periode med remission.[1][7] Lejlighedsvise tilbagefald og mindre remissioner kan forekomme.[7] Den gennemsnitlige tid mellem sygdommens udbrud og ændring fra relapserende-remitterende til sekundær progressiv MS er 19 år.[39]
Den primære progressive type beskriver de cirka 10–15%, der aldrig oplever remission efter deres første MS-symptomer.[40] Typen er karakteriseret ved progression af handicap helt fra sygdommens udbrud med ingen eller kun lejlighedsvise remissioner og forbedringer.[7] Alderen, hvor man rammes af den primære progressive type, er højere end ved den relapserende-remitterende, men lignende gennemsnitsalderen for overgangen fra den relapserende-remitterende til den sekundære progressive type. I begge tilfælde er det omkring fyrreårsalderen.[1]
Progressiv relapserende MS beskriver de personer, der fra start oplever støt neurologisk tilbagegang, men lider af klare angreb oveni. Dette er den mindst almindelige af alle MS-typerne.[7]
Tilfælde med ikke-standardiserede forløb er også blevet beskrevet. Disse benævnes nogle gange som grænsetyper af multipel sklerose og inkluderer Devics syndrom, Balo-koncentrisk sklerose, Schilders diffuse sklerose og Marburg multipel sklerose.[41] Der er uenighed, omkring hvorvidt disse typer er atypiske varianter af MS eller andre sygdomme.[42] Multipel sklerose opfører sig også anderledes hos børn, idet det tager længere tid for dem at nå det progressive stadie.[1] Ikke desto mindre når de stadig det progressive stade ved en lavere gennemsnitsalder end voksne.[1]
Håndtering
Selvom der ikke findes nogen kur mod MS, har flere behandlinger vist sig at være hjælpsomme. Behandlingernes primære mål er at få patienten tilbage til stadiet før angrebet, forebygning mod nye angreb og undgå yderligere handicap. Som med mange medicinske behandlinger har medikamenterne brugt i håndteringen af MS flere bivirkninger. Alternative behandlinger søges af nogle patienter på trods af den manglende støtte fra forskningen.
Akutte angreb
Under symptomatiske angreb er administration af høje doser af kortikosteroider, såsom methylprednisolon,[43][44] givet intravenøst den rutinemæssige behandling. Formålet med den slags behandling er at afslutte angrebet hurtigere og efterlade færre vedvarende problemer hos patienten. Selvom kortikosteroider generelt er effektive på kort sigt til at lindre symptomer, har den form for behandling ikke vist sig at have nogen signifikant langvarig effekt.[45] Potentielle bivirkninger inkluderer osteoporose[46] og svækket hukommelse, hvor sidstnævnte dog er reversibel.[47] Alvorlige angreb, som ikke reagerer på kortikosteroider, kan behandles med plasmaferese.[48]
Sygdomsmodificerende behandlinger
Den tidligste kliniske fremkomst af relapserende-remitterende MS (RRMS) er klinisk isoleret syndrom (KIS). Flere studier har vist, at behandling med interferoner under et attak i begyndelsen af sygdomsforløbet kan nedsætte risikoen for, at en patient vil udvikle klinisk MS.[49][50][51]
Per 2007 er seks sygdomsmodificerende behandlinger blevet godkendt af kommisioner fra forskellige lande mod RRMS. Tre er interferoner: to med interferon beta-1a (varebetegnelser Avonex, CinnoVex, ReciGen og Rebif) og en med interferon beta-1b (varebetegnelse: USA, Betaseron; i Europa og Japan, Betaferon). En fjerde medicinering er glatirameracetat (Copaxone), en ikke-interferon, ikke-steroidal immunmodulator. Den femte form for medicin, mitoxantron, er en immunundertrykker, som også bruges i kemoterapi, kun godkendt i USA og overvejende mod sekundær progressiv MS. Den sjette er natalizumab (på markedet som Tysabri). Alle seks medikamenter fungerer kun moderat, hvad angår at nedsætte antallet af attakker og sinke progressionen til funktionsnedsættelse, selvom hyppigheden af deres virkekraft varierer, og studier af deres langsigtede effekter mangler stadig.[52][53][54][55] Sammenligning af immunmodulatorer (alle undtagen mitoxantron) viser, at det mest effektive er natalizumab, både hvad angår nedsættelse af hyppigheden af tilbagefald og at bremse funktionsnedsættelsens fremskriden;[56] det er også blevet påvist at reducere sygdommens intensitet.[57] Mitoxantron er måske den mest effektive af alle;[58] men betragtes dog generelt ikke som en langsigtet behandlingsform, da brugen af det begrænses af alvorlig kardiotoxitet.[59]
Interferonerne og glatirameracetat gives ved hyppige injektioner, der varierer fra en om dagen for glatirameracetat til en gang om ugen (men intramuskulært) for Avonex. Natalizumab og mitoxantron gives ved drop med månedlige intervaller.
Behandling af progressiv MS er mere vanskeligt end af relapserende-remitterende MS. Mitoxantron har vist positive resultater hos patienter med sekundær progressiv og progressiv-relapserende mønstre. Det er moderat effektivt til at reducere sygdommens progression og hyppigheden af tilbagefald hos patienterne i det korte løb.[55] Ingen behandlinger har endnu vist sig at have nogen effekt på den primære progressive MS.[60]
Som ved enhver slags behandling har disse behandlinger flere bivirkninger. En af de mest almindelige er irritation ved injektionspunktet for glatiramacetat og de intravenøse behandlinger. Over tid kan der udvikle sig en synlig bule på injektionsstedet som følge af destruktionen af fedtvæv, kendt som lipoatrofi. Interferoner kan give symptomer, der er lig influenza;[61] nogle patienter, der tager glatiramer oplever en reaktion efter injektionen med rødmen, trykken for brystet, hjertebanken, åndenød og angst, som normalt varer mindre end tredive minutter.[53] Mere farligt er leverskader fra interferoner og mitoxantron,[62][63][64][65][66] de immunosuppressive effekter og hjertetoksicitet som mitoxantron også giver anledning til;[66] samt den formodede sammenhæng mellem natalizumab og nogle tilfælde af progressiv multifokal leukoencefalopati.[67][68][69]
Alternative behandlinger
Som ved de fleste kroniske sygdomme bliver alternativ behandling efterspurgt fra nogle patienter på trods af manglende støtte fra sammenlignelig og gentagelig videnskabelig forskning. Eksempler er bestemte diæter,[70] urtemedicin, inklusiv brugen af cannabis i medicinsk øjemed til at lette symptomerne[71][72] og hyperbarisk oxygenterapi.[73] Kampsportsterapi såsom Tai Chi, afslapningsdiscipliner som yoga eller almindelig motion synes at mindske træthed, men har ingen effekt på de kognitive funktioner.[74]
Et pilotforsøg fra 2013 foretaget af fysioterapeuter og forskere viser, at konditionstræning også er mulig for patienter med svær sclerose. På den måde kan patienteres kondital forbedres, og risikoen for sygdomme kan nedsættes. Et større forsøg med flere testpersoner end de seks i pilotforsøget er under opsejling, og forventes at blive gennemført i løbet af 2015.
Prognose

Prognosen (den forventede fremtidige udvikling af sygdommen) for en person med multipel sklerose afhænger af typen af sygdommen; individets køn, alder og første symptomer; samt graden af handicap, personen oplever.[8] Sygdommen udvikler sig og tiltager i løbet af årtier, hvor 30 er det gennemsnitlige antal år fra sygdommens fremkomst til personens død.[1]
Visse karakteristika er forbundet med en bedre kurs for den sygdomsramte herunder at være kvinde, have den relapserende-remitterende type, have neuritis optica i udgangspunktet, at få få anfald i de tidlige år samt opdagelse af sygdommen tidligt.[8][75]
Den forventede levealder for personer med MS er 5 til 10 år lavere end ikkeberørte personer.[1] Næsten 40% af patienterne når at fylde 70 år.[75] Ikke desto mindre er to tredjedele af dødsfaldene hos personer med MS direkte forbundet med konsekvenserne af sygdommen.[1] Selvmord er også en langt større risikofaktor hos personer med MS end hos ikkeberørte personer, mens infektioner og komplikationer er væsentlig større risikofaktorer hos MS-patienter med store handicap.[1]
Selvom de fleste patienter mister deres evne til at gå før de dør, er 90 % stadig i stand til at gå selvstændigt 10 år efter sygdommens fremkomst og 75% efter 15 år.[75][76]
Epidemiologi

To primære mål bliver brugt i epidemiologiske studier: incidens og prævalens. Incidens er antallet af nye tilfælde per enhed af personer per tidsenhed (typisk antallet af tilfælde per tusind personer per år); mens prævalens er det totale antal af tilfælde af sygdommen i befolkningen på et givet tidspunkt.Prævalens er kendt for ikke kun at afhænge af incidens men også på overlevelsesrate og migration af berørte personer. MS har en prævalens der er mellem 2 og 150 per 100.000 afhængig af landet eller specifik befolkning.[2] Studier om befolkningsmæssige og geografiske mønstre af epidemiologiske mål har været meget almindeligt inden for MS,[19] og har ført til forslag om forskellige ætiologiske (kausal-) teorier.[5][16][17][19]
MS fremkommer typisk hos voksne i 30'erne, men det kan også vise sig allerede i barndommen.[1] Den primær progressive type er mere almindelig hos 50-årige personer.[40] Som med mange autoimmune sygdomme er sygdommen mere almindelig hos kvinder, og den trend kan være stigende.[1][77] Hos børn er kønsratioen højere,[1] mens personer over 50 bliver ramt i cirka samme grad uafhængigt af køn.[40]
Der er en nord-til-syd-gradient på den nordlige halvkugle og en syd-til-nord-gradient på den sydlige halvkugle, hvor MS er langt mindre almindeligt for personer, der bor nær ækvator.[1][77] Klima, sollys og indtag af vitamin D er blevet udforsket som mulige årsager til sygdommen, som kunne forklare denne breddegradsgradient.[17] Dog er der vigtige undtagelser fra dette nord-syd-mønster og ændringer i prævalensrater over tid;[1] faktisk kan denne trend være ved at forsvinde.[77] Det indikerer at andre faktorer så som miljø eller genetik må medtages for at forklare MS's årsager.[1] MS er også mere almindelig i regioner med nordeuropæiske befolkninger.[1] Men selv i regioner hvor MS er almindelig, har nogle etniske grupper mindre risiko for at udvikle sygdommen, hvilke inkluderer samerne, turkmenerne, oprindelige amerikanere, canadiske hutteritter, afrikanere og new zealandske maorier.[16]
Miljøfaktorer i barndommen kan også spille en vigtig rolle i udviklingen af MS senere i livet. Flere studier af migranter viser at hvis migration forekommer før man er 15, får migranten den nye regions følsomhed over for MS. Hvis migrationen forekommer efter man er fyldt 15, bibeholder migranten sin fødeegns følsomhed.[1][16] Dog kan den aldersgeografiske risiko for at udvikle MS vise sig at strække sig over en større tidsskala.[1] En sammenhæng mellem hvilken årstid, man er født i og MS, er også blevet påvist, hvilket yder støtte til den foreslåede sammenhæng med sollys og vitamin D-indtag. For eksempel er færre personer med MS født i november sammenlignet med maj.[78]
Historie
Medicinsk opdagelse

Den franske neurolog Jean-Martin Charcot (1825–1893) var den første person, der fastsatte multipel sklerose, som en særskilt sygdom i 1868.[79] Idet han opsummerede tidligere resultater og tilføjede sine egne kliniske og patologiske observationer, kaldte Charcot sygdommen for sclerose en plaques. De tre tegn for MS nu kendt som Charcots triade er nystagmus, intentionstremor og telegrafisk tale, selvom disse ikke er unikke for MS. Charcot observerede også kongnitive ændringer, hvorfor han beskrev sine patienter som havende en "markant svækkelse af hukommelsen" og "langsom opfattelse".[3]
Før Charcot havde Robert Carswell (1793–1857), en britisk professor i patologi, og Jean Cruveilhier (1791–1873), en fransk professor i patologisk anatomi, beskrevet og illustreret mange af sygdommens kliniske detaljer., men identificerede den ikke som en separat sygdom.[80] Mere specifikt beskrev Carswell de skader han havde fundet som "betydelige læsioner i rygmarven ledsaget af atrofi".[1]
Efter Charcots beskrivelse beskrev Eugène Devic (1858–1930), Jozsef Balo (1895–1979), Paul Ferdinand Schilder (1886–1940) og Otto Marburg (1874–1948) specialtilfælde af sygdommen. Sygdommen fik ikke sit nuværende navn før 1955.[1] Gennem hele det 20. århundrede fandt en vigtig udvikling sted med hensyn til teorier om MS-årsager og -patogenese, mens effektive behandlinger først begyndte at dukke op omkring år 1990.[1]
Historiske tilfælde
Der er adskillige historiske beskrivelser af mennesker, der levede kort før og efter sygdommen blev beskrevet af Charcot, der sandsynligvis havde MS.
En ung kvinde kaldet Halldora, som boede i Island omkring år 1200, mistede pludselig sit syn og sin mobilitet, men efter at have bedt til helgenerne genvandt hun sine evner syv dage efter. Sankt Lidwina af Schiedam (1380–1433), en hollandsk nonne, kan være en af de første klart identificerbare MS-patienter. Fra hun var 16 til sin død som 53-årig, led hun af intermitterende smerter, svaghed i benene og synstab—typiske MS-symptomer.[81] Begge tilfælde har ledt til forslaget om 'vikingegen'-hypotesen for videreførslen af sygdommen.[82]
Augustus Frederick d'Este (1794–1848), søn af prins Augustus Frederick, Duke of Sussex og Lady Augusta Murray og barnebarn af George 3. af Storbritannien, led næsten helt bestemt af MS. D'Este efterlod en detaljeret dagbog beskrivende hans 22 år, hvor han levede med sygdommen. Hans dagbog begyndte i 1822 og sluttede i 1846, selvom den forblev ukendt for offentligheden indtil 1948. Hans symptomer begyndte i 28-års alderen med et pludseligt forbigående synstab efter en vens begravelse. Unde hans sygdoms udviklede han svaghed i benene, klodsethed på hænderne, følelsesløshed, svimmelhed, blæreforstyrrelser og impotens. I 1844 begyndte han at bruge rullestol. På trods af sygdommen beholdte han et optimistisk livssyn.[83][84]
Et andet tidligt tilfælde af MS er optegnet af den britiske dagbogsskriver W. N. P. Barbellion, nom-de-plume fra Bruce Frederick Cummings (1889–1919), som opretholdt en detaljeret logbog over sin diagnose og kamp med MS.[84] Hans dagbog blev publiceret i 1919 som The Journal of a Disappointed Man.[85]
Forskningsretninger
Behandlinger

En række behandlinger, der måske kan begrænse anfald eller forbedre funktion er udforskes til stadighed. Nogle af disse behandlinger indebærer en kombination af medicin, der allerede bruges mod MS, såsom den samlede administrering af mitoxantron og glatirameracetat (Copaxon).[86] De fleste behandlingsmetoder, der allerede er i kliniske forsøg, involverer dog medikamenter, der bruges mod andre sygdomme. Disse er alemtuzumab (Campath),[87] daclizumab (Zenapax),[88] inosin,[89] BG00012,[90] fingolimod,[91] og teriflunomid, den aktive metabolite af DMARDen leflunomid. Alemtuzumab fungerede bedre end interferon beta-1a hvad angik at reducere funktionsnedsættelse i relapserende-remitterende MS, forestillingsabnormaliteter og hyppigheden af tilbagefald, med den bivirkning at de autoimmune problemer øgedes. Disse inkluderede tre tilfælde af idiopatisk trombocytopenisk purpura, som førte til indstillingen af denne behandling.[92]
Andre medikamenter i kliniske forsøg er designet specifikt til MS, såsom laquinimod[93] og Neurovax.[94]
Lavdosis naltrexon er blevet ordineret "off-label" mod visse autoimmune sygdomme, herunder MS, og der er anekdotisk bevis for dets nytte,[95][96] men kun to små kliniske forsøg er blevet afholdt (per december 2008),[97] en af dem for primær progressiv MS.[98]
Diagnostiske metoder
Nye diagnostik- og udviklingsevalueringsmetoder er også blevet undersøgt. Målingen af antistoffer mod myelinproteiner som myelin oligodendrocytglycoprotein og myelin basic protein kan være brugbart i diagnosen. Optisk koherenstomografi af øjets retina kan bruges som et mål for responsen til medicinering, axondegenerering og hjerneatrofi.[99][100] En prøve af serumantistoffer er blevet foreslået for at lave en mere sikker og tryg diagnose.[101]
Forudsigelse af udvikling
På nuværende tidspunkt er der ingen klinisk etablerede laboratorieundersøgelser tilgængelige, som kan forudsige prognose. Flere lovende tilgange er dog blevet foreslået, heriblandt målingen af en lipidspecifik immunoglobulin M som indikator for langsigtede udfald.[102]
Kronisk cerebrospinal venøs insufficiens
Forsker Paolo Zamboni har foretaget forskning, der tyder på, at MS ikke er en autoimmun lidelse, men en vaskulær sygdom, kronisk cerebrospinal venøs insufficiens, i hvilken hjernens vener er forsnævrede. Han teoretiserer, at dette leder til opbygningen af jern i hjernen, hvilket forårsager MS-symptomer. Han har udført et operativt indgreb for at korrigere, hvad han mener er venøs insufficiens og påstår, at nogle patienter har vist betydelig bedring.[103] Operationerne var ikke-kontrolleret og ikke-randomiseret.[104] Det neurologiske samfund har været skeptisk. Lily Jung, på vegne af American Academy of Neurology, følte, at nogle af påstandene i rapporten ikke understøttes af dataene. Desuden sagde Jung:
 | Vi ville tage vel imod nogle randomiserede, kontrollerede, dobbeltblindede undersøgelser, der belyser emnet, men før da vil vi ikke opmuntre vores patienter til at hoppe i med begge fødder for at foretage denne procedure, hvilken har betydelige risici og ikke er blevet bevist sikker.[104][105][note 1] |  |
Se også
- Multipel sklerose og spasticitet
- Probiotika
- Sundhedsvæsenets KlassifikationsSystem
- ICD-10 er er system til klassifikation af sygdomme og andre helbredsrelaterede lidelser udformet af WHO. ICD er forkortelse for International Classification of Diseases. ICD-10 er således den tiende udgave af dette system.
- Amyotrofisk lateral sklerose
- Personer med multipel sklerose
Noter
Referencer
Videre læsning
- Langgartner M, Langgartner I, Drlicek M (april 2005). "The patient's journey: multiple sclerosis". BMJ. 330 (7496): 885-8. doi:10.1136/bmj.330.7496.885. PMC 556161. PMID 15831874.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link)
Eksterne henvisninger
- Sclerose-gennembrud af danske forskere
- Scleroseforeningen i Danmark (dansk)
- Multipel sklerose på Curlie (som bygger videre på Open Directory Project) (engelsk)
- Database for analyse og sammenligning af globale data om epidemiologien af MS (engelsk)
- NIH-lister af kliniske forsøg relateret til MS (engelsk)
- Abstract index Arkiveret 29. juni 2010 hos Wayback Machine fra Cochrane Library (engelsk)
- GeneReview/NCBI/NIH/UW entry on Multiple Sclerosis Overview (engelsk)
- Danish Multiple Sclerosis Research Center Arkiveret 24. april 2008 hos Wayback Machine, dansk forskningscenter for sklerose, et af flere "European MS Centers of Excellence" – med flere henvisninger under menupunktet "Links".(engelsk)


