Kaliumdisulfat
Kaliumdisulfat oder Kaliumpyrosulfat K2S2O7 ist das Kaliumsalz der Dischwefelsäure.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
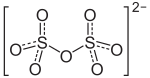 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Kaliumdisulfat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | K2S2O7 | ||||||||||||||||||
| Kurzbeschreibung | weißer, geruchloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 254,32 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||
| Dichte | 2,28 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | 419 °C[2] | ||||||||||||||||||
| Löslichkeit | löslich in Wasser[1]; reagiert unter Zersetzung | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Eigenschaften und Darstellung
Dikaliumdisulfat ist ein hygroskopischer, feuchtigkeitsempfindlicher, weißer und geruchloser Feststoff, welcher löslich in Wasser ist, wobei seine wässrige Lösung stark sauer reagiert.[1]
Es entsteht beim Erhitzen von Kaliumhydrogensulfat:[3]
.
Bei weiterem Erhitzen zerfällt das Kaliumdisulfat bei ca. 600 °C in Kaliumsulfat und Schwefeltrioxid:
.
Kaliumdisulfat reagiert als eine Lewissäure mit Wasser zu stark saurem Kaliumhydrogensulfat:[4]
.
Verwendung
Kaliumdisulfat kann bei der Veresterung von Alkanolen mit Carbonsäuren anstelle einer Säure als ein Katalysator verwendet werden. Da das Kaliumdisulfat dabei mit dem Reaktionswasser zu stark saurem Kaliumhydrogensulfat reagiert, kann sich bei diesem Verfahren kein Chemisches Gleichgewicht einstellen. Bei einem Überschuss an Kaliumdisulfat verläuft diese Reaktion deshalb quantitativ:[5]
Kaliumdisulfat kann für einen heißen, sauren Aufschluss von Salzen verwendet werden:
Das dabei gebildete Eisen(III)-sulfat ist wasserlöslich.
Toxikologie
Für die aktuelle GHS-Einstufung von Kaliumdisulfat sind keine eigenen toxikologischen Studien dokumentiert, sondern es wurden hierfür Studien, die mit Schwefelsäure durchgeführt wurden, verwendet. Die hieraus resultierende GHS-Einstufung als schwer ätzendes Gift ist strenger als die von konzentrierter Schwefelsäure[6]. Mit Wasser zersetzt sich Kaliumdisulfat spontan und quantitativ zu Kaliumhydrogensulfat. Demzufolge ist Kaliumdisulfat weniger gefährlich als Schwefelsäure und kann, wenn möglich, als ein Ersatzstoff für konzentrierte Schwefelsäure dienen[7].



