Molnupiravir
Molnupiravir (Handelsname Lagevrio) ist ein antiviraler Arzneistoff der Pharmaunternehmen Merck Sharp & Dohme (MSD) und Ridgeback Biotherapeutics zur oralen ambulanten Behandlung von milden bis mäßigen Verläufen von COVID-19. Am 24. Februar 2023 sprach sich die Europäische Arzneimittel-Agentur (EMA) dafür aus, die Zulassung von Molnupiravir in der EU zu verweigern. Sie begründete dies damit, dass ein positives Nutzen-Risiko-Verhältnis von Molnupiravir zur Behandlung von COVID-19 nicht ermittelt werden konnte. In Deutschland darf das Mittel nicht mehr abgegeben werden.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
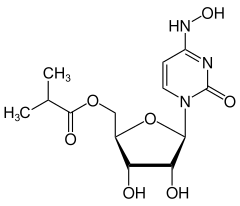 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Molnupiravir[1] | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C13H19N3O7 | |||||||||||||||||||||
| Kurzbeschreibung | weißer Feststoff[3] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | Viruzid | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 329,31 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit | leicht löslich in DMF und DMSO (jeweils 30 g·l−1 bei 20 °C)[5] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Zulassung
Europäische Union
Das von der Europäischen Arzneimittel-Agentur (EMA) im November 2021 begonnene Zulassungsverfahren[6] mündete am 24. Februar 2023 in der Empfehlung, die Zulassung des Arzneimittel durch die EU-Kommission zu verweigern. Begründet wurde dies damit, dass das Nutzen-Risiko-Verhältnis von Molnupiravir bei der Behandlung von COVID-19 nicht ermittelt werden konnte. Auf Grundlage der verfügbaren Daten sei nicht festgestellt worden, dass Molnupiravir das Risiko einer Krankenhauseinweisung oder eines Todesfalls verringern oder die Krankheitsdauer oder die Zeit bis zur Genesung verkürzen kann. Die vorläufigen Ergebnisse einer Zwischenauswertung der Zulassungsstudie MOVe-OUT[7][8] konnten gemäß EMA in der gesamten Studienpopulation und nach Auswertung weiterer Daten nicht bestätigt werden. Darüber hinaus sei es nicht möglich gewesen, eine bestimmte Gruppe von Patientinnen und Patienten in der EU zu ermitteln, bei denen ein klinisch relevanter Nutzen von Molnupiravir zu erwarten wäre.[9][10]
In Deutschland darf Lagrevio nach Mitteilung des Bundesinstituts für Arzneimittel und Medizinprodukte (BfArM) mit Wirkung vom gleichen Tag nicht länger in Verkehr gebracht werden, da durch die Beurteilung die rechtliche Grundlage dafür entfallen ist.[10] Auch bereits an den pharmazeutischen Großhandel und Apotheken ausgeliefertes Molnupiravir darf nicht weiter abgegeben werden.[10]
Bis zur neuen Begutachtung vom Februar 2023 hatte die EMA den Einsatz von Molnupiravir bei Notfällen, das heißt bei nicht beatmungspflichtigen COVID-19-Patienten, die ein erhöhtes Risiko hatten, schwer zu erkranken, unterstützt. Ein dazu von der Agentur im November 2021 erstelltes Gutachten konnte zur Unterstützung von Genehmigungen durch nationale Behörden für die frühzeitige Verwendung des Arzneimittels noch vor der Marktzulassung herangezogen werden.[11][12] In Deutschland war vom 3. Januar 2022 bis zum 24. Februar 2023 die Verordnung und Abgabe von Molnupiravir möglich. Aufgrund einer vom Bundesministerium für Gesundheit erlassenen Allgemeinverfügung konnte die Bundesregierung das Mittel vorübergehend auch ohne Marktzulassung im Geltungsbereich des Arzneimittelgesetzes legal beschaffen und in Verkehr bringen.[13] Zuvor hatte schon im Dezember 2021 in Dänemark die Gesundheitsbehörde ebenfalls die Anwendung des nicht marktzugelassenen Mittels genehmigt.[14][15]
Im Juni 2023 zog Merck Sharp & Dohme den Zulassungsantrag zurück.[16]
Großbritannien
Am 4. November 2021 ließ die britische Arzneimittelbehörde MHRA Molnupiravir zur Behandlung von leichtem bis moderaten COVID-19 bei Personen mit Risikofaktoren wie Diabetes mellitus, Adipositas oder Lungen- und Herzkrankheiten sowie bei älteren Personen ab 60 Jahren unter dem Namen Lagevrio bedingt zu.[17][18]
USA, Japan
In den USA erteilte die FDA am 22. Dezember 2021 eine Notfallzulassung.[19] Zuvor hatte sich das zuständige Prüfgremium der FDA mit einer knappen Mehrheit von 13 zu 10 dafür ausgesprochen. Insbesondere potentielle Nebenwirkungen und mögliche Fluchtmutationen wurden kritisiert.[20] Auch in Japan wurde Molnupiravir im Dezember 2021 für den Notfallgebrauch zugelassen.[21]
China
Aufgrund der massiven Corona-Welle in China genehmigten die dort zuständigen Behörden im Dezember 2022 den Einsatz von Molnupiravir des US-amerikanischen Herstellers MSD für die Behandlung von Infizierten mit Risiko für einen schweren Verlauf.[22]
Wirkung
Molnupiravir ist ein Prodrug, ein inaktiver oder wenig aktiver pharmakologischer Stoff, der erst durch Verstoffwechselung (Metabolisierung) im Organismus zu einem aktiven Wirkstoff (Metaboliten) wird. Durch Hydrolyse entsteht das synthetische Nukleosid-Analogon N4-Hydroxycytidin (NHC), das antiviral durch Einführung von Kopierfehlern bei der viralen RNA-Replikation durch virale RNA-Polymerase wirkt. In mehreren Studien wurde diese Wirkung gegen Coronaviren wie SARS-CoV, MERS-CoV und SARS-CoV-2 belegt. Ursprünglich wurde Molnupiravir im Rahmen der Arzneimittelforschung an der Emory University in Atlanta (Georgia, USA) zur Behandlung der Grippe (Influenza) untersucht.[23]

NHC ähnelt dem Nukleosid Cytidin, von dem es sich durch eine zusätzliche OH-Gruppe unterscheidet.[24] NHC existiert in zwei als Tautomere bezeichneten Formen, die sich durch eine Bindungsverschiebung und Protonenwanderung ineinander umwandeln. Dadurch kann NHC sowohl mit Guanosin als auch mit Adenosin Basenpaare bilden und erzeugt so Mutationen im Erbgut. Wirkt NHC wie Cytidin, akzeptiert die Gen-Fehlerkorrektur des Virus dies. Jedoch lassen sich die Bindungen in NHC so verschieben, dass es Uridin imitiert und ein Basenpaar mit Adenosin bildet. Wird Virus-RNA vervielfältigt, wird durch die teilweise „falschen“ Basenpaarungen das Erbgut völlig verändert. Eine fehlerfreie Viren-Vermehrung damit unwahrscheinlicher, es treten zu viele Mutationen auf.
Durch diese Mutationen besteht jedoch auch die Gefahr, dass es zu einer Fluchtmutation (Escape Variante) kommt, gegen die etwa auch die verfügbaren Impfstoffe nicht mehr wirken. „Das wäre katastrophal für die ganze Welt“, mahnte der amerikanische Immunologe James Hildreth, CEO des Meharry Medical College.[20]
Molnupiravir ähnelt strukturell anderen Nukleosidanaloga wie z. B. Remdesivir[23], führt aber anders als Remdesivir nicht zu einem Kettenabbruch bei der DNA-Synthese, der Wirkmechanismus ist wie oben beschrieben ein vollkommen anderer.
Da Molnupiravir bereits in Tierversuchen Schäden an Ungeborenen hervorgerufen hatte,[20] ist sein Einsatz bei Schwangeren und gebärfähigen Frauen nicht empfohlen[25] bzw. kontraindiziert;[26] gebärfähige Frauen müssen eine zuverlässige Verhütungsmethode anwenden.[25]
Klinische Prüfungen
Hospitalisierte Patienten
Am 19. Oktober 2020 begann MSD die multinationale Phase-II/III-Studie MOVe-IN zum Vergleich von Molnupiravir gegenüber Placebo bei hospitalisierten COVID-19-Patienten.[27] Die Ergebnisse der Studie zeigten keinen Nutzen von Molnupiravir im Sinne eines Verringerung der Mortalität oder der Zeit bis zur Entlassung aus dem Krankenhaus.[28]
Nicht-hospitalisierte Patienten
Die ebenfalls am 19. Oktober 2020 von MSD begonnene multinationale Phase-II/III-Studie MOVe-OUT verglich Molnupiravir gegenüber Placebo bei nicht-hospitalisierten COVID-19-Patienten.[7] Veröffentlichte Daten einer Zwischenanalyse dieser Studie deuteten zunächst darauf hin, dass Molnupiravir das Risiko einer Krankenhauseinweisung oder eines Todesfalls um etwa 50 Prozent im Vergleich zu Placebo bei Patienten mit leichter oder mittelschwerer COVID-19 reduziert.[8] Weitere Daten, welche Ende November 2021 veröffentlicht wurden, konnten nur noch eine Risikosenkung um etwa 30 Prozent im Vergleich zur Placebo-Gruppe zeigen.[29] Gemäß EMA konnten die zunächst positiven Ergebnisse der Studie in der gesamten Studienpopulation und nach Auswertung weiterer Daten nicht bestätigt werden. Auf Grundlage der verfügbaren Daten sei nicht festgestellt worden, dass Molnupiravir das Risiko einer Krankenhauseinweisung oder eines Todesfalls verringern oder die Krankheitsdauer oder die Zeit bis zur Genesung verkürzen kann.[9][10]
Synthese
Ein möglicher Weg zur Herstellung von Molnupiravir verläuft über eine fünfschrittige Synthese aus Uridin und zeigt eine Ausbeute von nur 17 %. Durch Derivatisierungen und Schutzmaßnahmen verlängert sich zudem die Anzahl an Schritten der Synthese. Außerdem ist Uridin eine sehr teure Substanz.[30]

Deshalb wurde eine alternative Synthese aus Cytidin gefunden, die die Kosten deutlich senken kann. Außerdem kann die Synthese auf einen zweistufigen Prozess reduziert werden, der aus einer Veresterung und einer Transaminierung besteht. Mit 75 % Ausbeute wird Molnupiravir erhalten, wenn zuerst eine Veresterung durchgeführt wird. Alternativ kann erst eine Hydroxiaminierung und dann eine Veresterung durchgeführt werden. Dabei wird eine Ausbeute von nur 37 % über beide Schritte erhalten. Für die Veresterung wird dabei Isobuttersäureoximester sowie Novoenzym 435 als Katalysator und 1,4-Dioxan als Lösungsmittel verwendet. Für die Transaminierung wird NH2OH-H2SO4 in Isopropanol verwendet, wodurch eine Dihydroxiaminierung vollständig vermieden werden kann.[30]