Hidrogenare
Hidrogenarea este o reacție chimică prin care un compus chimic sau un element chimic reacționează cu hidrogenul molecular (H2), de obicei în prezența unui catalizator metalic de nichel, paladiu sau platină. Hidrogenarea poate fi ori reducere (ca parte a unei reacții redox), ori reacție de hidrogenarea a unor compuși organici nesaturați, prin care aceștia devin saturați.
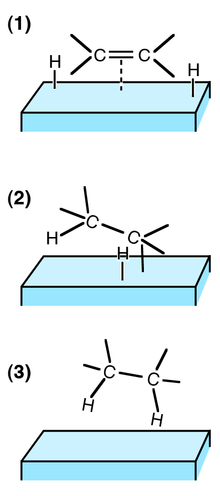
(1) Reactanții adsorb la suprafața catalizatorului și H2 disociază.
(2) Un atom de H se leagă de un atom de C. Celălalt atom de C este încă atașat de suprafață.
(3) Al doilea atom de C se leagă de un atom de H. Molecula părăsește suprafața.
De cele mai multe ori, hidrogenarea presupune adiția unor perechi de atomi de hidrogen la o moleculă, caz în putem avea compuși nesaturați (alchene, alchine, etc.). Catalizatorii sunt importanți pentru desfășurarea reacției, iar hidrogenarea necatalitică nu are loc decât la temperaturi ridicate.[1]
Procedee
Aspecte termodinamice și cinetice
Adiția de hidrogen la o legătură dublă sau triplă a unei hidrocarburi este un tip de reacție redox care poate fi favorizată termodinamic. De exemplu, adiția de hidrogen la o alchenă are o variație a energiei libere Gibbs de -101 kJ·mol−1.[2] Totuși, rata de desfășurare a reacției pentru majoritatea hidrogenărilor este neglijabilă în absența catalizatorilor. Hidrogenarea este o reacție puternic exotermă. De exemplu, energia eliminată prin hidrogenarea uleiurilor vegetale și a acizilor grași este de aproximativ 25 kcal per mol (105 kJ/mol). Mecanismul de reacție pentru hidrogenarea cu catalizator metalic a alchenelor și alchinelor a fost studiată pe larg.[3] Avem următoarea ecuație generală:
- RCH=CH2 + D2 → RCHDCH2D
Hidrogenarea catalizată poate fi de două tipuri:
- Cataliză omogenă
- Cataliză heterogenă
Hidrogenarea anorganică
Un exemplu cunoscut este hidrogenarea azotului cu obținerea de amoniac, care poate fi realizată la scară largă prin procedeul Haber-Bosch.
