Graphit
Graphit ist ein sehr häufig vorkommendes Mineral aus der Mineralklasse der „Elemente“. Er ist eine der natürlichen Erscheinungsformen des chemischen Elements Kohlenstoff in Reinform und kristallisiert äußerlich gesehen im hexagonalen Kristallsystem (Genaueres siehe unter Kristallstruktur).
| Graphit | |
|---|---|
 | |
| Allgemeines und Klassifikation | |
| IMA-Symbol | Gr[1] |
| Andere Namen | |
| Chemische Formel | C |
| Mineralklasse (und ggf. Abteilung) | Elemente – Halbmetalle (Metalloide) und Nichtmetalle |
| System-Nummer nach Strunz (8. Aufl.) Lapis-Systematik (nach Strunz und Weiß) Strunz (9. Aufl.) Dana | I/B.02a I/B.02-010 1.CB.05a 01.03.06.02 |
| Ähnliche Minerale | Molybdänit (Molybdänglanz) |
| Kristallographische Daten | |
| Kristallsystem | hexagonal |
| Kristallklasse; Symbol | dihexagonal-dipyramidal; 6/m2/m2/m |
| Raumgruppe | P63/mmc (Nr. 194)[4] |
| Gitterparameter | a = 2,46 Å; c = 6,71 Å[4] |
| Häufige Kristallflächen | {001} |
| Physikalische Eigenschaften | |
| Mohshärte | 1 bis 2 |
| Dichte (g/cm3) | 2,1 bis 2,3, beim idealen Einkristall 2,26[5] |
| Spaltbarkeit | vollkommen, Schichtabstand 3,35 Å beim idealen Einkristall[5] |
| Bruch; Tenazität | uneben, biegsam |
| Farbe | grau bis schwarz |
| Strichfarbe | grauschwarz |
| Transparenz | undurchsichtig |
| Glanz | Metallglanz, matt |
| Magnetismus | diamagnetisch |
| Kristalloptik | |
| Brechungsindex | n = 1,93 bis 2,07 (rot) |
| Optischer Charakter | einachsig negativ |
| Pleochroismus | stark rot |
| Weitere Eigenschaften | |
| Chemisches Verhalten | unlöslich in nicht-oxidierenden Säuren |
| Besondere Merkmale | hohe Anisotropie (z. B. Härte, Leitfähigkeit) |
Graphit bildet undurchsichtige, graue bis schwarze Kristalle in sechseckiger, tafeliger, schuppiger oder stängeliger Form, die auf den Kristallflächen Metallglanz aufweisen. Massige oder körnige Aggregate sind dagegen matt. Seine Mohshärte beträgt zwischen 1 und 2, seine Dichte etwa 2,1 bis 2,3 g/cm³, und er hat eine grauschwarze Strichfarbe.
Etymologie und Geschichte
Der Name Graphit leitet sich aus dem altgriechischen γράφειν (graphein) ab, was schreiben bedeutet.[6] Er spielt damit auf die Tatsache an, dass Graphit auf Papier oder anderen rauen Oberflächen durch Abreibung der einzelnen Blättchen leicht eine graue Ablagerung hinterlässt, die im Bleistift ihre Anwendung findet. Abraham Gottlob Werner[7] prägte 1789 den Namen, der sich dann international in der mineralogischen Fachwelt durchsetzte und auch von der International Mineralogical Association (IMA) übernommen wurde.[8]
Im Duden wird nach neuer deutscher Rechtschreibung die Schreibweise Grafit als empfohlene Schreibweise angegeben.[9] Gemäß der Empfehlung vom Rat für deutsche Rechtschreibung sind die Schreibweisen Graphit und Grafit allerdings gleichwertig.[3] Fachlich korrekt für den Mineralnamen ist jedoch nach wie vor die Schreibweise Graphit.[8][10]
Die Verwendung von Graphit kann in Europa auf eine lange Tradition seit der prähistorischen Zeit zurückblicken. Die ersten Hinweise einer Verwendung kennt man aus dem Mesolithikum Norditaliens. Rohgraphitstücke wurden als Färbemittel benutzt und den Toten in die Gräber mitgegeben. Für das Neolithikum finden sich in Böhmen zahlreiche Belege von Graphitton- und graphitierter Keramik. In Bayern fällt in der Frühbronzezeit vor allem die Straubinger Kultur durch starken Graphitgebrauch auf.
In der späten Eisenzeit in Mitteleuropa (Latènezeit) wurde Graphit gerne verwendet, um Gefäße, vor allem Kochtöpfe, feuerfester zu machen. Es fand während dieser Zeit ein großflächiger Handel statt, der die gesamte Verbreitung der Latène-Kultur umfasste. Hier waren besonders die Vorkommen bei Passau und Český Krumlov (ehemals Krummau) bedeutsam. Nach dem Zusammenbruch der keltischen Kultur in Mitteleuropa im Zuge der römischen Eroberung und der germanischen Expansion dauert es etwa 800 Jahre bis ins frühe Mittelalter, bis im slawischen Ostmitteleuropa wieder im größeren Stil Graphit verwendet wurde. In Asien (vor allem dem schon frühzeitig schriftkundigen China) hat Graphit als Schreibmaterial erstaunlicherweise keine Rolle gespielt.
Im 16. Jahrhundert entdeckten die Engländer ein großes Vorkommen an reinem Graphit, welches sie jedoch für eine Form des Bleiminerals Bleiglanz hielten und Plumbago nannten. Erst Carl Wilhelm Scheele gelang 1779 der Nachweis, dass es sich bei Graphit um reinen Kohlenstoff handelt. Trotz Scheeles Nachweis hält sich der Begriff „Bleistift“ bis heute (früher auch Reißblei oder Wasserblei genannt). Da sich Graphit nicht nur als gutes Schreibmaterial, sondern auch als perfektes Material für Gussformen von Kanonenkugeln herausstellte, hatte er auch eine gewisse militärische Bedeutung. So wurde deshalb z. B. während der napoleonischen Kriege Anfang des 19. Jahrhunderts die Ausfuhr von Bleistiften von Großbritannien nach Frankreich verboten.[11]
Im 20. Jahrhundert hat Graphit in der Kernphysik einige Bedeutung erlangt, da es ein hervorragender Neutronenmoderator ist. Im Rahmen sowohl des Manhattan Projects als auch des deutschen Uranvereins wurde die Frage diskutiert, ob ein Natururanreaktor mit Graphit Kritikalität erreichen kann. Im Dezember 1942 gelang es in den USA einem Team um Enrico Fermi im Chicago Pile 1, eine sich selbst aufrecht erhaltende Kettenreaktion in einem graphitmoderierten Natururanreaktor zu erzeugen.[12] Später wurde das für die Atombomben im Trinity-Test und für „Fat Man“ benötigte Plutonium in weiteren graphitmoderierten Kernreaktoren hergestellt.[13] Da entsprechend hochreines Graphit zur Erzeugung von Plutonium genutzt werden kann, steht es inzwischen unter entsprechenden Ausfuhrkontrollen, ähnlich wie dies für schweres Wasser der Fall ist.
Klassifikation
Bereits in der veralteten 8. Auflage der Mineralsystematik nach Strunz gehörte der Graphit zur Mineralklasse der „Elemente“ und dort zur Abteilung der „Halbmetalle und Nichtmetalle“, wo er als einziges Mitglied die Gruppe I/B.02a bildete.
Im zuletzt 2018 überarbeiteten und aktualisierten Lapis-Mineralienverzeichnis nach Stefan Weiß, das sich aus Rücksicht auf private Sammler und institutionelle Sammlungen noch nach dieser klassischen Systematik von Karl Hugo Strunz richtet, erhielt das Mineral die System- und Mineral-Nr. I/B.02-10. In der „Lapis-Systematik“ entspricht dies ebenfalls der Abteilung „Halbmetalle und Nichtmetalle“, wo Graphit zusammen mit Chaoit, Diamant, Fullerit (Mineralstatus bisher zweifelhaft), Lonsdaleit und Moissanit eine eigenständige, aber unbenannte Gruppe bildet.[10]
Auch die von der IMA zuletzt 2009 aktualisierte[14] 9. Auflage der Strunz’schen Mineralsystematik ordnet den Graphit in die Abteilung der „Halbmetalle (Metalloide) und Nichtmetalle“ ein. Diese ist allerdings weiter unterteilt nach den Hauptelementen der eingruppierten Minerale, so dass Graphit entsprechend in der Unterabteilung „Kohlenstoff-Silicium-Familie“ zu finden ist, wo es als einziges Mitglied die unbenannte Gruppe 1.CB.05a bildet.
Die vorwiegend im englischen Sprachraum gebräuchliche Systematik der Minerale nach Dana ordnet den Graphit ebenfalls in die Klasse und dort in die gleichnamige Abteilung der „Elemente“ ein. Hier ist er zusammen mit Diamant, Lonsdaleit, Chaoit und Fullerit in der Gruppe der „Kohlenstoffpolymorphe“ mit der System-Nr. 01.03.06 innerhalb der Unterabteilung „Elemente: Halbmetalle und Nichtmetalle“ zu finden.
Kristallstruktur
Graphit kommt in zwei polytypen Kristallstrukturen vor, die als Graphit-2H und als Graphit-3R bezeichnet werden.
Graphit-2H ist dabei in hexagonaler Symmetrie in der Raumgruppe P63/mmc (Raumgruppen-Nr. 194) orientiert mit den Gitterparametern a = 2,46 Å und c = 6,71 Å sowie 4 Formeleinheiten pro Elementarzelle.[4]
Bei Graphit-3R ist die Schichtung dagegen trigonal orientiert mit den Gitterparametern a = 2,46 Å und c = 10,06 Å sowie 6 Formeleinheiten pro Elementarzelle.[4]
Die kristallinen, ebenen Schichten verlaufen parallel und liegen als sogenannte „Basalebenen“ oder „Graphen-Schichten“. Eine Schicht besteht aus kovalent verknüpften Sechsecken, deren Kohlenstoff-Atome sp2-hybridisiert sind. Innerhalb dieser Ebenen beträgt die Bindungsenergie zwischen den Kohlenstoff-Atomen 4,3 Elektronenvolt, zwischen den Ebenen dagegen lediglich 0,07 Elektronenvolt. Aus dieser extremen Richtungsabhängigkeit der Bindungskräfte resultiert eine deutliche Anisotropie der mechanischen, elektrischen und thermischen Eigenschaften des Graphits:
- leichte Spaltbarkeit des reinen Graphits entlang der Basalebenen, deutlich höhere Festigkeit entlang der Kristallschichten;
- thermische und elektrische Isolation orthogonal zu den Basalebenen gegenüber einer fast metallischen Leitfähigkeit entlang der Ebenen.
Die Leitfähigkeit innerhalb einer Ebene wird durch die Delokalisation der π-Elektronen ermöglicht.
Die bekannten Schmiermitteleigenschaften von Graphit sind jedoch nicht nur strukturbedingt, denn sie treten nur in Gegenwart von Feuchtigkeitsspuren auf.[15]
Weisen die Ebenen keine feste Korrelation zueinander auf, spricht man von turbostratischem Kohlenstoff.
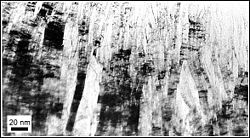
Die durchstrahlungs-elektronenmikroskopische (TEM-)Aufnahme zeigt Basalebenenstapel in Graphit. Die Überlagerung verkippter Stapel erzeugt Moiré-Streifen; die Basalebenenabstände von 3,35 Å (0,335 nm) werden hier nicht aufgelöst.[16]
Im sogenannten Glaskohlenstoff liegen die Ebenen dagegen nicht planparallel wie die Seiten eines Buches, sondern wie geknülltes Papier. Dieser Kohlenstoff ist hart und isotrop wie Glas, daher sein Name. Durch besondere Behandlung (Streckung von Kunststofffasern und anschließendes Graphitieren) gelingt es, die Ebenen in Faserrichtung zu orientieren. Das Ergebnis sind hochfeste Kohlenstofffasern.
Fullerene und Nanoröhren besitzen nur eine Basalebene, die im ersten Fall zu einer Kugel, im zweiten Fall zu Röhren gekrümmt sind. Auch hier sind die Übergänge zum Graphit fließend. Weitere Schichten können sich zwiebelartig anlagern und rußartiges Pulver bilden.
- Hexagonale Kristallstruktur des Graphit. Die rot markierten „β“-Kohlenstoffatome (ohne Nachbaratom in der darunterliegenden Schicht) werden in der nebenstehenden Aufnahme abgebildet.
- Rastertunnelmikroskopische Aufnahme einer Graphitoberfläche. Hell zu sehen sind diejenigen Oberflächenatome (rot markiert im nebenstehenden Bild), die kein unmittelbares Nachbaratom in der nächstunteren Schicht besitzen (mit gestrichelten Linien verbundene Atompositionen), da hier die elektronische Zustandsdichte höher ist. Ein unteres C-Atom ändert die elektronische Struktur des darüberliegenden Atoms.
- Elektronenmikroskopische Aufnahme von Graphit-Basalebenenstapel im Querschnitt.
Eigenschaften
Chemische Eigenschaften
- Bei etwa 600 °C und Anwesenheit von Sauerstoff entzündet sich Graphit.[17]
- Bei einer Temperatur von über 2500 °C (in einer sauerstofffreien Umgebung) wird Graphit plastisch verformbar.[18]
- Bei einer Temperatur von 3750 °C (in einer sauerstofffreien Umgebung) sublimiert Graphit.[18]
Graphit ist beständig gegen nichtoxidierende Säuren und ist diamagnetisch. Auffällig ist das stark anisotrope Verhalten von Graphit, insbesondere hinsichtlich Härte und elektrischer Leitfähigkeit.
Magnetische Suszeptibilität
Graphit hat eine negative magnetische Suszeptibilität und ist daher diamagnetisch. Der Betrag der Suszeptibilität und damit das Ausmaß an Diamagnetismus von Graphit hängt von der Qualität des Graphits und seiner Orientierung im Magnetfeld ab.
Bei Ausrichtung senkrecht zu den Atomlagen liegt sie bei 



Graphit ist damit bei senkrechter Ausrichtung das am stärksten diamagnetische Element. Es ist aber immer noch rund 2000 Mal schwächer als ideale Diamagneten – wie z. B. Supraleiter – mit einer magnetischen Suszeptibilität von 
Modifikationen und Varietäten
Vom Element Kohlenstoff sind vier Modifikation bekannt, die als natürliche Bildungen (ohne menschlichen Einfluss) nachgewiesen werden konnten und daher als eigenständige Mineralart anerkannt sind. Neben dem in den zwei polytypen Schichtstrukturen Graphit-2H (hexagonal) und Graphit-3R (trigonal) vorkommenden Graphit sind dies noch
- Diamant, in kubischer Symmetrie
- Chaoit, in hexagonaler Symmetrie, jedoch mit vom Graphit-2H abweichender Raumgruppe und anderen Gitterparametern
- Lonsdaleit, mit ebenfalls hexagonaler Symmetrie und gleicher Raumgruppe wie Graphit-2H, jedoch mit anderen Gitterparametern.
Bildung und Fundorte

Natürlicher Graphit entsteht durch eine Kombination aus Diagenese und Metamorphose (Kontakt- und Regionalmetamorphose) und durchläuft dabei die Prozesse der Inkohlung. Bedingungen dafür sind organischer Kohlenstoff und hohe Temperaturen und Drücke über Zeiträume von Jahrmillionen.[21]
Das Ausgangsmaterial des Graphits sind kohlenstoffhaltige Sedimente (z. B. Pflanzen- oder Faulschlammasse), deren Kohlenstoffgehalt durch Inkohlung auf bis zu 90 % angereichert wird. Die Anreicherungsprozesse können unter relativ niedrigen Drücken und Temperaturen ablaufen (Diagenese). Für die endgültige Entstehung von Graphit bedarf es aber hoher Temperaturen und Drücke, um den amorphen Kohlenstoff in kristallinen Kohlenstoff umzuwandeln. Solche Bedingungen können ausschließlich durch metamorphe oder magmatische Prozesse erreicht werden und müssen anoxisch ablaufen, da Kohlenstoff bei erhöhten Temperaturen ansonsten Verbindungen mit Sauerstoff eingeht und als Kohlenstoffmonoxid oder Kohlenstoffdioxid entweicht.[21]
Graphit kommt daher bevorzugt in metamorphen Gesteinen vor, die in plattentektonischen Kollisionsgebieten während der Gebirgsbildung aus sedimentären Ausgangsgesteinen entstanden sind.[21] Durch Regionalmetamorphose gebildete Graphitvorkommen befinden sich linsen- oder nestartig abgetrennt im Umgebungsgestein, durch Kontaktmetamorphose gebildetes Graphit kann auch in Pegmatiten sowie in Kalk- und Sandsteinen vorkommen.[22] Weiterhin kann Graphit Bestandteil von Meteoriten sein.
Nach der Entstehung wird Graphit in drei Arten eingeteilt:
- Der Flockengraphit (flake graphite) ist die häufigste Graphitvariante, er besteht aus Plättchen und kommt in metamorphen Gesteinen, wie z. B. Marmor, Gneis oder Schiefern vor.
- Der amorphe Graphit (amorphous graphite) ist ein sehr feinkörniger Graphit, der in Kohleflözen, Tonsteinen und Schiefern vorkommt.
- Der Ganggraphit (vein graphite) ist der seltenste Graphit, er bildet sich in Pegmatigängen und Spalten, in denen bei bereits relativ niedrigen Temperaturen von etwa 500–600 °C verschiedene Minerale kristallisieren. Seine Entstehung ist noch umstritten, jedoch gilt die Lösung von kohlenwasserstoffhaltigem Material in wässrigen Fluiden mit anschließender Auskristallisation für am wahrscheinlichsten.[21]
Es existieren zahlreiche Graphitfundorte weltweit.[23] Von wirtschaftlicher Bedeutung sind aber vor allem die Volksrepublik China, Korea, Madagaskar, Simbabwe, Brasilien und Indien sowohl im Tagebau als auch unter Tage. Im Jahr 2021 wurden rund 1,17 Millionen Tonnen gefördert.[24]
In Europa gibt es zurzeit nur noch wenige aktive Graphitbergwerke. In der Ukraine, in Norwegen und in Tschechien wird makrokristalliner Graphit in unterschiedlicher Qualität unter Tage abgebaut. Beim makrokristallinen Graphit sind die einzelnen Graphitkristallitpakete (Flocken) gut erhalten und sichtbar. In Österreich wurden dagegen mikrokristalline Graphite gewonnen, deren Kristalle nicht so deutlich ausgeprägt sind.
Österreich nahm in den 1960er-Jahren den nach Südkorea zweiten Platz unter den graphitfördernden Ländern ein (Höchststand 1964 mit etwa 100.000 Tonnen Förderung). Der größte Bergbau befand sich in Kaisersberg bei Sankt Stefan ob Leoben in der Steiermark. Er wurde 1997 stillgelegt; seit Frühjahr 2008 wird im dortigen „Marie-Stollen“ wieder gearbeitet. Bis 1991 bestand in Sunk bei Trieben im Paltental (Steiermark) ein Bergbau, in dem Graphit mit einem sehr hohen Kohlenstoffanteil von zum Teil über 85 % gewonnen wurde. Weitere kleine Graphitbergbaue bestanden bis in die 1970er-Jahre am Semmering, im Liesingtal (Steiermark), im Dunkelsteiner Wald (Niederösterreich) sowie im Waldviertel, wo das seit 1831 in Abbau stehende Vorkommen in Mühldorf[25] am bedeutendsten war. Aktuell (2022) ist der Untertagebergbau in Sankt Stefan ob Leoben der einzige aktive Graphitbergbau in den Alpen[26], wobei die dort abgebaute Menge je nach Quelle mit 100 t[27] und einmal mit 500 t[28] für das Jahr 2020 angegeben wird.
In Deutschland war und ist der Graphit-Bergbau von Kropfmühl im Landkreis Passau bedeutsam. Am 21. Juni 2012 wurde das dortige Graphitbergwerk offiziell wiedereröffnet, denn der Abbau wurde, laut einer Pressemitteilung des Unternehmens, aufgrund der steigenden Nachfrage nach Graphit und der Preisentwicklung am Weltmarkt wieder rentabel.[29] Die in Deutschland abgebauten Mengen betrugen 2020 je nach Quelle 108 t[27] bis 300 t[28].
Die weltweit größte Graphitmine befand sich 2022 in Mosambik und soll 50 Jahre lang betrieben werden.[28] Weltweit verteilten sich die Fördermengen wie folgt:[24]
| Land | 2017 | 2018 | 2019 | 2020 | 2021 |
|---|---|---|---|---|---|
| (in Tonnen) | |||||
 Österreich Österreich | 150 | 150 | 100 | 100 | 100 |
 Brasilien Brasilien | 95.000 | 78.981 | 81.770 | 67.020 | 78.555 |
 Deutschland Deutschland | 422 | 222 | 207 | 108 | 181 |
 Volksrepublik China Volksrepublik China | 625.000 | 630.000 | 700.000 | 665.000 | 735.000 |
 Indien Indien | 33.649 | 39.030 | 34.674 | 35.386 | 57.264 |
 Kanada Kanada | 14.000 | 11.000 | 11.045 | 7.620 | 7.700 |
 Kolumbien Kolumbien | 0 | 135 | 0 | 0 | |
 Madagaskar Madagaskar | 13.300 | 52.951 | 45.106 | 61.405 | 88.110 |
 Mexiko Mexiko | 10.310 | 4.130 | 2.342 | 2.033 | 1.778 |
 Mosambik Mosambik | 802 | 104.000 | 153.000 | 18.1591 | 77.116 |
 Namibia Namibia | 2.216 | 3.456 | 0 | 0 | 0 |
 Nordkorea Nordkorea | 50.000 | 45.000 | 45.000 | 45.000 | 30.000 |
 Norwegen Norwegen | 9.600 | 10.000 | 9.780 | 5.549 | 6.293 |
 Russland Russland | 19.500 | 11.900 | 17.500 | 12.900 | 17.300 |
 Sri Lanka Sri Lanka | 3.800 | 3.800 | 3.100 | 2.500 | 3.200 |
 Südkorea Südkorea | 0 | 670 | 302 | 3.052 | 18.297 |
 Türkei Türkei | 4.000 | 16.752 | 9.990 | 15.205 | 28.336 |
 Ukraine Ukraine | 13.000 | 15.000 | 10.000 | 10.000 | 17.000 |
 Vietnam Vietnam | 0 | 1.500 | 3.500 | 3.700 | 1.200 |
 Simbabwe Simbabwe | 1.577 | 0 | 0 | 0 | 0 |
| Gesamt | 896.326 | 1.028.542 | 1.127.551 | 954.737 | 1.167.430 |
Synthetische Herstellung
Durch Verkoken kohlenstoffhaltiger Materialien entstehen graphitierbare Kohlenstoffe. Ausgangssubstanzen sind zum Beispiel Braunkohle, Steinkohle, Erdöl und Peche, aber auch Kunststoffe. Bei der Graphitierung erfolgt durch Erhitzen unter Luftabschluss auf etwa 3000 °C eine Umwandlung vom amorphen Kohlenstoff zum polykristallinen Graphit.
Künstlich hergestellter Graphit ist auch als Acheson-Graphit bekannt. Bedeutende Hersteller sind unter anderem Showa Denko Carbon, SGL Carbon, Schunk Kohlenstofftechnik (Deutschland), Imerys (Schweiz), Tōkai Carbon (Japan), Morgan Advanced Materials (Großbritannien) und Tōyō Tanso (Japan).
Highly ordered pyrolytic graphite (HOPG) ist eine sehr reine Form von Graphit.
Recycling
Auch bei Graphit spielt Recycling eine wichtige Rolle, recycelter Graphit von Gussformen, Ofenauskleidungen und Graphitelektroden wird vor allem für Bremsbeläge und thermische Isolierungen verwendet. Das Recyclingpotential ist noch ausbaufähig, wird derzeit aber auf Grund reichlich vorhandener weltweiter Graphitmengen nicht ausgeschöpft.[28]
Verwendung
Graphitelektroden
2011 wurden 42 % aller synthetischen Graphite zu Elektroden verarbeitet. So werden für die Herstellung einer Tonne Elektrostahl im Durchschnitt 2–2,5 kg Graphit verbraucht.[31]
- Elektrode im Lichtbogenofen (zur Elektrostahlgewinnung)
- Elektrode in Kohlebogenlampen
- Kohlebürste in elektrischen Motoren
- negative Elektrode von Lithium-Ionen-Zellen
- positive Elektrode von Zink-Kohle-Primärzellen
- Elektrode beim Senkerodieren
- Schleifleisten auf dem Stromabnehmer von Schienenfahrzeugen
- Raderdungskontakte auf Schienenfahrzeugen
Nukleargraphit
Graphit wurde und wird in hochgereinigter Form in manchen Kernreaktor-Typen als Moderator eingesetzt. In den deutschen, inzwischen stillgelegten „Kugelhaufenreaktoren“ Versuchsreaktor Jülich und THTR-300 diente Graphit zugleich als Moderator und Brennelementmatrix. Die guten Moderationseigenschaften und die hohe Temperaturstabilität waren für den Einsatz in der Nukleartechnik ausschlaggebend.
Die Graphitbrände des britischen Windscale-Reaktors 1957 in Sellafield sowie des RBMK-Reaktors in Tschernobyl 1986 führten jedoch zu Bedenken wegen der Sicherheit von Graphit in Reaktoren. Als Probleme kommen die Reaktionsfähigkeit mit Wasserdampf (> 900 °C) unter Bildung brennbarer Gase und die Neigung zu energetischen Instabilitäten (siehe Wigner-Energie) hinzu.
2006 gab es weltweit 250.000 t bestrahlten Nukleargraphit (Deutschland ca. 1000 t), für den es wegen seines hohen Gehalts an C-14 (radioaktives Isotop mit einer Halbwertszeit von 5700 Jahren) noch keine ökonomisch akzeptable Endlagerstrategie gibt.[32] Die Diamantbatterie verspricht – gegebenenfalls nach isotopischer Anreicherung – Nukleargraphit eben gerade aufgrund der Radioaktivität von 14C zu nutzen.[33][34]
Weitere Verwendungsmöglichkeiten


Graphit wird vielfältig genutzt als
- Bleistiftmine, auch ohne Holzumhüllung für künstlerische Grafik
- Festschmierstoff
- Werkstoff für selbstschmierende Lager und Dichtungen
- Füller zur Verbesserung der elektrischen Leitfähigkeit und zum Herabsetzen des Reibbeiwertes von Kunststoffen
- Schmelztiegel
- Gießform
- thermisch hochbelastbare Ofenauskleidung
- Ablator (z. B. im SpaceX Merlin 1A Raketentriebwerk)
- Monochromator im Einkristalldiffraktometer
- Standardsubstrat in der Rastertunnelmikroskopie unter Umgebungsbedingungen.
- Waffe in Form von Graphitfäden zum Kurzschließen der feindlichen Stromversorgung (Graphitbombe)
- korrosionsbeständiger Werkstoff in der chemischen Industrie
- Wanne und Elektroden bei der Aluminiumherstellung (Schmelzflusselektrolyse)
- Legierungselement in Gusseisen – metallurgische Ausscheidungsphase (Kugelgraphit, Lamellengraphit)
- Phasenwechselmaterial
- Diabon ist ein aus Graphit bestehender Werkstoff
- Absorbermaterial für hochenergetische Teilchen (z. B. am LHC[35])
- Zur Verbesserung der Wärmedämmung bei EPS, wie Neopor.
Siehe auch
Literatur
- Ernst H. Weinschenk: Der Graphit, seine wichtigsten Vorkommnisse und seine technische Verwerthung. Verl.-Anst. und Dr. A.-G., Hamburg 1898, urn:nbn:de:hbz:061:1-86250.
- Eugen Ryschkewitsch: Graphit. Charakteristik, Erzeugung, Verarbeitung und Verwendung. S. Hirzel, Leipzig 1926.
- Irene Kappel: Die Graphittonkeramik von Manching. F. Steiner, Wiesbaden 1969.
- Wolfgang Delle et al.: Graphitische Werkstoffe für den Einsatz in Kernreaktoren. 2. polykristalliner Graphit und Brennelementmatrix. Thiemig, München 1983.
- Petr Korbel, Milan Novák: Mineralien-Enzyklopädie (= Dörfler Natur). Edition Dörfler im Nebel-Verlag, Eggolsheim 2002, ISBN 978-3-89555-076-8, S. 15.
Weblinks
- Graphit. In: Mineralienatlas Lexikon. Geolitho Stiftung
- Graphite. In: mindat.org. Hudson Institute of Mineralogy (englisch).
- David Barthelmy: Graphite Mineral Data. In: webmineral.com. (englisch).
- Weltkarte mit Graphitbergwerken und Produzenten. In: mineral-exploration.de. Mineral & Exploration, 2012.
- Achim Breitruck, Harry E. Hoster, R. Jürgen Behm: Metal organic coordination networks of oligopyridines and Cu on graphite. In: uni-ulm.de. Archiviert vom am 11. Juni 2016 (Metallorganische 2D-Netzwerke auf einer Graphitoberfläche dargestellt mit einem Rastertunnelmikroskop).