Διοξείδιο του πυριτίου
Το διοξείδιο του πυριτίου [ αγγλικά: silicon dioxide ή silica (πυριτία) ή silicic acid anydride (ανυδρίτης πυριτικού οξέος) ] είναι η δυαδική ανόργανη ένωση με μοριακό τύπο SiO2. Πρόκειται για ένα οξείδιο το οποίο αποτελεί το «πυριτιούχο ανάλογο» του διοξειδίου του άνθρακα (CO2). Συνήθως βρίσκεται στη φύση ως χαλαζίας και σε διάφορους ζωντανούς οργανισμούς.[5][6] Σε πολλά τμήματα του κόσμου, το διοξείδιο του πυριτίου είναι το κύριο συστατικό της άμμου. Το διοξείδιο του πυριτίου είναι μία από τις πιο σύνθετες και πιο άφθονες οικογένειες υλικών, που υπάρχει ως συστατικό σε πολλά ορυκτά και σε συνθετικά προϊόντα. Αξιοσημείωτα παραδείγματα περιλαμβάνουν τον τετηγμένο χαλαζία (fused quartz), το ατμίζον διοξείδιο του πυριτίου (fumed silica), γέλη διοξειδίου του πυριτίου και αεροπηκτώματα. Χρησιμοποιείται σε δομικά υλικά, στην μικροηλεκτρονική (ως ηλεκτρικός μονωτής) και ως συστατικό σε τροφικές και φαρμακευτικές βιομηχανίες.
| Ονόματα | |
|---|---|
| ΟνοματολογίαIUPAC Διοξείδιο του πυριτίου | |
| ΆλλαΟνόματα Χαλαζίας | |
| Αναγνωριστικά | |
| 7631-86-9 | |
| ChEBI | CHEBI:30563 |
| ChemSpider | 22683 |
| Αριθμός_EC | 231-545-4 |
| 200274 | |
InChI=1S/O2Si/c1-3-2 Key: VYPSYNLAJGMNEJ-UHFFFAOYSA-N | |
| KEGG | C16459 |
| MeSH | Silicon+dioxide |
| PubChem | 24261 |
| Αριθμός RTECS | VV7565000 |
| UNII | ETJ7Z6XBU4 |
| Ιδιότητες | |
| SiO2 | |
| Μοριακή μάζα | 60,08 g/mol |
| Εμφάνιση | Διαφανές στερεό (άμορφο) λευκό/λευκάζον κίτρινο (σκόνη/άμμος) |
| Πυκνότητα | 2,648 (α-χαλαζίας), 2,196 (άμορφο) g·cm−3[1] |
| Σημείο τήξης | 1.713 °C (3.115 °F; 1.986 K) (άμορφο)[1](p4.88) to |
| −29,6·10−6 cm3/mol | |
| Θερμική αγωγιμότητα | 12 (|| άξονας c), 6,8 (⊥ άξονα c), 1,4 (αμ.) W/(m⋅K)[1](p12.213) |
Δείκτης διάθλασης (nD) | 1,544 (διπλοθλαστικότητα (o)), 1,553 (e)[1](p4.143) |
| Κίνδυνοι | |
| NFPA 704 | |
| Όρια έκθεσης υγείας ΗΠΑ (NIOSH): | |
PEL (Επιτρεπτό) | TWA 20 mppcf (80 mg/m3/%SiO2) (άμορφο)[2] |
REL (Συνιστώμενο) | TWA 6 mg/m3 (άμορφο)[2] Ca TWA 0,05 mg/m3[3] |
IDLH (Άμεσος κίνδυνος) | 3000 mg/m3 (άμορφο)[2] Ca [25 mg/m3 (χριστοβαλίτης, τριδυμίτης); 50 mg/m3 (χαλαζίας)][3] |
| Σχετικές ενώσεις | |
διόνες | Διοξείδιο του άνθρακα Διοξείδιο του γερμανίου |
Σχετικές ενώσεις | Μονοξείδιο του πυριτίου Διθειούχο πυρίτιο |
| Θερμοχημεία | |
Πρότυπη μοριακή εντροπία (S | 42 J·mol−1·K−1[4] |
Πρότυπη ενθαλπία σχηματισμού(ΔfH | −911 kJ·mol−1[4] |
| | |
Η εισπνοή λεπτοδιαμερισμένου κρυσταλλικού διοξειδίου του πυριτίου είναι τοξική και μπορεί να οδηγήσει σε σοβαρή φλεγμονή του πνευμονικού ιστού, σε πυριτίαση (silicosis), βρογχίτιδα, καρκίνο του πνεύμονα και αυτοάνοσες ασθένειες, όπως λύκο και ρευματοειδή αρθρίτιδα.
Η πρόσληψη άμορφου διοξειδίου του πυριτίου, σε υψηλές δόσεις, οδηγεί σε βραχυχρόνια φλεγμονή, όπου όλες οι επιπτώσεις θεραπεύονται.[7]
Δομή
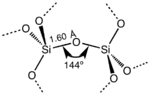

Στην πλειοψηφία των πυριτικών, το άτομο του πυριτίου εμφανίζει τετραεδρική συναρμογή (tetrahedral coordination), με τέσσερα άτομα οξυγόνου που περιβάλλουν ένα κεντρικό άτομο Si. Το πιο συνηθισμένο παράδειγμα φαίνεται στον πολύμορφο χαλαζία.
Παραδείγματος χάρη, στην κυψελίδα ενός α-χαλαζία, το κεντρικό τετράεδρο μοιράζεται και τις τέσσερις από τις γωνίες του των ατόμων του οξυγόνου, τα δύο εδροκεντρωμένα τετράεδρα μοιράζονται δύο από τα γωνιακά τους άτομα οξυγόνου και τα τέσσερα εδροκεντρωμένα τετράεδρα μοιράζονται μόλις ένα από τα άτομα οξυγόνου τους με άλλα SiO4 τετράεδρα. Αυτό αφήνει έναν καθαρό μέσο όρο από 12 από τις συνολικά 24 κορυφές για αυτό το τμήμα των επτά SiO4 τετραέδρων που θεωρούνται ότι είναι τμήμα της κυψελίδας για το διοξείδιο του πυριτίου (see 3-D Unit Cell).
Το SiO2 έχει έναν αριθμό διακριτών κρυσταλλικών (πολυμόρφων) μορφών πέρα από τις άμορφες μορφές. Με την εξαίρεση του στισοβίτη (stishovite) και των ινωδών διοξειδίων του πυριτίου, όλες οι κρυσταλλικές μορφές περιλαμβάνουν τετραεδρικές μονάδες SiO4 συνδεμένες μεταξύ τους με κοινές κορυφές σε διαφορετικές διατάξεις. Τα μήκη του δεσμού πυριτίου-οξυγόνου ποικίλλουν μεταξύ των διάφορων κρυσταλλικών μορφών· παραδείγματος χάρη, σε α-χαλαζία το μήκος του δεσμού είναι 161 pm, ενώ σε α-τριδυμίτη είναι στην περιοχή 154–171 pm. Η γωνία Si-O-Si ποικίλει επίσης μεταξύ μιας χαμηλής τιμής των 140° στον α-τριδυμίτη, μέχρι 180° στον β-τριδυμίτη. Σε α-χαλαζία, η γωνία Si-O-Si είναι 144°.[9]
Το ινώδες διοξείδιο του πυριτίου έχει δομή παρόμοια με αυτή του θειούχου πυριτίου (SiS2) με αλυσίδες από τετράεδρα με κοινά άκρα SiO4. Ο στισοβίτης, η μορφή υψηλότερης πίεσης, αντίθετα, έχει δομή που μοιάζει με ρουτιλίου όπου το πυρίτιο είναι με 6-συναρμογή. Η πυκνότητα του στισοβίτη είναι 4,287 g/cm3, συγκριτικά με τον α-χαλαζία, τον πιο πυκνό από τις μορφές χαμηλής πίεσης, που έχει πυκνότητα 2,648 g/cm3.[10] Η διαφορά στην πυκνότητα μπορεί να αποδοθεί σε αύξηση της συναρμογής στα έξι πιο μικρά μήκη δεσμού Si-Ο στον στισοβίτη (τέσσερα μήκη δεσμού Si-Ο των 176 pm και δύο άλλα των 181 pm) που είναι πιο μεγάλα από το μήκος δεσμού Si-Ο (161 pm) σε α-χαλαζία.[11]Η αλλαγή στην συναρμογή (coordination) αυξάνει την ιονικότητα του δεσμού Si-O.[12] Πιο σημαντικό είναι ότι οι αποκλίσεις από αυτές τις πρότυπες παραμέτρους συνιστούν μικροκρυσταλλικές διαφορές ή αποκλίσεις που αναπαριστούν μια προσέγγιση προς άμορφο, υαλώδες στερεό.
Η μόνη σταθερή μορφή κάτω από κανονικές συνθήκες είναι ο α-χαλαζίας, στην οποία συνήθως βρίσκεται το κρυσταλλικό διοξείδιο του πυριτίου. Στη φύση, οι ακαθαρσίες στον κρυσταλλικό α-χαλαζία μπορεί να αυξήσουν τα χρώματα (δείτε τον κατάλογο). Τα ορυκτά υψηλής θερμοκρασίας, χριστοβαλίτης ή κριστοβαλίτης και τριδυμίτης, έχουν και τα δυο πιο χαμηλές πυκνότητες και πιο χαμηλούς δείκτες διάθλασης από τον χαλαζία. Επειδή η σύσταση είναι ταυτόσημη, η αιτία για τις διαφορές πρέπει να είναι στην αυξημένη απόσταση στα ορυκτά υψηλής θερμοκρασίας. Όπως συνηθίζεται με πολλές ουσίες, όσο πιο υψηλή η θερμοκρασία, τόσο πιο μακριά είναι τα άτομα, λόγω της αυξημένης ενέργειας δόνησης (vibration energy).[εκκρεμεί παραπομπή]
Ο μετασχηματισμός από α-χαλαζία σε β-χαλαζία λαμβάνει χώρα απότομα στους 573 °C. Επειδή ο μετασχηματισμός συνοδεύεται από σημαντική αλλαγή στον όγκο, μπορεί να προκαλέσει εύκολα ρωγμάτωση των κεραμικών ή των πετρωμάτων που ξεπερνούν αυτό το όριο της θερμοκρασίας.[13]
Τα υψηλής πίεσης ορυκτά, σεϊφερτίτης (seifertite), στισοβίτης και κοεσίτης (coesite), όμως, έχουν πιο υψηλές πυκνότητες και πιο υψηλούς δείκτες διάθλασης από τον χαλαζία. Αυτό οφείλεται προφανώς στην έντονη συμπίεση των ατόμων που συμβαίνει κατά τον σχηματισμό τους, με αποτέλεσμα πιο συμπυκνωμένη δομή.[14]
Ο φωσγισίτης διοξειδίου του πυριτίου (Faujasite silica) είναι μια άλλη μορφή του κρυσταλλικού διοξειδίου του πυριτίου. Λαμβάνεται από απαργιλίωση χαμηλού σε νάτριο, πολύ σταθερού Y ζεολίθου ενωμένου με οξύ και θερμική επεξεργασία. Το τελικό προϊόν περιέχει πάνω από 99% διοξείδιο του πυριτίου και έχει υψηλή κρυσταλλικότητα και εμβαδόν επιφανείας (πάνω από 800 m2/g). Ο φωσγισίτης διοξειδίου του πυριτίου έχει πολύ υψηλή θερμική και όξινη σταθερότητα. Παραδείγματος χάρη, περιέχει υψηλό βαθμό μοριακή τάξη μεγάλης απόστασης ή κρυσταλλικότητας ακόμα και μετά από βράσιμο σε πυκνό υδροχλωρικό οξύ.[15]
Το τετηγμένο διοξείδιο του πυριτίου εμφανίζει αρκετά ιδιαίτερα φυσικά χαρακτηριστικά που μοιάζουν με αυτά που παρατηρούνται σε υγρό νερό: αρνητική θερμοκρασιακή διαστολή, μέγιστη πυκνότητα σε θερμοκρασίες ~5000 °C και ελάχιστη θερμοχωρητικότητα.[16] Η πυκνότητά του μειώνεται από 2,08 g/cm3 στους 1950 °C σε 2,03 g/cm3 στους 2200 °C.[17]
Μοριακό SiO2 με γραμμική δομή παράγεται όταν μοριακό μονοξείδιο του πυριτίου, SiO, συμπυκνώνεται σε αργό που ψύχεται με ήλιο με ήλιο μαζί με άτομα οξυγόνου που δημιουργούνται από εκφόρτιση μικροκύματος (microwave discharge)]]. Το διμερές διοξείδιο του πυριτίου, (SiO2)2 έχει παρασκευαστεί με αντίδραση O2 με μονωμένο διμερές μονοξείδιο του πυριτίου, (Si2O2). Στο διμερές διοξείδιο του πυριτίου υπάρχουν δύο άτομα οξυγόνου που γεφυρώνουν τα άτομα πυριτίου με μια γωνία Si-O-Si των 94° και μήκος δεσμού 164,6 pm με το τελικό Si-Ο με μήκος δεσμού 150,2 pm. Το μήκος δεσμού Si- είναι 148,3 pm, που συγκρίνεται με το μήκος των 161 pm σε α-χαλαζία. Η ενέργεια του δεσμού εκτιμάται στα 621,7 kJ/mol.[18]
Παρουσία στη φύση
Γεωλογία
Το διοξείδιο του πυριτίου με χημικό τύπο SiO2 βρίσκεται συνήθως στη φύση ως χαλαζίας, που αποτελεί περισσότερο από το 10% της μάζας του φλοιού της γης.[19] Ο χαλαζίας είναι το μόνο σταθερό πολύμορφο του διοξειδίου του πυριτίου στην επιφάνεια της γης. Ως μετασταθές έχει βρεθεί σε μορφές υψηλής πίεσης από κοεσίτη and στισοβίτη γύρω από δομές πρόσκρουσης (impact structures) και σχετίζεται με εκλογίτες (eclogites) που σχηματίζονται κατά τον μεταμορφισμό πολύ υψηλής πίεσης (ultra-high-pressure metamorphism). Οι μορφές υψηλών θερμοκρασιών του τριδυμίτη και του χριστοβαλίτη είναι γνωστές από ηφαιστειογενή πετρώματα πλούσια σε διοξείδιο του πυριτίου. Σε πολλές περιοχές του κόσμου, το διοξείδιο του πυριτίου είναι το κύριο συστατικό της άμμου.[20]
Βιολογία
Αν και είναι λίγο διαλυτό, το διοξείδιο του πυριτίου εμφανίζεται σε πολλά φυτά. Υλικά φυτών με υψηλή περιεκτικότητα σε διοξείδιο του πυριτίου από φυτόλιθο φαίνεται να είναι σημαντικά για ζώα που βόσκουν, από μασητικά έντομα μέχρι οπληφόρα (ungulates). Το διοξείδιο του πυριτίου επιταχύνει την φθορά των δοντιών και υψηλά επίπεδα από διοξείδιο του πυριτίου σε φυτά που τρώγονται συχνά από φυτοφάγα μπορεί να έχουν αναπτυχθεί ως αμυντικός μηχανισμός κατά της αρπακτικότητας.[21][22]
Το διοξείδιο του πυριτίου είναι επίσης πρωτεύον συστατικό του τέφρας φλοιού ρυζιού (rice husk ash), που χρησιμοποιείται, παραδείγματος χάρη, στη διήθηση και στην κατασκευή τσιμέντου.
Για πάνω από ένα δισεκατομμύριο χρόνια, η πυριτικοποίηση (silicification) στα κύτταρα και από τα κύτταρα είναι κοινή στον βιολογικό κόσμο. Στον σύγχρονο κόσμο συμβαίνει σε βακτήρια, μονοκύτταρους οργανισμούς, φυτά και ζώα (ασπόνδυλα και σπονδυλωτά).Χαρακτηριστικά παραδείγματα περιλαμβάνουν:
- Το κέλυφος των διατόμων, ακτινοζώων και της testate amoebae.[6]
- Φυτόλιθους από διοξείδιο του πυριτίου στα κύτταρα πολλών φυτών, συμπεριλαμβανομένων των ιππουριδοειδών (Equisetaceae), πρακτικά όλα τα χόρτα και πλατύ φάσμα από δικοτυληδόνων.
- Οι αιχμές που σχηματίζουν τον σκελετό πολλών σπόγγων.
Τα κρυσταλλικά ορυκτά που σχηματίζονται στο φυσιολογικό περιβάλλον εμφανίζουν συχνά εξαιρετικές φυσικές ιδιότητες (π.χ., δύναμη, σκληρότητα, δυσθραυστότητα) και τείνουν να σχηματίσουν ιεραρχικές δομές που επιδεικνύουν μικροκρυσταλλική τάξη σε πλατύ εύρος κλιμάκων. Τα ορυκτά κρυσταλλοποιούνται από περιβάλλον που είναι ακόρεστο ως προς το πυρίτιο και σε συνθήκες ουδέτερου pH και χαμηλής θερμοκρασίας (0–40 °C).
Ο σχηματισμός του ορυκτού μπορεί να συμβεί είτε μέσα στο κυτταρικό τοίχωμα ενός οργανισμού (όπως στους φυτολίθους), ή έξω από το κυτταρικό τοίχωμα, όπως τυπικά συμβαίνει σε δοκιμές. Ειδικές βιοχημικές αντιδράσεις υπάρχουν για την απόθεση ορυκτών. Τέτοιες αντιδράσεις περιλαμβάνουν αυτές που εμπεριέχουν λιπίδια, πρωτεΐνες και υδατάνθρακες.
Είναι ασαφές για ποιο λόγο το διοξείδιο του πυριτίου είναι σημαντικό στη διατροφή των ζώων. Αυτός ο τομέας της έρευνας είναι δύσκολος, επειδή το διοξείδιο του πυριτίου είναι πανταχού παρόν και στις περισσότερες περιπτώσεις διαλύεται μόνο σε ίχνη. Το ίδιο συμβαίνει σίγουρα και στους ζωντανούς οργανισμούς, αφήνοντας μας με το πρόβλημα της δυσκολίας δημιουργίας κατάλληλων ελέγχων χωρίς διοξείδιο του πυριτίου για ερευνητικούς σκοπούς. Αυτό καθιστά δύσκολη τη βεβαιότητα πότε το διοξείδιο του πυριτίου έχει λειτουργικά ωφέλιμα αποτελέσματα και πότε η παρουσία του είναι τυχαία ή ακόμα επιβλαβής. Η τρέχουσα επικρατούσα άποψη είναι ότι είναι φαίνεται να είναι σίγουρα σημαντικό στην ανάπτυξη, δύναμη και διαχείριση πολλών συνδετικών ιστών. Αυτό αληθεύει όχι μόνο για σκληρούς συνδετικούς ιστούς όπως οστά και δόντια, αλλά πιθανόν και στη βιοχημεία των υποκυτταρικών δομών που περιέχουν ένζυμο.[23]
Χρήσεις
Οικοδομική χρήση
Υπολογίζεται ότι το 95% του παραγόμενου διοξειδίου του πυριτίου καταναλώνεται στην οικοδομική βιομηχανία, π.χ. για την παραγωγή του τσιμέντου τύπου Πόρτλαντ.[19]
Το διοξείδιο του πυριτίου με τη μορφή της άμμου χρησιμοποιείται ως το κύριο συστατικό στην χύτευση σε άμμο (sand casting) για την κατασκευή μεταλλικών συστατικών στη μηχανική και άλλες εφαρμογές. Το υψηλό σημείο τήξης του διοξειδίου του πυριτίου επιτρέπει τη χρήση του σε τέτοιες εφαρμογές.
Το κρυσταλλικό διοξείδιο του πυριτίου χρησιμοποιείται στην υδραυλική ρωγμάτωση (hydraulic fracturing) σχηματισμών που περιέχουν σχιστολιθικό πετρέλαιο (tight oil) και σχιστολιθικό αέριο (shale gas).[24]
Πρόδρομη ένωση στο γυαλί και το πυρίτιο
Το διοξείδιο του πυριτίου είναι το κύριο συστατικό στην παραγωγή του περισσότερου γυαλιού. Η θερμοκρασία υαλώδους μετάπτωσης του καθαρού SiO2 είναι περίπου 1475 K.[25] Όταν τετηγμένο διοξείδιο του πυριτίου SiO2 ψύχεται γρήγορα, δεν κρυσταλλοποιείται, αλλά στερεοποιείται ως γυαλί.
Η δομική γεωμετρία του πυριτίου και του οξυγόνου στο γυαλί είναι παρόμοια με αυτή του χαλαζία και των περισσότερων άλλων κρυσταλλικών μορφών του πυριτίου και του οξυγόνου με το πυρίτιο να περιβάλλεται από κανονικά τετράεδρα κέντρων του οξυγόνου. Η διαφορά μεταξύ του γυαλιού και των κρυσταλλικών μορφών προκύπτει από την συνδεσιμότητα των τετραεδρικών μονάδων: Αν και δεν υπάρχει μεγάλη περιοδικότητα περιοχής στην υαλώδη διάταξη δικτύου παραμένει σε κλίμακες μήκους αρκετά πέρα από το μήκος δεσμού SiO. Παράδειγμα αυτής της διάταξης είναι η προτίμηση δημιουργίας δακτυλίων 6-τετραέδρων.[26]
Ατμίζον διοξείδιο του πυριτίου (ή καπνοπυριτία ή πυρογενές διοξείδιο του πυριτίου)
Το ατμίζον διοξείδιο του πυριτίου είναι μια μορφή διοξειδίου του πυριτίου πολύ λεπτών σωματιδίων ή κολλοειδούς. Παρασκευάζεται καίγοντας τετραχλωριούχο πυρίτιο (SiCl4) σε φλόγα υδρογόνου πλούσιου σε οξυγόνο για να παραγάγει "καπνόe" από SiO2.[10]
- SiCl4 + 2 H2 + O2 → SiO2 + 4 HCl.
Η πλειοψηφία των οπτικών ινών για τις τηλεπικοινωνίες παρασκευάζονται επίσης από διοξείδιο του πυριτίου. Είναι πρωτογενής ακατέργαστη ύλη για πολλά είδη κεραμικών και πορσελάνη.
Το διοξείδιο του πυριτίου χρησιμοποιείται για την παραγωγή στοιχειακού πυριτίου. Η διεργασία περιλαμβάνει ανθρακοθερμική αναγωγή (carbothermic reduction) σε κάμινο ηλεκτρικού τόξου (electric arc furnace):[27]
- SiO2 + 2 C → Si + 2 CO
Διατροφικές και φαρμακευτικές εφαρμογές
Το διοξείδιο του πυριτίου είναι ένα συνηθισμένο πρόσθετο στην παραγωγή τροφίμων, όπου χρησιμοποιείται κυρίως ως παράγοντας ροής σε κονιοποιημένα τρόφιμα, ή για να προσροφήσει νερό σε υγροσκοπικές εφαρμογές. Χρησιμοποιείται ως αντισυσσωματικός παράγοντας σε κονιοποιημένα τρόφιμα όπως σε καρυκεύματα και σε μη γαλακτοκομικά υποκατάστατα κρέμας. Είναι βασικό συστατικό της γης διατόμων (diatomaceous earth). Το κολλοειδές διοξείδιο του πυριτίου χρησιμοποιείται ως διαυγαστικό μέσο σε κρασί, ζύθο και χυμούς.[19]
Στα φαρμακευτικά προϊόντα, το διοξείδιο του πυριτίου βοηθά τη ροή σκόνης όταν σχηματίζονται χάπια.
Προσωπική φροντίδα
Στα καλλυντικά, χρησιμοποιείται λόγω των ιδιοτήτων ελαφράς διάχυσης και φυσικής απορροφητικότητας που έχει.[28][29]
Το ενυδατωμένο διοξείδιο του πυριτίου χρησιμοποιείται στις οδοντόκρεμες ως σκληρό λειαντικό για την αφαίρεση της οδοντικής πλάκας.
Άλλες χρήσεις
Το υδρόφοβο διοξείδιο του πυριτίου (Hydrophobic silica) χρησιμοποιείται ως αποαφριστικό.[30]
Η ιδιότητα του ως πυρίμαχο, είναι χρήσιμη σε μορφή ινών ως υλικό θερμικής προστασίας σε υψηλές θερμοκρασίες.
Χρησιμοποιείται ως συστατικό θερμικής βελτίωσης στη βιομηχανία αντλιών θερμότητας εδάφους (ground source heat pump).
Το διοξείδιο του πυριτίου χρησιμοποιείται στην εξαγωγή του DNA και του RNA λόγω της ικανότητας σύνδεσης του με τα νουκλεϊκά οξέα παρουσία χαοτρόπων (chaotropes).[31]
Ένα αεροπήκτωμα με βάση το διοξείδιο του πυριτίου χρησιμοποιήθηκε στο διαστημόπλοιο αστρόσκονη (Stardust) για τη συλλογή εξωγήινων σωματιδίων.[32]
Το καθαρό διοξείδιο του πυριτίου, όταν ψυχθεί ως ατμίζων χαλαζίας σε γυαλί χωρίς πραγματικό σημείο τήξης, μπορεί να χρησιμοποιηθεί ως ίνες γυαλιού (glass fiber) για υαλοβάμβακα (fiberglass).
Παραγωγή
Το διοξείδιο του πυριτίου λαμβάνεται συνήθως με εξόρυξη, συμπεριλαμβανόμενης της αμμοληψίας και του καθαρισμού του χαλαζία. Ο χαλαζίας είναι κατάλληλος για πολλούς σκοπούς, ενώ απαιτείται χημική επεξεργασία για να γίνει καθαρότερος ή αλλιώς πιο κατάλληλο προϊόν (π.χ. πιο δραστικό ή λεπτόκοκκο).
Καπνοί διοξειδίου του πυριτίου (silica fume)
Καπνοί διοξειδίου του πυριτίου λαμβάνονται ως παραπροϊόν από θερμή επεξεργασία όπως παραγωγή σιδηροπυριτίου (ferrosilicon). Είναι λιγότερο καθαροί από το ατμίζον διοξείδιο του πυριτίου (fumed silica) και δεν πρέπει να συγχέεται με αυτό το προϊόν. Η διεργασία παραγωγής, τα χαρακτηριστικά σωματιδίων και τα πεδία εφαρμογής του ατμίζοντος διοξειδίου του πυριτίου είναι ολότελα διαφορετικά από αυτά των καπνών διοξειδίου του πυριτίου.
Ίζημα διοξειδίου του πυριτίου (Precipitated silica)
Ίζημα διοξειδίου του πυριτίου ή άμορφο διοξείδιο του πυριτίου (amorphous silica) παράγεται από την οξίνιση διαλυμάτων του πυριτικού νατρίου (sodium silicate). Το πηκτωματώδες ίζημα ή πηκτή του διοξειδίου του πυριτίου (silica gel), πλένεται πρώτα και έπειτα αφυδατώνεται για να παραγάγει άχρωμο μικροπορώδες διοξείδιο του πυριτίου.[10] Η ιδανική εξίσωση που περιέχει τριπυριτικό και θειικό οξύ είναι:
- Na2Si3O7 + H2SO4 → 3 SiO2 + Na2SO4 + H2O
Περίπου ένα δισεκατομμύριο χιλιόγραμμα/έτος (1999) από διοξείδιο του πυριτίου παράχθηκαν με αυτόν τον τρόπο, κυρίως για χρήση σε σύνθετα πολυμερή - ελαστικά και σόλες υποδημάτων.[19]
Σε μικροολοκληρωμένα κυκλώματα
Λεπτές ταινίες από διοξείδιο του πυριτίου αναπτύσσονται αυθόρμητα σε δισκία πυριτίου (silicon wafer) μέσω θερμικής οξείδωσης, παράγοντας μια πολύ κοίλη στρώση περίπου 1 nm του αποκαλούμενου φυσικού οξειδίου (native oxide).[33]Υψηλότερες θερμοκρασίες και εναλλακτικά περιβάλλοντα χρησιμοποιούνται για την ανάπτυξη καλώς ελεγχόμενων στρωμάτων από διοξείδιο του πυριτίου σε πυρίτιο, παραδείγματος χάρη σε θερμοκρασίες μεταξύ 600 και 1200 °C, χρησιμοποιώντας την αποκαλούμενη ξηρή ή υγρή οξείδωση με O2
- Si + O2 → SiO2
- Si + 2 H2Ο → SiO2 + 2 H2
Το φυσικό στρώμα οξειδίου είναι ευνοϊκό στη μικροηλεκτρονική, όπου δρα ως ηλεκτρικός μονωτής με υψηλή χημική σταθερότητα. Μπορεί να προστατεύσει το πυρίτιο, να αποθηκεύσει φορτίο, να σταματήσει το ρεύμα και ακόμα να δράσει ως ελεγχόμενη οδός περιορισμού της τρέχουσας ροής.[36]
Εργαστηριακές ή ειδικές μέθοδοι
Από πυριτικούς εστέρες
Πολλοί οδοί για το διοξείδιο του πυριτίου ξεκινούν με πυριτικούς εστέρες, με την καλύτερη να είναι με το ορθοπυριτικό τετρααιθύλιο (tetraethyl orthosilicate) (TEOS). Θερμαίνοντας απλά το TEOS στους 680–730 °C δίνει το διοξείδιο:
- Si(OC2H5)4 → SiO2 + 2 O(C2H5)2
Παρομοίως, το TEOS καίγεται γύρω στους 400 °C:
- Si(OC2H5)4 + 12 O2 → SiO2 + 10 H2Ο + 8 CO2
Το TEOS υφίσταται υδρόλυση μέσω της αποκαλούμενης επεξεργασίας διαλύματος-πηκτής (sol-gel process). Η διαδικασία της αντίδρασης και η φύση του προϊόντος επηρεάζονται από καταλύτες, αλλά η εξιδανικευμένη αντίδραση είναι:[37]
- Si(OC2H5)4 + 2 H2Ο → SiO2 + 4 HOCH2CH3
Άλλες μέθοδοι
Επειδή είναι πολύ σταθερό, το διοξείδιο του πυριτίου προκύπτει από πολλές μεθόδους. Εννοιολογικά απλό, αλλά με μικρή πρακτική αξία, η καύση του σιλανίου δίνει διοξείδιο του πυριτίου. Αυτή η αντίδραση είναι ανάλογη με την καύση του μεθανίου:
- SiH4 + 2 O2 → SiO2 + 2 H2O.
Όμως, η χημική εναπόθεση ατμών (chemical vapor deposition) του διοξειδίου του πυριτίου σε κρυσταλλική επιφάνεια από σιλάνιο έχει χρησιμοποιηθεί με τη χρήση αζώτου ως φέρον αέριο (carrier gas) στους 200-500oC.[38]
Χημικές αντιδράσεις

Το διοξείδιο του πυριτίου μετατρέπεται σε πυρίτιο με αναγωγή από άνθρακα.
Το φθόριο αντιδρά με διοξείδιο του πυριτίου για να σχηματίσει SiF4 και O2, ενώ τα άλλα αέρια αλογόνων (Cl2, Br2, I2) είναι ουσιαστικά ανενεργά.[10]
Το διοξείδιο του πυριτίου προσβάλλεται από υδροφθορικό οξύ (HF) για να παραγάγει εξαφθοροπυριτικό οξύ:[9]
- SiO2 + 6 HF → H2SiF6 + 2 H2O.
Το HF χρησιμοποιείται για να αφαιρέσει ή να ακολουθήσει το διοξείδιο του πυριτίου στη βιομηχανία ημιαγωγών.
Το διοξείδιο του πυριτίου δρα ως οξύ Lux–Flood, που μπορεί να αντιδράσει με βάσεις κάτω από συγκεκριμένες συνθήκες. Επειδή δεν περιέχει υδρογόνο, δεν μπορεί να αντιδράσει ως οξύ Μπρόνστεντ-Λόρι. Ενώ δεν είναι διαλυτό στο νερό, μερικές ισχυρές βάσεις θα αντιδράσουν με το γυαλί και πρέπει να αποθηκεύεται συνεπώς σε πλαστικές φιάλες.[39]
Το διοξείδιο του πυριτίου διαλύεται σε ζεστό συμπυκνωμένο άλκαλι ή τετηγμένο υδροξείδιο, όπως περιγράφεται στην ιδανική εξίσωση:[10]
- SiO2 + 2 NaOH → Na2SiO3 + H2O.
Το διοξείδιο του πυριτίου εξουδετερώνει βασικά μεταλλικά οξείδια (π.χ. οξείδιο του νατρίου, οξείδιο του καλίου, οξείδιο του μολύβδου (ΙΙ), οξείδιο του ψευδαργύρου, ή μείγματα οξειδίων, σχηματίζοντας πυριτικά και υάλους επειδή οι δεσμοί Si-O-Si στο διοξείδιο του πυριτίου σπάνε διαδοχικά).[9] Ως παράδειγμα η αντίδραση οξειδίου του νατρίου και SiO2 μπορεί να παραγάγει ορθοπυριτικό νάτριο, πυριτικό νάτριο και υάλους, ανάλογα με τις αναλογίες των αντιδρώντων:[10]
- 2 Na2Ο + SiO2 → Na4SiO4;
- Na2Ο + SiO2 → Na2SiO3;
- (0,25–0,8)Na2Ο + SiO2 → ύαλος.
Παραδείγματα τέτοιων υάλων έχουν εμπορική αξία, π.χ. ύαλος νατρασβέστου (soda-lime glass), βοροπυριτική ύαλος (borosilicate glass), ύαλος μολύβδου (lead glass). Σε αυτές τις υάλους, το διοξείδιο του πυριτίου ονομάζεται διαμορφωτής δικτύου ή πλέγματος (network former ή lattice former).[9] Η αντίδραση χρησιμοποιείται επίσης σε υψικαμίνους (blast furnaces) για την αφαίρεση ακαθαρσιών άμμου στο ορυκτό με εξουδετέρωση με οξείδιο του ασβεστίου, σχηματίζοντας σκουριά πυριτικού ασβεστίου.

Το διοξείδιο του πυριτίου αντιδρά σε θερμαινόμενη επαναρροή (reflux) σε διάζωτο με 1,2-αιθανοδιόλη και βάση αλκαλιμετάλλου για την παραγωγή πολύ δραστικών, υπερσθενών πυριτικών που παρέχουν πρόσβαση σε πλατύ φάσμα νέων ενώσεων του πυριτίου.[40] Τα πυριτικά είναι πρακτικά αδιάλυτα σε όλους τους πολικούς διαλύτες εκτός από τη μεθανόλη.
Το διοξείδιο του πυριτίου αντιδρά με στοιχειακό πυρίτιο σε υψηλές θερμοκρασίες και παράγει SiO:[9]
- SiO2 + Si → 2 SiO
Διαλυτότητα στο νερό
Η διαλυτότητα του διοξειδίου του πυριτίου στο νερό εξαρτάται πολύ από την κρυσταλλική του μορφή και είναι τρεις έως τέσσερις φορές υψηλότερη στο διοξείδιο του πυριτίου από τον χαλαζία· ως συνάρτηση της θερμοκρασίας, έχει μέγιστο γύρω στους 340 °C.[41] Αυτή η ιδιότητα χρησιμοποιείται για την αύξηση μεμονωμένων κρυστάλλων χαλαζία σε υδροθερμική επεξεργασία, όπου φυσικός χαλαζίας διαλύεται σε υπέρθερμο νερό σε δοχείο πίεσης που είναι πιο κρύο στην κορυφή. Κρύσταλλοι 0,5–1 kg μπορούν να αυξηθούν σε μια περίοδο 1–2 μηνών.[9] Αυτοί οι κρύσταλλοι αποτελούν την πηγή πολύ καθαρού χαλαζία για χρήση σε ηλεκτρονικές εφαρμογές.[10]
Επιπτώσεις στην υγεία

Το διοξείδιο του πυριτίου όταν ληφθεί από το στόμα είναι βασικά μη τοξικό, με μέση θανατηφόρα δόση 5000 mg/kg (5 g/kg).[19] Μια μελέτη του 2008 διάρκειας 15 ετών βρήκε ότι υψηλότερα επίπεδα διοξειδίου του πυριτίου στο νερό φαίνεται να μειώνουν τον κίνδυνο της άνοιας. Αύξηση 10 mg/ημέρα από διοξείδιο του πυριτίου σε πόσιμο νερό συσχετίστηκε με μείωση του κινδύνου άνοιας κατά 11%.[42]
Εισπνεόμενη λεπτοδιαμερισμένη σκόνη κρυσταλλικού διοξειδίου του πυριτίου μπορεί να οδηγήσει σε πυριτίαση (silicosis), βρογχίτιδα, ή καρκίνο του πνεύμονα, επειδή η σκόνη κολλάει στα πνευμόνια και ερεθίζει συνεχώς τον ιστό, μειώνοντας τη χωρητικότητα του πνεύμονα.[43] Όταν λεπτά σωματίδια διοξειδίου του πυριτίου αναπνέονται σε αρκετά μεγάλες ποσότητες (όπως μέσω επαγγελματικής έκθεσης), αυξάνεται ο κίνδυνος αυτοάνοσων ασθενειών όπως ο λύκος[44] και η ρευματοειδής αρθρίτιδα σε σύγκριση με τους αναμενόμενους ρυθμούς στον γενικό πληθυσμό.[45]
Επαγγελματικοί κίνδυνοι
Το διοξείδιο του πυριτίου είναι επαγγελματικός κίνδυνος για άτομα που κάνουν αμμοβολή, ή δουλεύουν με προϊόντα που περιέχουν κονιοποιημένο κρυσταλλικό διοξείδιο του πυριτίου. Το άμορφο διοξείδιο του πυριτίου, όπως η καπνοπυριτία (fumed silica), μπορεί να προκαλέσει μη αντιστρεπτή βλάβη στον πνεύμονα σε κάποιες περιπτώσεις, αλλά δεν συσχετίζεται με ανάπτυξη πυριτίασης. Παιδιά, ασθματικοί κάθε ηλικίας, αλλεργικοί και οι ηλικιωμένοι (που όλοι τους έχουν μειωμένη χωρητικότητα πνεύμονα) μπορεί να επηρεαστούν σε λιγότερο χρόνο.[46]
Το κρυσταλλικό διοξείδιο του πυριτίου είναι επαγγελματικός κίνδυνος για όσους δουλεύουν με πέτρινους πάγκους, επειδή η διαδικασία κοπής και εγκατάστασης των πάγκων δημιουργεί μεγάλες ποσότητες αερομεταφερόμενου διοξειδίου του πυριτίου.[47] Το κρυσταλλικό διοξείδιο του πυριτίου που χρησιμοποιείται στην υδραυλική ρηγμάτωση (hydraulic fracturing) παρουσιάζει κίνδυνο υγείας για τους εργαζομένους.[24]
Παθοφυσιολογία
Στο σώμα, τα σωματίδια του κρυσταλλικού διοξειδίου του πυριτίου δεν διαλύονται για κλινικά σχετικές περιόδους. Οι κρύσταλλοι διοξειδίου του πυριτίου στα πνευμόνια μπορούν να ενεργοποιήσουν το φλεγμονόσωμα (inflammasome) NLRP3 σε μακροφάγα και δενδριτικά κύτταρα και να καταλήξουν συνεπώς στην παραγωγή της ιντερλευκίνης (interleukin), μιας ιδιαίτερα προφλεγμονώδους κυτοκίνης (pro-inflammatory cytokine) στο ανοσοποιητικό σύστημα.[48][49][50]
Κανονισμοί
Κανονισμοί που περιορίζουν την έκθεση διοξειδίου του πυριτίου 'ως προς τον κίνδυνο πυριτίασης' καθορίζουν ότι αφορούν μόνο το διοξείδιο του πυριτίου, που είναι και κρυσταλλικό και σε μορφή σκόνης.[51][52][53][54][55][56]
Το 2013, η Υπηρεσία Επαγγελματικής Ασφάλειας και Υγείας των ΗΠΑ (Occupational Safety and Health Administration( μείωσε το όριο έκθεσης σε 50 µg/m3 αέρα. Πριν το 2013, επιτρεπότανε 100 µg/m3 και στους εργαζόμενους στις κατασκευές ακόμα και σε 250 µg/m3.[24]Το 2013, το OSHA ζήτησε επίσης "πράσινη ολοκλήρωση (green completion)" των φρεάτων με ρωγμάτωση για να μειώσει την έκθεση σε κρυσταλλικό διοξείδιο του πυριτίου, πέρα από τον περιορισμό του ορίου της έκθεσης.[24]
Κρυσταλλικές μορφές
Το SiO2, περισσότερο από σχεδόν οποιοδήποτε υλικό, υπάρχει σε πολλές κρυσταλλικές μορφές. Αυτές οι μορφές ονομάζονται πολύμορφα σώματα.
| Μορφή | Κρυσταλλική συμμετρία Σύμβολο Πίρσον, Αρ. ομάδας | ρ g/cm3 | Σημειώσεις | Δομή |
|---|---|---|---|---|
| α-χαλαζίας | Ρομβοεδρικό (τριγωνικό) hP9, P3121 No.152[57] | 2,648 | Ελικοειδείς αλυσίδες που κάνουν μεμονωμένους μοναδικούς κρυστάλλους οπτικά ενεργούς· ο α-χαλαζίας μετατρέπεται σε β-χαλαζία στους 846 K |  |
| β-χαλαζίας | Εξαγωνικό hP18, P6222, No. 180[58] | 2,533 | Πολύ συγγενές με τον α-χαλαζία (με γωνία Si-O-Si 155°) και οπτικά ενεργό· ο β-χαλαζίας μετατρέπεται σε β-τριδυμίτη στους 1140 K |  |
| α-τριδιμύτης | Ορθορομβικό oS24, C2221, No.20[59] | 2,265 | Μετασταθής μορφή κάτω από κανονική πίεση |  |
| β-τριδυμίτης | Εξαγωνικό hP12, P63/mmc, No. 194[59] | Στενά συγγενής με τον α-τριδυμίτη· ο β-τριδυμίτης μετατρέπεται σε β-κριστοβαλίτη στους 2010 K |  | |
| α-κριστοβαλίτης | Τετραγωνικό tP12, P41212, No. 92[60] | 2,334 | Μετασταθής μορφή κάτω από κανονική πίεση |  |
| β-κριστοβαλίτης | Κυβικό cF104, Fd3m, No.227[61] | Στενά συγγενής με τον α-κριστοβαλίτη· τήκεται στους 1978 K |  | |
| Κεατίτης | Τετραγωνικό tP36, P41212, No. 92[62] | 3,011 | Δακτύλιοι Si5O10, Si4O14, Si8O16· συντίθεται από υαλώδες διοξείδιο του πυριτίου και άλκαλι στους 600–900 K και 40–400 MPa |  |
| Μογκανίτης | Μονοκλινές mS46, C2/c, No.15[63] | Δακτύλιοι Si4O8 and Si6O12 | 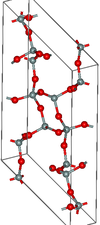 | |
| Κοεσίτης | Μονικλινές mS48, C2/c, No.15[64] | 2,911 | Δακτύλιοι Si4O8 και Si8O16· 900 K και 3–3,5 GPa | 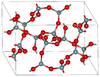 |
| Στισχοβίτης | Τετραγωνικό tP6, P42/mnm, No.136[65] | 4,287 | Ένα από τα πιο πυκνά πολύμορφα του διοξειδίου του πυριτίου (μαζί με τον σιφερτίτη (seifertite))· μοιάζει με το ρουτίλιο με 6πλο Si συναρμογής· 7,5–8,5 GPa |  |
| Σιφερτίτης | Ορθορομβικό oP, Pbcn[66] | 4,294 | Ένα από τα πιο πυκνά πολύμορφα του διοξειδίου του πυριτίου (μαζί με τον στισχοβίτη)· παράγεται σε πιέσεις πάνω από 40 GPa.[67] | 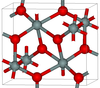 |
| Μελανοφλογίτης | Κυβικό (cP*, P4232, No.208)[8] ή τετραγωνικό (P42/nbc)[68] | 2,04 | Δακτύλιοι Si5O10, Si6O12· ορυκτό βρίσκεται πάντα υδρογονάνθρακες σε χώρους παρεμβολής - Κλαθρασίλης[69] |  |
| Ινώδες W-διοξείδιο του πυριτίου[10] | Ορθορομβικό oI12, Ibam, No.72[70] | 1,97 | Όπως το SiS2 αποτελείται από αλυσίδες κοινού άκρου, τήκεται στους ~1700 K | 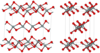 |
| 2Δ διοξείδιο του πυριτίου[71] | Εξαγωνικό | Φυλλόμορφη δομή διπλοστιβάδας |  |
Παραπομπές
Εξωτερικοί σύνδεσμοι
- Tridymite, International Chemical Safety Card 0807
- Quartz, International Chemical Safety Card 0808
- Cristobalite, International Chemical Safety Card 0809
- amorphous, NIOSH Pocket Guide to Chemical Hazards
- crystalline, as respirable dust, NIOSH Pocket Guide to Chemical Hazards
- Formation of silicon oxide layers in the semiconductor industry. LPCVD and PECVD method in comparison. Stress prevention.
- Quartz SiO2 piezoelectric properties
- Silica (SiO2) and Water
- Epidemiological evidence on the carcinogenicity of silica: factors in scientific judgement by C. Soutar and others. Institute of Occupational Medicine Research Report TM/97/09
- Scientific opinion on the health effects of airborne silica by A Pilkington and others. Institute of Occupational Medicine Research Report TM/95/08
- The toxic effects of silica by A Seaton and others. Institute of Occupational Medicine Research Report TM/87/13
- Structure of precipitated silica Αρχειοθετήθηκε 2015-07-15 στο Wayback Machine.
