1-Butanol
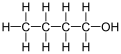
O 1-butanol, tamén chamdao butan-1-ol ou n-butanol, é un alcohol primario coa fórmula química C4H9OH e unha estrutura liñal. Son isómeros do 1-butanol o isobutanol, o butan-2-ol e o ter-butanol. O termo sen máis modificacións butanol adoita referirse ao isómero de cadea recta 1-butanol.
| 1-Butanol | |
|---|---|
 | |
 | |
Outros nomes n-Butanol | |
| Identificadores | |
| Número CAS | 71-36-3 |
| PubChem | 263 |
| ChemSpider | 258 |
| UNII | 8PJ61P6TS3 |
| Número CE | 200-751-6 |
| Número UN | 1120 |
| DrugBank | DB02145 |
| KEGG | D03200 |
| MeSH | 1-Butanol |
| ChEBI | CHEBI:28885 |
| ChEMBL | CHEMBL14245 |
| Número RTECS | EO1400000 |
| Referencia Beilstein | 969148 |
| Referencia Gmelin | 25753 |
| 3DMet | B00907 |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
| Fórmula molecular | C4H10O |
| Masa molar | 74,12 g mol−1 |
| Aspecto | Líquido incoloro refrinxente |
| Olor | a banana,[2] áspero, alcohólico e doce |
| Densidade | 0,81 g/cm3 |
| Punto de fusión | −898 °C; −1 584 °F; −625 K |
| Punto de ebulición | 1 177 °C; 2 151 °F; 1 450 K |
| Solubilidade en auga | 73 g/L a 25 °C |
| Solubilidade | moi soluble en acetona miscible con etanol, etil éter |
| log P | 0.839 |
| Presión de vapor | 0,58 kPa (20 °C) ILO International Chemical Safety Cards (ICSC) |
| Acidez (pKa) | 16,10 |
Susceptibilidade magnética (χ) | −56,536·10−6 cm3/mol |
| Índice de refracción (nD) | 1,3993 (20 °C) |
| Viscosidade | 2,573 mPa·s (a 25 °C) [3] |
| Momento dipolar | 1,66 D |
| Termoquímica | |
| Entalpía estándar de formación ΔfH | −328(4) kJ/mol |
| Entalpía estándar de combustión ΔcH | −2670(20) kJ/mol |
| Entropía molar estándar S | 225,7 J/(K·mol) |
| Perigosidade | |
| Pictogramas GHS |  |
| NFPA 704 | |
| Punto de inflamabilidade | 35 °C; 95 °F; 308 K |
| Límites de explosividade | 1.45–11.25% |
| LD50 | 790 mg/kg (rat, oral) |
| Compostos relacionados | |
| Compostos relacionados | Butanetiol n-Butilamina Dietil éter Pentano |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
O 1-butanol aparece na natureza como un produto menor da fermentación etanólica de azucres e outros sacáridos[4] e está presente en moitos alimentos e bebidas.[5][6] Tamén é un aromatizante artificial permitido nalgúns países, como EUA,[7] usado en manteigas, cremas, froitas, ron, whisky, xeados, caramelos, bolería e refrescos.[8] Tamén se usa nunha ampla variedade de produtos de consumo non alimentarios.[5] Non figura na lista de aditivos alimentarios permitidos na Unión Europea[9] e está na lista positiva da regulación da Unión Europea 10/2011 para plásticos que están en contacto con alimentos.[10][11]
O amplo uso do 1-butanol como intermediario industrial, especialmente para a produción de acetato de butilo (que el mesmo é un aromatizante e solvente industrial). É un composto petroquímico derivado do propileno. A produción estimada en 1997 era: Estados Unidos 784,000 toneladas; Europa occidental 575,000 toneladas; Xapón 225,000 toneladas.[6]
Produción
Desde a década de 1950, a maioría dot 1-butanol prodúcese por hidroformilación do propeno (proceso oxo) para formar preferencialmente o butiraldehido n-butanal. A catálise típica baséase no cobalto e o rodio. O butiraldehido é despois hidroxenado para producir butanol.

Un segundo método para producir butanol é pola reacción de Reppe do propileno con CO e auga:[12]
- CH3CH=CH2 + H2O + 2 CO → CH3CH2CH2CH2OH + CO2
En épocas anteriores, o butanol preparábase a partir do crotonaldehido, que pode obterse do acetaldehido.
O butanol pode tamén producirse por fermentación bacteriana de biomasa. Antes da década de 1950 utilizábase Clostridium acetobutylicum en fermentación industrial para producir butanol. Investigacións feitas nas pasadas décadas mostraron os resultados que se obtiñan con outros organismos que poden producir butanol por fermentación.
O butanol pode producirse por hidroxenación do furano con catálise con paladio ou platino a alta temperatura e alta presión.[13]
Uso industrial
A produción de vernices supón o 85% do uso do 1-butanol. É un solvente moi utilizado, por exemplo para a nitrocelulosa. Diversos derivados do butanol utilízanse como solventes, como o butoxietanol ou acetato de butilo. Moitos plastificantes están baseados en ésteres butilo, por exemplo o ftalato de dibutilo. O monómero acrilato de butilo utilízase para producir polímeros. É o precursor das n-butilaminas.[12]
Biocombustible
O 1-butanol propúxose como substituto ao gasóleo para diésel e para a gasolina. É producido en pequenas cantidades en case todas as fermentacións (combustible fusel). O Clostridium produce moito maior rendemento de butanol. Están a facerse investigacións para incrementar o rendemento de biobutanol a partir de biomasa.
O butanol é considerado como un potencial biocombustible (combustible butanol). O butanol ao 85% pode utilizarse en coches deseñados para gasolina sen necesidade de facer cambios no motor (a diferenza do etanol ao 85%), e proporciona máis enerxía por un mesmo volume que o etanol, case tanto coma a gasolina. Por tanto, un vehiculo que use butanol tería un consumo de combustible máis comparable ao da gasolina que ao do etanol. O butanol pode tamén engadirse ao combustible para diésel para reducir as emisións de feluxe.[14]
A produción ou nalgúns casos o uso das seguintes substancias pode causar unha exposición ao 1-butanol: coiro sintético, butil ésteres, cola de caucho, tinguiduras, esencias de froitas, lacas, película de cine e de fotografía, chubasqueiros, perfumes, plásticos de piroxilina, rayón, cristais de seguridade, verniz de goma laca e teas impermeables.[5]
Distribución na natureza
O butan-1-ol aparece de forma natural como resultado da fermentación de carbohidratos en varias bebidas alcohólicas, como cervexa,[15] brandy de uvas,[16] viño,[17] e whisky.[18] Detectouse nos volátiles do lúpulo,[19] froito de Artocarpus heterophyllus,[20] leite tratado con calor,[21] melón da variedade musk,[22] queixo,[23] sementes de Vigna unguiculata,[24] e arroz cocido.[25] O 1-butanol tamén se forma durante a fritura profunda con aceite de millo, aceite de semente de algodón, trilinoleína e trioleína.[26]
O butan-1-ol é un dos "alcohois fusel" (do alemán "licor malo"), que son alcohois que teñen máis de dous átomos de carbonos e unha solubilidade significativa en auga.[27] É un compoñente natural de moitas bebidas alcohólicas, aínda que en concentracións baixas e variables.[28][29] Este alcohol, xunto con outros alcohois fusel similares, considérase responsable de resacas graves, aínda que os experimentos en modelos animais non mostran evidencias disto.[30]
O 1-butanol utilízase como ingrediente en aromas procesados e artificiais,[31] e para a extracción de proteínas libres de lípidos da xema do ovo,[32] materiais aromatizantes naturais e aceites vexetais, a produción de extracto de lúpulo para a fabricación de cervexa e como solvente para quitar pigmentos proteicos de concentrado de proteínas de follas húmido.[33]
Metabolismo e toxicidade
A toxicidade aguda do 1-butanol é relativamente baixa, cuns valores de LD50 oral de 790–4.360 mg/kg (rata; valores comparables para o etanol son 7.000–15.000 mg/kg).[6][34][12] Metbolízase completamente en vertebrados de maneira similar ao etanol: a alcohol deshidrocenase converte o 1-butanol en butiraldehido; este convértese entón en ácido butírico pola acción da aldehido deshidroxenase. O ácido butírico pode metabolizarse completamente a dióxido de carbono e auga pola vía da β-oxidación. Na rata, soamente se excreta pola urina o 0,03% dunha dose oral de 2.000 mg/kg.[35] A doses subletais o 1-butanol actúa como un depresor do sistema nervioso central, similar ao etanol: un estudo en ratas indicou que a potencia intoxicante do 1-butanol é unhas 6 veces maior que a do etanol, posiblemente debido á súa transformación máis lenta pola alcohol deshidroxenase.[36]
Outros perigos
O 1-butanol líquido, como é común con outros solventes orgánicos, é extremadamente irritante para os ollos; o contacto repetido coa pel pode causar irritación.[6] Isto crese que é un efecto xenérico do desgraxado. Non se observou ningunha sensibilización da pel. A irritación das vías respiratorias ocorre soamente a concentracións moi altas (>2.400 ppm).[37]
Cun punto de inflamabilidade de 35 °C, o 1-butanol presenta un perigo de incendio moderado: é lixeiramente máis inflamable que o queroseno ou o combustible para diésel pero menos inflamable que moitos outros solventes orgánicos comúns. O efecto depresor sobre o sistema nervioso central (similar á intoxicación por etanol) é un perigo potencial cando se traballa co 1-butanol en espazos pechados, aínda que o limiar de olor (0,2–30 ppm) é moito menor que a concentración á cal habería un efecto neurolóxico.[37][38]
Notas
Véxase tamén
Outros artigos
- Combustible butanol
Ligazóns externas
- International Chemical Safety Card 0111
- "NIOSH Pocket Guide to Chemical Hazards #0076". National Institute for Occupational Safety and Health (NIOSH).
- SIDS Initial Assessment Report for n-Butanol da Organización para a Cooperación e Desenvolvemento Económico (OCDE)
- IPCS Environmental Health Criteria 65: Butanols: four isomers
- IPCS Health and Safety Guide 3: 1-Butanol


