Pszeudouridin
| Pszeudouridin | |||
 | |||
| IUPAC-név | 5-(β-D-Ribofuranozil)pirimidin-2,4(1H,3H)-dion | ||
| Más nevek | Ψ-Uridin, 5-Riboziluracil, β-D-Pszeudouridin, 5-(β-D-Ribofuranozil)uracil | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 1445-07-4 | ||
| PubChem | 15047 | ||
| ChemSpider | 14319 | ||
| KEGG | C02067 | ||
| ChEBI | 17802 | ||
| |||
| |||
| InChIKey | PTJWIQPHWPFNBW-GBNDHIKLSA-N | ||
| Beilstein | 32779 | ||
| UNII | 7R0R6H6KEG | ||
| ChEMBL | 3144027 | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C9H12N2O6 | ||
| Moláris tömeg | 244,20 g/mol | ||
| Megjelenés | Fehér szemcsés por | ||
| Oldhatóság (vízben) | Jól oldódik[pontosabban?] | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
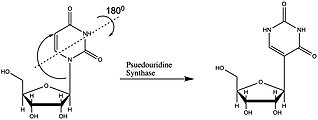
A pszeudouridin (jele: Ψ)[1] az uridin nukleozid izomerje, ahol az uracil szén-szén kötéssel kapcsolódik a ribózhoz a szén-nitrogén glikozidos kötés helyett.
A pszeudouridin a leggyakoribb módosulás a sejtek RNS-ében.[2] A transzkripció és szintézis után az RNS több mint 100 kémiailag különböző vegyülettel módosítható. Ezek szabályozhatják a transzkripció utáni RNS-kifejeződést, akárcsak a négy eredeti nukleotid, és különböző szerepük van például az RNS-transzkripcióban, -lokalizációban és -stabilizációban. Ezek egyike a pszeudouridin, az uridin C5-izomerje, ahol a ribóz 1. és az uracil 5. szénatomja közt van C-C kötés, szemben az uridinnel, ahol C1-N1 kötés található. A C-C kötés nagyobb rugalmasságot biztosít a molekulának.[3]
A pszeudouridin a szerkezeti RNS-ek gyakori, de kevéssé ismert alkotója. A 18 Ψ a Leishmania donovani genomjának peptidil-transzferáz-kódoló részében és az mRNS-csatornában gyorsítja a fehérjeszintézist és a növekedést.[4]
A rRNS-ben és tRNS-ben lévő pszeudouridinről kimutatták, hogy finomhangolja és stabilizálja a helyi szerkezetet, és segít megőrizni a funkciójukat az mRNS-dekódolásban, riboszóma-létrehozásban, feldolgozásban és transzlációban.[3][5][6]
Hatása különböző RNS-eken
tRNS

A Ψ gyakori ebben az RNS-osztályban, és megkönnyíti a gyakori tRNS-szerkezetek létrejöttét. Egy ilyen például a Ψ55-öt tartalmazó TΨC ciklus. A Ψ gyakran található meg a tRNS-ek D- és antikodontörzseiben. A Ψ fizikokémiai tulajdonságai révén stabilizál az U-val lehetetlen szerkezeteket.[3]
A transzláció folyamán a Ψ irányítja a tRNS-molekulák rRNS-sel és mRNS-sel való kölcsönhatásait. A Ψ és egyéb módosított nukleotidok az RNS eredeti szerkezetének jelentős megváltozása nélkül változtatják a tRNS-domének helyi struktúráját, ahol találhatók. Az antikodontörzs-ciklusban (ASL) a Ψ fontos lehet a tRNS-ek riboszómákhoz való megfelelő kapcsolódásához. A Ψ stabilizálja az ASL dinamikus szerkezetét, ezzel erősebb kötést lehetővé téve a 30S riboszómához. Az ASL stabilizált konformációja segíti a megfelelő antikodon-kodon párok fenntartását transzlációkor. Ez a stabilitás növelheti a transzláció pontosságát a peptidkötés-kialakulási sebesség csökkentésével és a nem megfelelő kodon-antikodon párok eltávolításával. A Ψ helyi szerkezeti stabilizációs hatása ellenére a tRNS pszeudouridilációja nem fontos a sejt életképessége szempontjából, és általában nem szükséges az aminoacilációhoz.[3]
mRNS
A Ψ megtalálható a fehérjeszintézis templátjaiban, az mRNS-ekben is. Az mRNS-ben található Ψ megváltoztathatja az UAA, UAG és UGA kodonok specificitását. Ezekben a stopkodonokban mind az U→Ψ, mind az U→C mutáció elősegítik a nonszenszszuppressziót.[7]. A BioNTech és a Pfizer által kifejlesztett SARS-CoV-2-vakcinákban minden U helyén N1-metilpszeudouridin található,[8] egy, a Ψ-nal rokon nukleozid, ahol az N1-atomhoz egy metilcsoport kapcsolódik.
rRNS
A Ψ megtalálható az élőlények minden doménjében és a sejtszervecskék nagy és kis riboszomális alegységeiben. A riboszómában a Ψ a II., IV. és V. doménben stabilizál RNS-RNS vagy RNS-fehérje kölcsönhatásokat. A Ψ biztosította stabilitás segíthet az rRNS-szerkezet kialakulásában és a riboszómaképződésben. A Ψ a helyi struktúrák stabilitását is befolyásolhatja, ami a transzlációkori dekódolás és ellenőrzés sebességét és pontosságát befolyásolja.[3]
snRNS
A Ψ megtalálható az eukarióták spliceoszomális fő snRNS-eiben. A Ψ-származékok az snRNS-ben gyakran állandók maradnak, de taxononként és szervezetenként eltérnek. A Ψ-származékok az snRNS-ben általában a spliceoszóma létrehozásában és funkciójában résztvevő RNS-RNS vagy RNS-fehérje kölcsönhatásokban résztvevő területeken találhatók, Az snRNS-ben lévő Ψ-származékok a spliceoszóma megfelelő szerkezetének létrejöttében játszanak fontos szerepet, ami fontos a pre-mRNS feldolgozáshoz.[3]
Pszeudouridin-szintázok
A pszeudouridinek kotranszkripciós módosítások, vagyis az RNS-keletkezés közben jönnek létre.[9] Az ezt végző fehérjék a pszeudouridin-szintázok (PUS). Ezek minden országban megtalálhatók. A legtöbb kutatás a PUS-ok tRNS-módosító képességével kapcsolatban történt, így az snRNS-t és mRNS-t érintő mechanizmusok nem teljesen tisztázottak. A PUS-ok RNS-specificitása, szerkezete és izomerizációs mechanizmusa eltér. Az eltérő PUS-szerkezetek 5 családba sorolhatók. Ezek aktív szekvenciája és fontos motívumai közösek.[10]
TruA
A TruA domén a tRNS, snRNS és mRNS számos különböző helyén végez módosításokat. Az uridin izomerizációjáról beszélhetünk e családban.[6][11]

A PUS 1 a sejtmagban található, és a tRNS-t módosítja különböző helyeken: az U2 snRNS-ben az U44-nél, valamint az U6 snRNS-ben az U28-ban. Tanulmányok szerint a PUS 1 kifejeződése megnő környezeti stressz hatására, és fontos az RNS-splicing szabályozásához. Továbbá a PUS 1 szükséges a sejtmagban készült tRNS citoplazmába szállításához.[6]
A PUS 2 hasonlít a PUS 1-hez, de a mitokondriumokban található, ahol csak a mito-tRNS U27-ét és U28-át módosítja. E fehérje a mitokondriális tRNS-t módosítja, ahol kevesebb pszeudouridin található, mint más tRNS-ekben. A legtöbb mitokondriumban található fehérjével ellentétben a PUS 2 esetén nem ismert mitokondriális célzószignál (MTS).[6]
A PUS 3 a PUS 1-gyel homológ, de a tRNS-ben máshol módosít (U38/39) a citoplazmában és a mitokondriumokban. Ez a TruA család legjobban megmaradó fehérjéje. A PUS 3 okozta módosulások számának csökkenését észlelték nem megfelelő alakú tRNS-szerkezet esetén. A fehérje az ncRNS-t és az mRNS-t is módosítja a tRNS mellett. Ennek fontosságának megállapításához további kutatás szükséges. A PUS 3 és a PUS 1 módosítja a humán szteroidaktivátor-receptort.[6]
TruB
A TruB családba csak a mitokondriumokban és a sejtmagban található PUS 4 tartozik. A PUS 4 általi U55-módosulások nagyrészt megmaradnak a tRNS hajlatánál. A humán PUS 4-ben nincs jelen a PUA (pszeudouridin-szintáz–archeozin-transz-glikoziláz. A PUS 4 a tRNS T-ágára specifikus. A PUS4 mRNS-módosítására vonatkozó előzetes adatok még nem igazoltak. Ezenkívül egy növényeket fertőző RNS-vírus, a rozsnokmozaik-vírus egy fajtájához is kötődik.[6][12]
TruD
A TruD képes számos RNS-t módosítani, és még nem ismert a különböző RNS-szubsztrátok felismerésének módja. A PUS 7 a 35. helyen módosítja az U2 snRNS-t, hőhatásra e módosítás üteme növekszik. Ezenkívül a citoplazma-tRNS-t a 13., a pre-tRNSTyr-t a 35. helyen módosítja. A PUS 7 specificitása nem függ az RNS-típustól, mivel az mRNS-t is pszeudouridilálja a PUS 7. Az UGUAR RNS-szekvenciában a második U-t cseréli. Az mRNS PUS 7 általi peszudouridilációja növekszik a hőmérséklet növekedésével, mivel a fehérje a sejtmagból a citoplazmába kerül. A módosítás növelheti az mRNS-stabilitást hősokk esetén, mielőtt az RNS a sejtmagba vagy a mitokondriumba megy az RNS, de további tanulmányok szükségesek.[6][11].
RluA
Az RluA domén a szubsztrátot egy hozzá kötődő fehérje és a doménhez való kötések alapján azonosítja.
A PUS 5 nincs jól dokumentálva és elhelyezve, és hasonlóan a PUS 2-höz, nincs mitokondriális jelcélzó szekvenciája. A fehérje a mitokondriális 21S rRNS U2819-ét módosítja. Ezenkívül feltételezések szerint a PUS 5 módosít az mRNS-ben is néhány uridint, de ez még nem bizonyított.
A PUS 6-ban van egy RluA domén, mely a sejtplazmabeli és mitokondriális tRNS-ben csak az U31-et változtatja meg. Ezenkívül az mRNS-t is módosíthatja.[6]
A PUS 8, más néven Rib2 a citoplazmatikus tRNS-t az U32 helyen módosítja. Itt van C-terminális DRAP-deaminázdomén, mely a riboflavin-bioszintézishez kapcsolódik. A riboflavin-szintázhoz kapcsolódó RluA és a DRAP- vagy deaminázdomén teljesen eltérő funkciókkal rendelkezik a fehérjében, és nem ismert, hogy kölcsönhatnak-e. A PUS 8 szükséges az élesztőben, de ez feltehetően a riboflavin-szintézissel áll összefüggésben, nem a pszeudouridin-módosulással.[6]
A PUS 9 azonos helyen katalizál a PUS 8-cal, de a mitokondriális tRNS-ben működik. Ez az egyetlen N-terminális mitokondriáliscélzójel-domént tartalmazó PUS fehérje. Tanulmányok szerint a PUS 9 módosíthat mRNS-eket, ami alacsonyabb szubsztrátspecificitáshoz vezet.[6]
RsuA
Az RsuA az U516 nukleozidot módosítja a 16S rRNS 18-as hélixében.[13] A Ψ516 az egyetlen pszeudouridin a 16S rRNS-ben.[14]
Genomszekvenálási technikák
A pszeudouridin számos különböző technikával azonosítható. Az RNS- és DNS-eltéréseket többek közt folyadékkromatográfia–tömegspektrometriával lehet azonosítani. A tömegspektrometria tömeg és töltés szerint választja szét a molekulákat. Noha az uridin és a pszeudouridin tömege azonos, töltésük eltér. A folyadékkromatográfia a megmaradási időt, vagyis az oszlop elhagyásához szükséges időt használja.[15] A pszeudouridin kémiai módon CMC-vel (N-ciklohexil-N’-β-(4-metilmorfolínium)-etilkarbodiimid) azonosítható, mely az uridint és a pszeudouridint specifikusan különbözteti meg. A CMC a pszeudouridinhez és az uridinhez is kapcsolódik, de az előbbihez erősebben kapcsolódik, mivel a harmadik nitrogén hidrogénkötést képes létesíteni. A pszeudouridin-kötött CMC ezután jelzőmolekulával leképezhető.[16]
Orvosi jelentősége
A pszeudouridin csekély, de jelentős változást idéz elő a közeli cukor-foszfát vázon, és erősíti a báziscsoportosulást. E hatások számos, de nem minden pszeudouridin-részlet biológiai szerepe mögött állhatnak. Bizonyos mutációk a tRNS-ben vagy az rRNS-ben lévő bizonyos pszeudouridin-részletek nélkül transzlációs nehézségeket, lassú növekedést és alulmaradást okozhatnak a vad típusú törzsekkel való versenyben. A pszeudouridin megjelenik a mitokondriális izomelhalásban és a szideroblasztos vérszegénységben. A dyskeratosis congenita és a Hoyeraal–Hreidarsson-szindróma két ritka örökletes betegség, melyeket a DKC1, a pszeudouridin-szintáz diszkerint kódoló gén mutációi okoznak. A pszeudouridin szabályozza a virális lappangási folyamatokat is a HIV-fertőzéseknél.[17] A pszeudouridilációt ezenkívül összefüggésbe hozták az anyai ágon öröklött diabétesszel és siketséggel (MIDD). Itt egy pontmutáció a mitokondriális tRNS-ben megakadályozza egy nukleotid pszeudouridilációját, megváltoztatva a tRNS harmadlagos szerkezetét, ami instabilabb tRNS-hez vezethet, ami hibákat okozhat a mitokondriális transzlációban.[17]
Vakcinákban
Ha a szintetikus mRNS-ben pszeudouridin van az uridin helyett, a módosult mRNS gyengébb immunválaszt kelt a receptorokban. Ez hasznossá teszi az mRNS-vakcinákban a pszeudouridint. Ezt a tulajdonságot Karikó Katalin és Drew Weissman 2005-ben fedezték fel.[18]
Az N1-metil-pszeudouridin még gyengébb immunválaszt eredményez, mint a Ψ, és javítja a transzlációs képességet,[19] ezért a Pfizer–BioNTech- és a Moderna-vakcinák is N1-metil-pszeudouridint használnak a Ψ helyett.[19]
Jegyzetek
Fordítás
Ez a szócikk részben vagy egészben a Pseudouridine című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.