Szén-dioxid
A szén-dioxid (CO2, régi helyesírással széndioxid) standard körülmények között légnemű, gáz-halmazállapotú vegyület, a szén egyik oxidja. A tiszta levegő mintegy 0,040% (térfogatszázalék) szén-dioxidot tartalmaz. (Korrigált 2016-os átlag: 404 ppm)[2] Ez a mennyiség az elmúlt évtizedekben jelentősen növekedett (100 éve még kb. 280 ppm volt). A szén-dioxid üvegházhatású gáz, amely a klímakutatók 97%-a szerint hozzájárul a globális felmelegedéshez.[3][4] A jelenlegi globális felmelegedés 80%-áért az emberi szén-dioxid-kibocsátás okolható. A klímakutatók többsége szerint a 450 ppm-es légköri szén-dioxid-koncentráció már visszafordíthatatlan következményekkel járna az éghajlatváltozás szempontjából.[5] A légkörbe számos forrásból kerülhet; szén és széntartalmú anyagok égése, állatok, növények és mikroorganizmusok légzése során keletkezik. Nagy mennyiségben keletkezik ipari folyamatok során is (cement- és acélgyártás, metanol-, ammónia- és monomerszintézis). A nettó CO2-kibocsátás csökkentésének két stratégiai fontosságú pillére, melyek intenzív kutatások tárgyát képezi: egyrészt az említett folyamatok hatékonyságának, szelektivitásának növelése,[6][7][8] másrészt pedig a CO2 konverziója üzemanyagokká,[9] illetve szerves vegyületekké.[10][11][12][13] Jelentős mennyiségű szén-dioxid kerül a levegőbe a vulkanizmus során és a tengerek kötött szén-dioxidjából is.A szén-dioxid −78,5 °C-on fagy meg (kondenzál), szilárd halmazállapotának neve szárazjég. A szárazjeget a hűtőipar is felhasználja, de látványosságként is alkalmazzák, ahogy felmelegedve a folyékony halmazállapot kihagyásával gőzzé válik, azaz szublimál.
| Szén-dioxid | |
 2 dimenziós szerkezet | 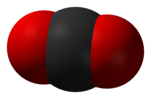 3 dimenziós szerkezet |
| IUPAC-név | szén-dioxid |
| Más nevek | mustgáz szárazjég (szilárd) |
| Kémiai azonosítók | |
| CAS-szám | 124-38-9 |
| EINECS-szám | 2046-96-9 |
| RTECS szám | FF6400000 |
| ATC kód | V03AN02 |
| Gyógyszer szabadnév | carbon dioxide |
| Kémiai és fizikai tulajdonságok | |
| Kémiai képlet | CO2 |
| Moláris tömeg | 44,01 g/mol |
| Megjelenés | színtelen, szagtalan gáz |
| Sűrűség | 1,98 kg/m³, gáz (273 K) 1600 kg/m³, szilárd |
| Olvadáspont | −78 °C (195 K), szublimál |
| Forráspont | −57 °C (216 K), nyomás alatt |
| Oldhatóság (vízben) | 0,145 g/100 ml (25 °C) |
| Savasság (pKa) | 6,35 és 10,33 |
| Viszkozitás | 0,07 cP −78 °C-on |
| Kristályszerkezet | |
| Kristályszerkezet | kvarcszerű |
| Dipólusmomentum | nulla |
| Veszélyek | |
| EU osztályozás | nincsenek veszélyességi szimbólumok[1] |
| NFPA 704 | |
| R mondatok | nincs[1] |
| S mondatok | S9, S23, S36[1] |
| Lobbanáspont | nem gyúlékony |
| Rokon vegyületek | |
| Rokon vegyületek | szén-monoxid szénsav szén-diszulfid |
| Az infoboxban SI-mértékegységek szerepelnek. Ahol lehetséges, az adatok standardállapotra (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. Az ezektől való eltérést egyértelműen jelezzük. | |
Kémiai és fizikai tulajdonságok


Színtelen, kis koncentrációban szagtalan, a levegőnél nagyobb sűrűségű. Ha a belélegzett levegő a normál koncentráció többszörösét (néhány %-ot) tartalmazza szén-dioxidból, akkor azt enyhén savanykásnak érezzük, ez a koncentráció azonban már veszélyes, mert fulladást okozhat.
A tiszta szén-dioxid nem éghető, az égést nem táplálja, ezt a tulajdonságát használják ki a tűzoltó-készülékeknél, és a gyertyalángos próbánál a pincék ellenőrzésénél: ha a gyertya kialszik, akkor a szén-dioxid veszélyes mennyiségben van jelen a helyiségben. Reakciókban kevésbé vesz részt. Vízben kismértékben oldódik (0,145 g/100 ml), a vízzel gyengén savas szénsavat képez.
A légnemű halmazállapotú vegyület normál légköri nyomás (1 bar) alatt ‒78,5 °C-on fagy meg, a folyékony halmazállapot kihagyásával. 5,1 barnál nagyobb nyomáson előállítható viszont folyékony szén-dioxid is. A gázpalackokban is ilyen állapotban tárolják. A szén-dioxid szilárd halmazállapotát szárazjégnek nevezzük.
A sűrűsége standard hőmérsékleten és nyomáson körülbelül 1,98 kg/m³, másfélszer akkora, mint a Föld légköréé. A szén-dioxid molekula (O=C=O) két kettős kovalens kötést tartalmaz és egyenes az alakja. Hiába alkotják eltérő elemek, a szimmetrikus szerkezet okán apoláris. A molekulának alapállapotban nincs elektromos dipólusmomentuma, azonban különböző határszerkezeteknél lehetséges, hiszen a különböző vibrációk[14] során alakja megváltozik – ennek okán soroljuk az üvegházhatású gázok közé. Nem reaktív és nem gyúlékony.
Felhasználása, gyártása, keletkezése
Jelen van az üdítőkben, szénsavas italok alkotórészeként, tűzoltó palackokban, hegesztésnél aktív védőgázként. Az ipari célokra használt szén-dioxid palackok ISO szabvány szerinti színe szürke.[15]
A koffeint a zöld, nedves kávébabból szuperkritikus extrakcióval vonják ki, amihez oldószernek folyékony szén-dioxidot használnak.[16]
Szilárd formában (szárazjég) hűtőanyagként is használják, például amikor gyors mélyhűtésre van szükség, vagy nem áll rendelkezésre hűtőgép.
A szén-dioxidot nagyobb mennyiségben bányásszák (Magyarországon például 1982-ig a Kisalföldön, Mihályi mellett később), illetve kőolaj- és földgázkutakból tör fel mint melléktermék. Az így kapott gázt tisztítják, majd nagy nyomáson cseppfolyósítják, és ebben a formában tárolják, szállítják. A cseppfolyós szén-dioxid hirtelen nyomáscsökkenésekor történő gyors párolgás (párolgáshő) annyira lehűti az anyagot, hogy az megfagy, és szárazjég keletkezik.
Az élelmiszeriparban szívesen használják a tankerjesztésű pezsgők erjedése során keletkező szén-dioxidot, ugyanis a pezsgő természetes habzásához kevesebb is elég, mint amennyi abban keletkezik. A felesleget üdítőkhöz, sörgyártásnál használják fel.
A VIII. Magyar Gyógyszerkönyvben Carbonei dioxidum néven hivatalos.
A biogáz egyik jelentős alkotórésze.
Az égési folyamatokban keletkezik szerves anyagok, pl. fosszilis tüzelőanyagok elégetésekor, mint légkörbe kibocsátott füstgáz.
A must forrásakor is keletkezik szén-dioxid, amit ilyenkor mustgáznak neveznek, és ami a pincében a földhöz közel összegyűlve oxigénhiányos állapotot idézhet elő, rosszullétet, szédülést, hányingert, mentális zavarokat okozva, nagyobb koncentrációban pedig fulladáshoz vezethet. Ennek megelőzésére hagyományosan gyertyát alkalmaztak, annak lángját azonban csak 14 százaléknyi szén-dioxid-tartalom oltja ki, miközben akár a 9 százalékos koncentráció is öt-tíz perc alatt végzetes lehet a pincében tartózkodóra.[17]
A szén körforgása
A földköpeny széntartalma szén-dioxid formájában kerül a légkörbe; döntően a vulkáni, illetve utóvulkáni működés eredményeként.
A növények képesek a levegő szén-dioxidját megkötni, az abból kivont szenet a szervezetükbe beépíteni: ez a folyamat az asszimiláció. A fa égésekor a nagy füstöt nem a szén-dioxid okozza, hanem a sok elpárolgó víz és a nitrogén-oxidok. A legkülönfélébb élőhelyek szén-dioxid-mérlege gyakorlatilag 0: az elpusztuló növények és állatok szerves vegyületeit a mikroorganizmusok lebontják, és a soklépcsős folyamat eredményeként felszabaduló szén-dioxid visszajut a levegőbe. A földtörténetben a bioszféra széntartalma folyamatosan temetődik el. Egy része fosszilis tüzelőanyaggá alakul, legnagyobb része azonban a mészvázú tengeri állatok révén betemetődik, és karbonátos kőzetekké alakul. Minden mai mészkő és dolomit előfordulás valamikor légköri szén-dioxid volt, valamint jelentős mennyiségű karbonáttartalmú ásvány is ismert. A legtöbb szén-dioxidot tehát nem az eltemetett szerves anyag vonja ki a légkörből, hanem a mészvázú állatok: ezek mészváza ugyanis (a tengerekben a karbonátkompenzációs szint felett) eltemetődve mészkővé alakul, azaz mineralizálódik. A szén-dioxid globális forgalmába az ember nemcsak a fosszilis tüzelőanyagok elégetésével avatkozik be, hanem meglehetősen sok szén kivonásával is, amikor a különféle szerves anyagokból növekvő mennyiségben tartós használati tárgyakat (bánya-, talp- és épületfákat, bútorokat, könyveket stb.) készít. Ezek jelentős része a használat után sem kerül vissza a biológiai körforgásba, hanem hulladéklerakókban eltemetjük őket – ezekben idővel, lassan majd mineralizálódnak.
A földtörténeti ókorban zömmel a páfrányok maradványaiból alakultak ki a nagy energiatartalmú, a szénbányászatban jelentős feketekőszén-telepek, majd zömmel a földtörténeti újkorban a kevésbé szenesedett, kisebb kalóriatartalmú barnakőszén-telepek.
Több-kevesebb szén található a kőolaj- és földgázszármazékokban, a legjobb (legkörnyezetbarátabb) arány a metánban (CH4) van: C:H=1:4. Ennél sokkal rosszabb az arány a hosszabb szénláncokban: a cetán (C16H34) esetében már csak C:H=1:2,125. Ezzel tehát jelentősen csökkenthető a CO2-kibocsátás, de már az is jelentős, ha PB gáz (propán (C3H8), bután (C4H10)) helyett metánt használunk.
Üvegházhatás
Az égéssel légkörbe bocsátott füstgázoknak és pl. anaerob bomlási folyamatokban keletkező metánnak jelentős napfény elnyelő tulajdonsága van, amiért „üvegházhatásúnak” nevezzük. Többek között a légkör utóbbi korokban mért melegedését, a klímaváltozást okozzák. Ezért a technológiák közül igyekeznek kiváltani az égéses energiafejlesztést, illetve ipari technológiákat.
Jegyzetek
Források
- szén-dioxid-kvóták – Túl olcsón adtuk a szén-dioxid-kvótákat? – mno.hu Archiválva 2007. szeptember 27-i dátummal a Wayback Machine-ben (2007. április 24.)
- 10 százalékos csökkentést kér a magyar szén-dioxid kvótamennyiségből az Európai Bizottság. (2007. április 24.)
- Vita lesz a szén-dioxid-kibocsátási tervről Archiválva 2007. szeptember 27-i dátummal a Wayback Machine-ben (2007. április 19.)