கார்பனீராக்சைடு
| கார்பனீராக்சைடு கார்பன்-டை-ஆக்சைடு | |
|---|---|
  | |
| வேறு பெயர் | கார்போனிக் அமில வளிமம், carbonic anhydride, உலர் பனிக்கட்டி(திண்மம்) |
| வேதியியல் குறியீடு | CO2 |
| மோலார் திணிவு | 44.0095(14) கி/மோல் |
| திண்ம நிலை | உலர் பனிக்கட்டி, கார்போனியா |
| தோற்றம் | நிறமற்ற வளிமம் |
| சிஏஎசு எண் | [124-38-9] |
| இயல்புகள் | |
| அடர்த்தியும் நிலையும் | 1600 கிகி/மீ³, திண்மம் approx. 1.98 கிகி/மீ³, gas at STP |
| நீரில் கரைதன்மை | 1.45 கிகி/மீ³ |
| பதங்கமாதலின் மறைவெப்பம் | 25.13 கிஜூ/மோல் |
| உருகுநிலை | −57 °C (216 K), அமுக்கத்தில் |
| கொதிநிலை | −78 °C (195 K), பதங்கமாதல் |
| அமிலத்தன்மை (pKa) | 6.35 உம் 10.33 உம் |
| பாகுநிலை | 0.07 cP at −78 °C |
| அமைப்பு | |
| மூலக்கூற்று வடிவம் | linear |
| பளிங்கு அமைப்பு | குவாட்ஸ்-போல |
| இருமுனைவுத் திருப்பம் | பூச்சியம் |
| ஆபத்துக்கள் | |
| MSDS | External MSDS |
| Main ஆபத்துக்கள் | asphyxiant, irritant |
| என்.எப்.பி.ஏ 704 | (நீர்மம்) |
| R-சொற்றொடர்கள் | R: As, Fb |
| S-சொற்றொடர்கள் | S9, S23, S36(நீர்மம்) |
| வேதிப்பொருள்களின் நச்சு விளைவுகளின் பதிவேடு எண் | FF6400000 |
| துணைத் தரவுப் பக்கம் | |
| அமைப்பும் இயல்புகளும் | n, εr, etc. |
| Spectral data | UV, IR, NMR, MS |
| தொடர்பான சேர்வைகள் | |
| தொடர்புடைய ஒட்சைட்டுக்கள் | கார்பன் மோனாக்சைடு கார்பன் கீழாக்சைடு இருகாபன் ஓரொட்சைட்டு காபன் மூவொட்சைட்டு |
| Except where noted otherwise, data are given for materials in their standard state (at 25 °C, 100 kPa) Infobox disclaimer and references | |
கார்பனீராக்சைடு (carbon dioxide) என்பது CO2 என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட ஒரு நிறமற்ற வாயுவாகும். காபனீரொக்சைட்டு, கார்பன்-டை-ஆக்சைடு, கரியமிலவாயு என்று பல்வேறு பெயர்களாலும் இதை அழைக்கிறார்கள். கார்பனீராக்சைடு உலர் காற்றைக் காட்டிலும் 60% அடர்த்தி மிகுந்ததாகும். ஒரு கார்பன் அணு இரண்டு ஆக்சிசன் அணுக்களுடன் சகப்பிணைப்பு மூலம் இரட்டைப் பிணைப்புகளால் பிணைக்கப்பட்டு கார்பன் டை ஆக்சைடு மூலக்கூறு உருவாகிறது. நடைமுறையில் இவ்வாயு புவியின் வளிமண்டலத்தில் 0.04 சதவீதம் என்ற குறைந்த சுவடு அளவில் உள்ளது. கன அளவில் இந்த அளவு மில்லியனுக்கு 410 பகுதிகள் ஆகும். தொழிற்புரட்சிக்கு முன்னால் இந்த அளவு மில்லியனுக்கு 280 பகுதிகள் மட்டுமே இருந்தது. எரிமலைகள், சூடான நீரூற்றுகள், வெந்நீர் உற்றுகள் போன்றவை கார்பனீராக்சைடின் இயற்கை மூலங்களில் சிலவாகும். நீர் மற்றும் அமிலங்களின் செயல்பாடுகளால் கார்பனேட்டு பாறைகளில் இருந்து இது விடுவிக்கப்படுகிறது. கார்பன் டை ஆக்சைடு தண்ணீரில் கரையக்கூடியதாக இருப்பதால், அது நிலத்தடி நீரில், ஆறுகள் மற்றும் ஏரிகள், பனிக்கட்டி, பனிப்பாறைகள் மற்றும் கடல்நீர் ஆகியவற்றில் இயல்பாகவே கலந்துள்ளது. பெட்ரோலியம் மற்றும் இயற்கை எரிவாயுவிலும் கார்பன் டை ஆக்சைடு கலந்துள்ளது. சாதாரணமாகக் காணக்கூடிய அடர்த்தி நிலைகளில் இது நெடியற்றுக் காணப்படுகிறது. இருப்பினும், அதிகமான செறிவுகளில் கூர்மையான அமிலத் தன்மையான நெடியைக் கொண்டதாக உள்ளது [1].
கார்பன் டை ஆக்சைடுக்கு கார்பன் சுழற்சியில் கிடைக்கக்கூடிய கார்பன் ஆதாரமாக இருக்கின்றது. வளிமண்டல கார்பன் டை ஆக்சைடு பூமியிலுள்ள உயிர்களுக்கான முதன்மை கார்பன் ஆதாரமாக இருக்கிறது. தொழிற்புரட்சிக்கு முன்னர் வளிமண்டலத்தில் இருந்த கார்பன்-டை-ஆக்சைடின் அடர்த்தி உயிரினங்களின் ஒளிச்சேர்க்கை மற்றும் புவியியல் நிகழ்வுகள் மூலம் ஒழுங்கு படுத்தப்பட்டுள்ளன. தாவரங்கள், பாசிகள் மற்றும் சயனோபாக்டீரியாக்கள் ஒளி ஆற்றலின் உதவியோடு கார்பன் டை ஆக்சைடு, நீர் ஆகியவற்றைப் பயன்படுத்தி ஒளிச்சேர்க்கை முறையில் உணவு தயாரிக்கின்றன. இவை இவ்வினையின் கழிவுப் பொருளாக ஆக்சிசனை வெளிவிடுகின்றன [2].
காற்றைச் சுவாசித்து வாழ்கின்ற அனைத்து உயிரினங்களும் கார்பன் டை ஆக்சைடை வெளிவிடுகின்றன. கார்போவைதரேட்டுகளையும் லிப்பிடுகளையும் சுவாசித்தல் மூலம் வளர்ச்சிதை மாற்றமடையச் செய்து ஆற்றலை இவை உற்பத்தி செய்கின்றன [3]. மனிதன் உட்பட காற்றைச் சுவாசிக்கும் அனைத்து உயிர்னங்களும் கார்பன் டை ஆக்சைடை காற்றில் கலக்கச் செய்கின்றன. மீனின் செதிள்களில் இருந்து இவ்வாயு தண்ணீரில் விடப்படுகிறது. கரிம வேதியியல் பொருட்கள் சிதைவடையும் போதும், ரொட்டி, பீர் மற்றும் மதுபானங்கள் தயாரிக்கையில் சர்க்கரையை நொதிக்கச் செய்யும் போதும் கார்பன் டை ஆக்சைடு உருவாகிறது. இயற்கை எரிவாயு, பெட்ரோலியம், புதைப்படிவுகள், நிலக்கரி, மரம் போன்ற கரிமப் பொருட்கள் காற்றில் எரியும் போதும் கார்பன் டை ஆக்சைடு உருவாகிறது. பேரளவில் நிகழ்த்தப்படும் ஆக்சிசனேற்ற செயல்முறைகளில் விரும்பத்தகாத உடன் விளைபொருளாக கார்பன் டை ஆக்சைடு உருவாகிறது. உதாரணமாக அக்ரைலிக் அமிலம் தயாரிப்பில் ஆண்டுக்கு 5 மில்லியன் டன்கள் கார்பன் டை ஆக்சைடு உடன் விளை பொருளாக உருவாகிறது [4][5][6][7].
பற்றவைத்தல் மற்றும் தீ அணைப்பு கருவிகளில் கார்பன் டை ஆக்சைடு ஒரு மந்த வாயுவாகப் பயன்படுத்தப்படுகிறது. காற்று துப்பாக்கிகள் மற்றும் எண்ணெய் மீட்பு கருவி ஆகியவற்றில் அழுத்தமளிக்கும் வாயுவாகப் பயன்படுத்தப்படுகிறது. ஓர் இரசாயன மூலப்பொருளாகவும் மற்றும் காபியில் உள்ள காபீனை நீக்க உதவும் திரவ கரைப்பான் ஆகவும், மீ உலர்த்தியாகவும் கார்பன் டை ஆக்சைடு வாயு பயன்படுத்தப்படுகிறது [8]. குடிநீர் மற்றும் கார்பனேற்றப்பட்ட பானங்களிலும் பொங்குதலுக்காக கார்பன் டை ஆக்சைடு சேர்க்கப்படுகிறது. குளிரூட்டிகளில் பயன்படும் உலர் பனிக்கட்டியாகவும் திட கார்பன் டை ஆக்சைடு பயன்படுகிறது.
புதைபடிவ எரிபொருட்களின் பயன்பாடு காரணமாக வளிமண்டலத்தில் வெளியிடப்பட்ட கார்பன் டை ஆக்சைடு 2013 ஆம் ஆண்டில் எடுக்கப்பட்ட கணக்கெடுப்பின்படி 99.4% CO2 உமிழ்வு என பிரதிநிதித்துவப்படுத்துகிறது [9]. பூமியின் வளிமண்டலத்தில் மிகவும் குறிப்பிடத்தக்க நீண்டகால பைங்குடில் வாயுவாக கார்பன் டை ஆக்சைடு உள்ளது. தொழில்துறை புரட்சி, மானுடவியல் உமிழ்வுகள், புதைபடிவ எரிபொருள்கள் பயன்பாடு, காடுகள் அழித்தல் ஆகிய செயல்பாடுகளால் வளிமண்டலத்தில் கார்பன் டை ஆக்சைடின் செறிவு வேகமாக அதிகரித்து புவி வெப்பமடைவதற்கு வழிவகுத்தது. தண்ணீரில் கரைந்து கார்போனிக் அமிலமாக உருவாகும் என்பதால் கடல் நீரை இது அமிலமாக்கியும் வருகிறது.
வரலாறு

தனித்தியங்கும் ஒரு பொருளாக முதன்முதலில் விவரிக்கப்பட்ட வாயு கார்பன் டை ஆக்சைடு ஆகும். 1640[10] ஆம் ஆண்டில் யான் பாப்டிசுட்டு வான் எல்மோண்ட் என்ற வேதியியலாளர் ஒரு மூடிய கலனுக்குள் கல்கரியை எரித்து பரிசோதித்தார். அது எரிந்து முடிந்தபின் கிடைத்த சாம்பல் பயன்படுத்திய கல்கரியைக் காட்டிலும் எடை குறைவாக இருந்தது. குறைவான எடை ஒரு வாயுவாக வெளியிருக்கலாம் என்று அவர் முடிவு செய்தார்[11].இசுக்காட்லாந்திய வேதியியலர் யோசப் பிளாக் கார்பன் டை ஆக்சைடின் பண்புகளை மேலும் ஆராய்ச்சி செய்தார். கால்சியம் கார்பனேட்டு எனப்படும் சுண்னாம்புக் கல்லை அமிலங்களுடன் சேர்த்து சூடுபடுத்தினாலும் கார்பன் டை ஆக்சைடு உருவாகும் எனக் கண்டறிந்தார். இவ்வாயு காற்றை விட கனமானது என்று கூறினார். சுண்ணாம்பு நீர் வழியாக இதை ஊதும் போது கால்சியம் கார்பனேட்டு வீழ்படிவாகிறது என்பதையும் அறிந்தார். விலங்குகளின் சுவாசத்தாலும் நுண்ணுயிர்களின் நொதித்தலாலும் கார்பன் டை ஆக்சைடு உருவாகிறது என்பதை நிருபித்தார்.
1772 ஆம் ஆண்டில் ஆங்கில நாட்டு வேதியியலாளர் யோசப் பிரீசுட்லி என்பவர் சுண்ணாம்புக் கல் மற்றும் கந்தக அமிலம் மூலம் இதை செயற்கை முறையில் உருவாக்கினார். 1823 இல் அம்ப்ரி டேவி மற்றும் மைக்கேல் ஃபாரடே ஆகியோரால் முதன்முதலில் கார்பன் டை ஆக்சைடு உயர்ந்த அழுத்தங்களில் திரவமாக்கப்பட்டது. 1835 இல் திரவ கார்பன் டை ஆக்சைடு ஒரு அழுத்த கொள்கலன் மூலம் குறைந்த வெப்பநிலையில் திடப்பொருளாக மாற்றப்பட்டது. அதுவே திடப்பனி என்று அழைக்கப்பட்டது[12][13].
தன்மைகள்
- நீரில் கரைந்து கார்பானிக் அமிலத்தைக் கொடுக்கும். இவ்வமிலம் நீல லிட்மசை சிவப்பாக மாற்றும்.
- CO
2 + H
2O H
H
2CO
3
- மேலும் நீற்றுச் சுண்ணாம்பு நீரை பால் போல் மாற்றும்.[14]
பௌதிகப் பண்புகள்
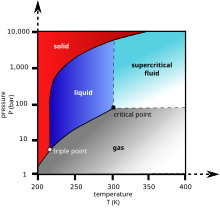

காபனீரொக்சைட்டு நிறமற்ற வாயுவாகும். குறைந்த செறிவில் மணமற்றது. அதிக செறிவில் அமிலங்களுக்குரிய மணத்தைக் கொண்டிருக்கும். சாதாரண வெப்பநிலையிலும் அமுக்கத்திலும், காபனீரொக்சைட்டு 1.98 kg/m3 அடர்த்தியைக் கொண்டிருக்கும். இவ்வடர்த்தியானது வளியின் அடர்த்தியின் 1.67 மடங்காகும். (வளியை விட அடர்த்தி கூடியது)சாதாரண வளிமண்டல அமுக்கத்தில் காபனீரொக்சைட்டுக்கு திரவ நிலை கிடையாது. -78.5 °C (−109.3 °F; 194.7 K) வெப்பநிலையில் இது நேரடியாக திண்ம நிலையை அடைந்து விடும். திண்ம காபனீரொக்சைட்டும் இவ்வெப்பநிலைக்கு மேல் பதங்கமாகி விடும்.

திண்ம காபனீரொக்சைட்டை உலர் பனிக்கட்டி என அழைப்பர். வளிமண்டல அமுக்கத்தை விட 5.1 மடங்கு அமுக்கத்திலேயே காபனீரொக்சைட்டின் திரவ நிலையை அவதானிக்க முடியும்.
பிரித்தெடுத்தலும் உற்பத்தியும்
நான்கு பிரதான கைத்தொழில்களின் (சுவட்டு எரிபொருள், ஐதரசன் உற்பத்தி, அமோனியா உற்பத்தி, நொதித்தல்) பக்க விளைபொருளாக காபனீரொக்சைட்டு விளங்குகின்றது. வளியை வடிக்கட்டல் மூலம் இதனை உற்பத்தி செய்தல் நட்டத்துக்குரியதாகும்.
ஐதரோகார்பன்களை எரிக்கும் போது காபனீரொக்சைட்டு விளைபொருளாகக் கிடைக்கின்றது.
- CH
4+ 2 O
2→ CO
2+ 2 H
2O
சுண்ணக்கல்லை 850 °C வெப்பநிலையில் சூடாக்கி நீறாத சுண்ணாம்பை உற்பத்தி செய்யும் போது பக்க விளைபொருளாகக் காபனீரொக்சைட்டு கிடைக்கின்றது.
- CaCO
3→ CaO + CO
2
இரும்பு உற்பத்தியில் இரும்பின் ஒக்சைட்டுகளை காபன்மொனொக்சைட்டு அல்லது கார்பனால் தாழ்த்தும் போது பக்க விளைபொருளாகக் காபனீரொக்சைட்டு கிடைக்கின்றது.
- Fe
2O
3+ 3 CO → 2 Fe + 3 CO
2
அற்கஹோல் உற்பத்தியில் காபனீரொக்சைட்டும் அற்கஹோலும் மதுவத்தால் சீனி நொதிக்கப்பட்ட பின் கிடைக்கின்றன.
- C
6H
12O
6 → 2 CO
2+ 2 C
2H
5OH
ஆய்வுகூட உற்பத்தி
உலோக கார்பனேட்டுகளும் அனேகமான அமிலங்களும் தாக்கமடையும் போது காபனீரொக்சைட்டு வெளிப்படுகின்றது. உதாரணமாக கால்சியம் கார்பனேட்டு (முட்டைக்கோது, சிப்பியோட்டில் பெறலாம்) மற்றும் ஐதரோகுளோரிக் அமிலம் தாக்கமடையும் தாக்கமானது கால்சியம் குளோரைட்டு மற்றும் காபனீரொக்சைட்டு ஆகியவற்றை விளைவுகளாகத் தோற்றுவிக்கும்.
- 2 HCl+ CaCO
3→ CaCl
2+ H
2CO
3
தொழிற்சாலை உற்பத்தி
காபனீரொக்சைட்டைத் தனியாக உற்பத்தி செய்வதை விட பக்கவிளைபொருளாகப் பெறுவதே இலாபம் ஈட்டித் தரக்கூடியதாகும். எனவே காபனீரொக்சைட்டை பக்கவிளைபொருளாகத் தோற்றுவிக்கும் தொழிற்சாலைகளில் இது உற்பத்தி செய்யப்படு திண்ம உலர் பனியாகவோ அல்லது அமுக்கப்பட்ட வாயுவாகவோ விற்பனை செய்யப்படுகின்றது.
பயன்கள்

தீயணைக்கும் பொருளாகவும் காற்றேற்றம் பெற்ற குளிர்பானங்களிலும், சலவை சோடா மற்றும் ரொட்டி சோடா தயாரிக்கவும் பயன்படுகிறது. குளிர்சாதனப் பெட்டிகளிலும் உலர் பனிக்கட்டி பயன்படுகிறது. சர்க்கரை தொழிற்சாலைகளில் நீர்ம கார்பன் டை ஆக்சைடு பயன்படுகிறது.[14]
சுற்றுசூழல் பாதிப்புகள்
- கார்பன் டை ஆக்சைடு சுற்றுச்சூழலில் குறிப்பிடத்தக்க பாதிப்புகளை உருவாக்குகின்றன.மேலும் இது சூரியனின் வெப்ப கதிர்வீச்சினை உறிஞ்சி பூமியின் மேற்பரப்பு வெப்பநிலையை உயர்த்தும் பசுமை இல்ல வாயுக்களில் முக்கியமான ஒன்றாகத் திகழ்கிறது. இதுவரையிலான காலகட்டத்தில் தாவரங்களின் ஒளிச்சேர்க்கை மற்றும் விலங்குகள் சுவாசித்தல் மூலம் கார்பன் சுழற்சி ஒரு சமநிலையில் வைக்கப்பட்டிருந்தது. எனினும் தொழில் புரட்சிக்கு பிறகு கார்பன் சார்ந்த எரிபொருட்கள் எரிக்கப்படுவதால் வளிமண்டல கார்பன் டை ஆக்சைடு செறிவு வேகமாக அதிகரித்து உலக வெப்பமயமாதலில் முக்கிய காரணியாக விளங்குகிறது.மேலும் இது தண்ணீரில் கரைந்து வலிமைகுறைந்த கார்பானிக் அமிலமாக மாறுகிறது இதனால் கடல் அமிலமாதல் நிகழ்கிறது.
நச்சுத்தன்மை

பொதுவாக 1% க்குக் குறைந்த அளவில் காபனீரொக்சைட்டு நச்சுத்தன்மை அற்றது. (சாதாராண வளியில் 0.036% தொடக்கம் 0.039% வரை வேறுபடும்). ஒக்சிசன் போதியளவில் காணப்பட்டாலும் காபனீரொக்சைட்டு செறிவு 7% - 10% இடையில் காணப்படுமானால் கண் பார்வை குறைதல், மயக்கத் தன்மை, தலை நோ என்பன ஏற்படும். ஏனெனில் இரத்தத்தில் ஒக்சிசனின் இடத்தை காபனீரொக்சைட்டு பிடித்துக்கொள்வதலாகும்.

