Batterioterapia fecale
La batterioterapia fecale, detta anche trapianto fecale o trapianto di feci o infusione di probiotici umani (HPI) o trapianto di microbioma fecale, è un trattamento medico non farmacologico, in fase sperimentale, utilizzato con una certa efficacia in soggetti affetti da colite pseudomembranosa sostenuta dal Clostridioides difficile,[1][2][3] o anche in caso di colite ulcerosa refrattaria alle comuni terapie.[4]
| Batterioterapia fecale | |
|---|---|
Terapia non farmacologica  Reperto anatomopatologico di una mucosa del colon che mostra le lesioni tipiche della colite pseudomembranosa. | |
| MeSH | D000069467 |
| MedlinePlus | 007703 |
Scopo di questa innovativa terapia è quello di ripristinare l'ecologia microbica e l'omeostasi del colon, reintroducendo un microbiota umano sano (equilibrato), prelevato da feci di un donatore sano o in certi casi da feci "donate" precedentemente dallo stesso soggetto (omotrasfusione o ripristino autologo della flora gastrointestinale - ARGF).[5]
Storia
Lewin (2001) riporta che "... il consumo di feci fresche di cammello viene raccomandato dai beduini come rimedio per la dissenteria batterica, la sua efficacia è probabilmente attribuibile all'antibiotico subtilisina prodotto dal Bacillus subtilis); questa procedura è stata usata anche da soldati tedeschi in Africa durante la seconda guerra mondiale."[6]
La tecnica usata per la batterioterapia fecale è stata sviluppata sin dal 2003 dal team del dott. Thomas J. Borody a Sydney, Australia, come trattamento alternativo nella colite pseudomembranosa, specie nelle forme recidivanti e resistenti alla terapia con vancomicina.[4][7] Nello stesso anno un gruppo di ricerca dell'SMDC Medical Center della Clinica di Duluth capoluogo della Contea di St. Louis, Minnesota pubblica un lavoro che per la prima volta descrive la metodica su 18 casi di pazienti con infezione da C. difficile.[8]
Questa strategia terapeutica è stata a lungo usata nell'allevamento animale, per evitare la salmonellosi nei polli.[9]Inoltre, è utilmente utilizzata su topi di laboratorio germ free (naturalmente privi di germi) per rendere umanizzate le feci degli stessi animali, in modo da poter studiare gli effetti di farmaci o altro sull'ecosistema umano riprodotto nel topo.[10]
Razionali teorici
I razionali teorici di questa tecnica terapeutica vanno ricercati nelle ricerche più avanzate, che riguardano l'uso dei probiotici e gli studi sul microbioma, che è l'insieme di microrganismi: batteri, archeobatteri, funghi, virus, presenti in un ambiente specifico (in questo caso l'ambiente fecale). Infatti è noto come una buona ecologia microbica possa respingere il sovra-sviluppo di organismi patogeni. Nel colon si stimano vi siano 500 a circa 1000 specie diverse di batteri per un totale di 1013 batteri.[11]Infatti, il microbioma che va considerato come entità biologica a sé stante, che è simbionte con l'organismo ospite. Il complesso dei batteri o microbioma agisce nel mantenere l'omeostasi dell'organismo ospite; questa flora microbica è relativamente innocua se reintrodotta nell'organismo.[12][13][14][15][16]
Non si sa molto del ruolo del microbioma, però molte specie animali erbivore e no,[17] è noto hanno abitudini coprofaghe, probabilmente ciò per avere un doppio ciclo digestivo (digestione doppia).[18][19]
Il vantaggio principale della batterioterapia fecale è quello di ridurre il rischio di indurre resistenza agli antibiotici in batteri ad alta patogenicità. Altri vantaggi sono un costo relativamente basso, la mancanza di necessità di farmaci e una buona efficacia (da confermare con studi più ampi) per il trattamento di casi in cui esiste una resistenza agli antibiotici.Il metodo è tuttavia ancora considerato un trattamento di "ultima spiaggia" per la sua maggiore invasività rispetto al trattamento convenzionale con antibiotici, e per i potenziali rischi di trasmissione di infezioni (batteri, virus, prioni, parassiti intestinali).[20]
Anche se l'esperienza con batterioterapia fecale è ancora limitata, i risultati pubblicati sulla procedura mostrano che oltre 80 pazienti hanno dimostrato un tasso medio di successo superiore al 90%. La batterioterapia fecale è una procedura a basso contenuto tecnologico, facile da eseguire, che può rompere i cicli di uso ripetuto di antibiotici, cosa che a sua volta riduce il rischio di fenomeni di antibiotico resistenza. Inoltre, ha anche un potenziale risparmio di costi, rispetto alle ripetute somministrazioni di antibiotici con le necessarie ospedalizzazioni.[20]
Colite pseudomembranosa
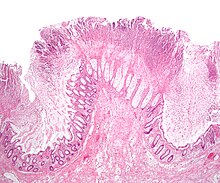
L'importanza come patogeno del Clostridioides difficile (CDI) è stata stabilita con certezza a partire dal 1978,[21] ma l'importanza di questa tecnica nel trattamento della colite pseudomembranosa nasce anche dal fatto che la sua epidemiologia è recentemente cambiata, ponendo seri problemi diagnostici e terapeutici per i clinici. I tassi di infezione (CDI) sono raddoppiati da 31/100.000 persone del 1996 a 61/100.000 nel 2003.[22]Nel corso degli ultimi anni, infatti, la gravità e la mortalità dell'infezione da C. difficile CDI, è in aumento e ciò è stato attribuito a un nuovo ceppo virulento di C. difficile conosciuto come il ceppo North American Pulsed-field gel electrophoresis type 1 (NAP-1) o anche PFGE tipo BI/NAP1 ribotipo 027.[23]L'unicità del ceppo NAP-1 consiste nella sua maggiore produzione di tossine A e B e nella produzione di una tossina binaria e nella sua resistenza al fluorochinolone.[24][25][26][27][28][29]
Ceppi NAP1 ipervirulenti di C. difficile sono responsabili della maggioranza delle recenti epidemie nosocomiali, inoltre, l'uso diffuso di antibiotici di tipo fluorochinolone può avere facilitato la proliferazione selettiva di questo ceppo. Il ceppo NAP1 è anche in grado di provocare, con più alta probabilità, la colite grave e fulminante caratterizzata da leucocitosi marcata, insufficienza renale acuta, instabilità emodinamica, e megacolon tossico.[30]
Il C. difficile è diventato la più comune causa batterica di diarrea nosocomiale.[31][32] L'infezione da Clostridioides difficile provoca la CDAD (Clostridioides difficile Associated Disease) o più raramente la colite pseudomembranosa, che è una grave condizione medica causa di una significativa morbidità e mortalità, specialmente nei pazienti sottoposti a trattamento con antibiotici o pazienti con cancro sottoposti a trapianto di cellule staminali,[32] o anche in pazienti sottoposti a radioterapia.[33][34]
L'aumento della frequenza delle infezioni da parte di ceppi di C. difficile ipervirulenti ha portato a complicazioni e fallimenti terapeutici con il trattamento tradizionale a base di metronidazolo e vancomicina.[35][36]
Pur con un'esperienza clinica limitata, preliminarmente, la batterioterapia fecale ha mostrato di garantire elevati tassi di guarigione clinica, tuttavia, mancano oggi per questo approccio terapeutico studi clinici randomizzati.Malgrado ciò secondo ricercatori dell'Università del Minnesota, Minneapolis:
«il trapianto ha avuto un impatto drammatico sulla composizione della flora intestinale del paziente. ... Il cambiamento nella composizione batterica è stato accompagnato da risoluzione dei sintomi del paziente. ... i batteri del donatore hanno occupato rapidamente le loro nicchie con conseguente ripristino sia della struttura che della funzione delle comunità microbiche presenti.»
Colite ulcerosa

Nella colite ulcerosa, nessun agente patogeno è stato trovato finora. Ma l'efficacia della batterioterapia fecale, in questo caso, suggerirebbe che la causa della colite ulcerosa può essere dovuta a una precedente infezione di un agente patogeno rimasto sconosciuto.Infatti l'infezione iniziale può probabilmente essersi risolta naturalmente in questi pazienti; ma talvolta, uno squilibrio della flora intestinale del colon potrebbe portare a una riacutizzazione infiammatoria (il che spiegherebbe la natura ciclica e ricorrente di questa malattia). Questo ciclo sembra, almeno in molti casi, essere interrotto dalla ri-colonizzazione del colon del paziente con di un complesso batterico (probiotico) prelevato da un intestino sano (eterotrapianto).[7]Alcuni medici ritengono che questo trattamento effettuato in soggetti in buone condizioni, è sicuro e molti pazienti potrebbero trarre beneficio da questa innovativa terapia.[38][39]
Uno studio del maggio 2011, ha confermato la buona disponibilità dei pazienti e di genitori di bambini affetti da colite ulcerosa ad accettare questo trattamento, una volta superato l'iniziale disgusto per la metodica.
«Sebbene il disgusto iniziale e il "fattore puah" sono stati citati in maniera uniforme, queste preoccupazioni sono state più che compensate da benefici percepiti.»
Nel 2013 un'altra ricerca conferma la validità della terapia con uno studio prospettico pilota su dieci soggetti di 7-21 anni. Questo studio dimostra la tollerabilità e l'efficacia della terapia di trapianto fecale nella colite ulcerosa; infatti, in sette soggetti c'è stata una remissione clinica entro una settimana e sei su nove hanno mantenuto la remissione clinica a un mese.[41]
Altre patologie studiate
Attualmente la tecnica è studiata in soggetti affetti da malattia di Parkinson, diabete, obesità[42], sindrome del colon irritabile, malattie infiammatorie croniche intestinali, sclerosi multipla, porpora trombocitopenica idiopatica, insulinoresistenza.[43] e sindrome da fatica cronica[44]
Procedura
Classica


La scelta migliore per il donatore è un parente in buona salute, che sia stato testato per una vasta gamma di agenti batterici e parassitari.[45] Normalmente si usano le feci di un parente stretto del paziente, dopo aver indagato ed escluso la presenza di batteri o virus o parassiti contagiosi tipo: salmonella, virus dell'epatite, ecc.[46][47][48]
La procedura comporta a volte 5-10 giorni di trattamento con clisteri, fatti con il microbiota umano delle feci del donatore. La maggior parte dei pazienti guarisce dopo un solo trattamento.[senza fonte] I clisteri sono preparati e somministrati in ambiente ospedaliero per garantire tutte le attenzioni necessarie.
L'infusione del probiotico può anche essere fatta attraverso un sondino nasogastrico, fornendo i batteri direttamente all'intestino tenue.[8][49] Dopo la raccolta, il campione di feci viene lavorato e preparato in un laboratorio clinico sotto forma di una sospensione liquida, che viene successivamente instillata nel tratto gastrointestinale superiore attraverso un sondino nasogastrico che risale fino a livello del duodeno.[50]
I due metodi possono essere combinati per ottenere il miglior risultato. Regolari controlli vanno fatti fino a un anno dopo la procedura.
ARGF (ripristino autologo della flora gastrointestinale)
Una forma modificata di batterioterapia fecale, attualmente in fase di sviluppo, è il ripristino autologo della flora gastrointestinale - ARGF.[51]Questa metodica è più sicura, più efficace e più facile da somministrare. Un campione fecale autologo (proprio), è fornito dal paziente prima del trattamento medico e conservato in frigorifero. Se il paziente sviluppa successivamente la patologia da C. difficile il campione viene estratto con soluzione salina e filtrata. Il filtrato è liofilizzato e il solido risultante viene racchiuso in capsule gastroresistenti. La somministrazione delle capsule ripristina la flora del colon propria del paziente, cosa utile per combattere l'infezione da C. difficile eventualmente subentrata. Questa procedura permette di evitare i rischi della classica batterioterapia fecale, dove una eventuale infezione potrebbe essere trasmessa al paziente dal donatore e, inoltre, si eviterebbe la necessità di somministrare il campione di feci nel duodeno attraverso una sonda gastrica.[52]
Efficacia
L'efficacia della metodica nel prevenire le recidive della colite pseudomembranosa è stimata attorno a 90%[53][54]Uno studio del dicembre del 2011 conferma questi dati mostrando un'efficacia della metodica del 92%, nel prevenire la diarrea o un'ulteriore recidiva in un gruppo di 26 pazienti con infezioni ricorrenti da C. difficile.[55]
Uno studio finlandese del 2011 sottolinea come il trattamento con gli antibiotici delle infezioni ricorrenti da Clostridioides difficile (CDI) porta a recidive nel 50% nei pazienti. L'utilizzo del trapianto fecale durante una procedura di esame colonscopico previa una preparazione intestinale con il polietilenglicole (lavaggio), ha consentito, con un follow-up a un anno, un risoluzione dell'89% dei casi di colite pseudomembranosa recidivante, sottolineando che i casi trattati erano causati da un ceppo di C. difficile (tipo 027) particolarmente virulento.[56]
Sempre nel dicembre del 2011, su 317 pazienti, una review ha mostrato un'efficacia della metodica del 92% mostrando anche scarsi effetti collaterali.[57]
Nel 2015 viene pubblicato uno studio di confronto con la vancomicina che mostra la superiorità della batterioterapia fecale rispetto a questo antibiotico.[58]
Stato dell'arte
Inizialmente dopo un seminario di studi (workshop) presso la Yale University nel 2005 e nel 2007, sono state emanate e pubblicate raccomandazioni generali e specifiche, pubblicate e validate nel 2008, riguardo all'uso clinico dei probiotici (Recommendations for probiotic use. - J Clin Gastroenterol. 2008).[59]In questa importante pubblicazione sono state emanate numerose raccomandazioni per il trattamento delle malattie infiammatorie intestinali (MICI) e la sindrome dell'intestino irritabile. Gli autori in questo workshop hanno raccomandato cautela nell'uso della tecnica del trapianto fecale a causa del limitato numero di studi.
Successivamente nell'aggiornamento del dicembre del 2011 di questo atto di consenso (consensus opinion), prodotto sempre dalla Yale University School of Medicine con la partecipazione di 10 esperti, viene confermato e validato il valore terapeutico della batterio terapia fecale, o trapianto di microbioma fecale, nelle forme di diarrea da C. difficile resistenti.[60]
Una importante metanalisi pubblicata nell'aprile del 2013 e condotta su 11 RCT per un totale di 273 pazienti con colite pseudomembranosa trattati con trapianto fecale dimostra che: 245 pazienti hanno ottenuto la guarigione clinica senza eventi avversi significativi, con un follow up di settimane o anni, con un miglior risultato per l'impianto del materiale per via rettale. Tuttavia gli autori concludono sulla necessità di ulteriori studi per poter suggerire in modo generalizzato questa metodica terapeutica.[61]
Ruolo dell'appendice
Il rischio di recidive di colite pseudomembranosa sembra essere strettamente legato alla presenza o meno dell'appendice, poiché questa probabilmente svolge un ruolo attivo nel ripristino della normale microflora intestinale dopo un ciclo di terapia con antibiotici. Infatti, essa fa parte del tessuto linfoide associato alla mucosa (MALT) e la sua integrità è condizione necessaria per consentire una ottimale produzione del biofilm protettivo della mucosa colica.In uno studio del dicembre 2011 infatti, si dimostra come la probabilità di infettarsi con il Clostridiun difficile, in soggetti sottoposti ad appendicectomia, è del 48 per cento, contro l'11 di chi conserva ancora l'appendice, dimostrando così una relazione diretta tra la recidiva della colite pseudomembranosa e l'appendicectomia.[62]
Note
Bibliografia
Riviste
- TJ. Borody, EF. Warren; S. Leis; R. Surace; O. Ashman, Treatment of ulcerative colitis using fecal bacteriotherapy., in J Clin Gastroenterol, vol. 37, n. 1, luglio 2003, pp. 42-7, PMID 12811208.
- G. Bazzocchi, P. Gionchetti; PF. Almerigi; C. Amadini; M. Campieri, Intestinal microflora and oral bacteriotherapy in irritable bowel syndrome., in Dig Liver Dis, 34 Suppl 2, settembre 2002, pp. S48-53, PMID 12408440.
- P. Gionchetti, F. Rizzello; A. Venturi; P. Brigidi; D. Matteuzzi; G. Bazzocchi; G. Poggioli; M. Miglioli; M. Campieri, Oral bacteriotherapy as maintenance treatment in patients with chronic pouchitis: a double-blind, placebo-controlled trial., in Gastroenterology, vol. 119, n. 2, agosto 2000, pp. 305-9, PMID 10930365.
- A. Khoruts, J. Dicksved; JK. Jansson; MJ. Sadowsky, Changes in the composition of the human fecal microbiome after bacteriotherapy for recurrent Clostridium difficile-associated diarrhea., in J Clin Gastroenterol, vol. 44, n. 5, pp. 354-60, DOI:10.1097/MCG.0b013e3181c87e02, PMID 20048681.
- W. Glauser, Risk and rewards of fecal transplants., in CMAJ, vol. 183, n. 5, marzo 2011, pp. 541-2, DOI:10.1503/cmaj.109-3806, PMID 21398226.
- P. Patrick Basu, A. Dinani; K. Rayapudi; T. Pacana; NJ. Shah; H. Hampole; NV. Krishnaswamy; V. Mohan, Rifaximin therapy for metronidazole-unresponsive Clostridium difficile infection: a prospective pilot trial., in Therap Adv Gastroenterol, vol. 3, n. 4, luglio 2010, pp. 221-5, DOI:10.1177/1756283X10372985, PMID 21180604.
- H. Tilg, A. Kaser, Gut microbiome, obesity, and metabolic dysfunction., in J Clin Invest, vol. 121, n. 6, giugno 2011, pp. 2126-32, DOI:10.1172/JCI58109, PMID 21633181.
- JC. Kwon, MK. Kang; SH. Kim; SM. Choi; HJ. Kim; WS. Min; DG. Lee, A case of pseudomembranous colitis after voriconazole therapy., in Yonsei Med J, vol. 52, n. 5, settembre 2011, pp. 863-5, DOI:10.3349/ymj.2011.52.5.863, PMID 21786455.
- PJ. Turnbaugh, VK. Ridaura; JJ. Faith; FE. Rey; R. Knight; JI. Gordon, The effect of diet on the human gut microbiome: a metagenomic analysis in humanized gnotobiotic mice., in Sci Transl Med, vol. 1, n. 6, novembre 2009, pp. 6ra14, DOI:10.1126/scitranslmed.3000322, PMID 20368178.
- AA. MacConnachie, R. Fox; DR. Kennedy; RA. Seaton, Faecal transplant for recurrent Clostridium difficile-associated diarrhoea: a UK case series., in QJM, vol. 102, n. 11, novembre 2009, pp. 781-4, DOI:10.1093/qjmed/hcp118, PMID 19726581.
- E. Pasche, D. Teodoro; J. Gobeill; P. Ruch; C. Lovis, QA-driven guidelines generation for bacteriotherapy., in AMIA Annu Symp Proc, vol. 2009, 2009, pp. 509-13, PMID 20351908.
Tesi e dissertazioni
- Cramer, Julie L., Fecal Bacteriotherapy for the Treatment of Recurrent Clostridium Difficile Infection in Adults, in Pacific University - School of Physician Assistant Studies. Theses, Dissertations and Capstone Projects, 2010. URL consultato il 27 agosto 2011 (archiviato dall'url originale il 4 marzo 2016).
Testi
- Timothy R. Koch, Colonic diseases[collegamento interrotto], Humana Press, 2003, pp. 152–, ISBN 978-0-89603-961-2.
- I. W. Fong, Emerging Issues and Controversies in Infectious Disease, Springer, 18 dicembre 2008, pp. 209–, ISBN 978-0-387-84840-2.
- Ellen Sandbeck, Green barbarians: how to live bravely on your home planet, Simon and Schuster, 5 gennaio 2010, pp. 201–, ISBN 978-1-4165-7182-7.
- Sonia Michail e Philip M. Sherman, Probiotics in Pediatric Medicine, Springer, 2009, pp. 187–, ISBN 978-1-60327-288-9.
- Dimitris Charalampopoulos e Robert A. Rastall, Prebiotics and probiotics science and technology, Springer, 20 giugno 2009, pp. 836–, ISBN 978-0-387-79057-2.
- Jordi Rello e Marin Kollef, Infectious diseases in critical care, Springer, 19 aprile 2007, pp. 194–, ISBN 978-3-540-34405-6.
- Elizabeth Lipski, Digestive wellness, McGraw-Hill Professional, 28 ottobre 2004, pp. 267–, ISBN 978-0-07-144196-4.
- Daniel K. Onion, The Little Black Book of Primary Care, Jones & Bartlett Learning, 16 luglio 2010, pp. 276–, ISBN 978-0-7637-7369-4.
Collegamenti esterni
- www.cdc.gov C. difficile - Healthcare-associated Infections (HAIs), su cdc.gov.
- Center for Digestive Diseases, Sydney, Australia, su cdd.com.au.
- New York Times articolo del 2010: fecal bacteriotherapy, su nytimes.com.
- Trapianto fecale per curare l'infezione da Clostridium difficile, su scienceblogs.com. URL consultato il 25 gennaio 2011 (archiviato dall'url originale il 1º gennaio 2011).
- Trapianto di microbiota: il sito in italiano di approfondimento, su trapiantomicrobiota.weebly.com.
- Trapianto fecale e malattia di Parkinson, su newscientist.com.
- Bacteriotherapy - Trattamento del Clostridium difficile, su bacteriotherapy.org. URL consultato il 25 agosto 2011 (archiviato dall'url originale il 23 marzo 2011).
- Video: ABC TV Catalyst, 14 July 2011 - Batterio terapia fecale per l'infezione da Clostridium difficile, su abc.net.au.

