电解
电解(electrolysis)是指将電流通过电解质溶液或熔融态物质,而在阴極和阳极上引起氧化还原反应的过程。电化学电池在接受外加电压(即充电過程)时,會发生电解过程。
舉例



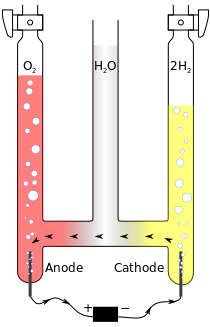
以下為在酸性水溶液中電解水的例子。
- 正極(anode):
- 負極(cathode):
總反應式
在這個反應中,陽極產生放出電子的反應(氧化),陰極產生取得電子的反應(還原)。
歷史
電解的英文electrolysis是由希臘文ἤλεκτρον[ɛ̌ːlektron]「琥珀」和λύσις [lýsis] 「溶解」而來。
应用
电解可用来进行各种电化学的制备和生产,是重要的工业过程。
法拉第定律
法拉第第一電解定律
電解過程中,在電極發生化學反應而產生的物質的質量與通過電解質的電量成正比。
- 電量=電流×時間(Q=I·t)
法拉第第二電解定律
當相同電量通過不同電解質時,沉積在電極的元素的摩尔數與它的離子所帶的電荷大小成反比。


