Rak mokraćne bešike
Rak mokraćne bešike je bilo koji od nekoliko tipova kancera koji nastaju iz tkiva mokraćne bešike.[3] Simptomi uključuju krv u mokraći, bol kod mokrenja i bol u krstima.[1]
| Rak mokraćne bešike (Kancer mokraćnog mjehura) 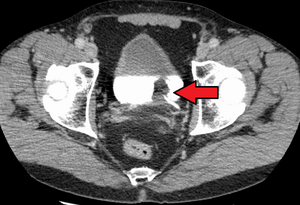 | |
|---|---|
| Klasifikacija i vanjski resursi | |
| ICD-10 | C67 |
| ICD-9 | 188 |
| OMIM | 109800 |
| DiseasesDB | 1427 |
| MedlinePlus | 000486 |
| eMedicine | radio/711 med/2344 med/3022 |
| MeSH | [http://www.nlm.nih.gov/cgi/mesh/2010/MB_cgi?field=uid&term=D001749
|
Znaci i simptomi

Rak mokraćne bešike karakteristično uzrokuje krvarenje u mokraći, koje može biti vidljivo ili se može otkriti samo mikroskopom. Krvarenje u mokraći je najčešći simptom karcinoma mokraćne bešike i bezbolna je. Vidljiva krv u urinu može biti kratkotrajna, a možda će biti potreban test urina kako bi se potvrdila nevidljiva krv. Između 80 i 90% ljudi sa rakom bešike u početku je imalo vidljivu krv. Krv u mokraći može biti uzrokovana i drugim stanjima, poput kamenaca u mokraćnoj bešici ili ureteru, infekcije, bolesti bubrega, karcinoma bubrega ili vaskularnih malformacija, iako ta stanja (osim karcinoma bubrega) obično bi bilo bolna.
Ostali mogući simptomi uključuju bol tokom mokrenja, često mokrenje ili osjećaj potrebe za mokrenjem, a da to ne mogu učiniti. Ovi znakovi i simptomi nisu specifični za rak mokraćnog mjehura, a mogu biti uzrokovani i nekanceroznim stanjima, uključujući infekcije prostate, prekomjerno aktivni mokraćni mjehur ili cistitis. Neki rijetki oblici karcinoma mokraćne bešike poput urahalnog adenokarcinoma proizvode mucin, koji se zatim izlučuje urinom zbog čega postaje gust.[4]
Osobe sa uznapredovalom bolešću mogu imati bolove u karlici ili kostima,otok donjih ekstremiteta ili bol u trbuhu.[5] Rarely, a palpable mass can be detected on physical examination.[6]
Uzroci
Pušenje duhana je glavni poznati doprinositelj raka mokraćne bešike; u većini populacija pušenje je povezano s preko polovine slučajeva karcinoma mokraćnog mjehura kod muškaraca i trećinom slučajeva kod žena,[7] međutim ove proporcije smanjile su se posljednjih godina otkad ima manje pušača u Evropi i Sjevernoj Americi.[8] Postoji gotovo linearna veza između trajanja pušenja (u godinama), godina okupljanja i rizika od raka mokraćne bešike. Može se primijetiti rizični plato kod pušenja oko 15 cigareta dnevno (što znači da su oni koji puše 15 cigareta dnevno imaju približno jednak rizik kao i oni koji puše 30 cigareta dnevno). Pušenje (cigara, lula, egipatska lula i bezdimni duhan) u bilo kojem obliku povećava rizik od karcinoma bešike.[9] Prestanak pušenja smanjuje rizik. Rizik od raka mokraćne bešike smanjuje se za 30% u roku od 1–4 godine i nastavlja smanjivati za 60% nakon 25 godina nakon prestanka pušenja.[10] Međutim, bivši pušači vjerovatno će uvijek biti izloženiji većem riziku od raka mjehura u odnosu na ljude koji nikada nisu pušili. Pasivno pušenje također predstavlja rizik.[11][12]
Potrošnja opijuma trostruko povećava rizik od raka mokraćne bešike, a istovremena upotreba opijuma i pušenja povećava rizik od raka bešike pet puta u poređenju sa općom populacijom.[13]
Oko 30 % tumora bešike vjerovatno je posljedica profesionalne izloženosti kancerogenima na radnom mestu. Profesionalna ili slučajna izloženost sljedećim supstancama implicirana je kao uzrok raka mokraćnog mjehura:
Rizična zanimanja su vozači autobusa, gumari, molerski radnici, automehaničari, kožari (uključujući cipele), kovači, postavljači mašina i mehaničari.[19][20] Hairdressers are thought to be at risk as well because of their frequent exposure to permanent hair dyes.[21]
Infekcija parazitom Schistosoma haematobium (bilharzija ili shistosomijaza) može prouzrokovati rak mokraćnog mjehura, posebno tipa pločastih ćelija.[22] Shistosomina jaja izazivaju hronično upalno stanje u zidu mokraćnog mjehura što rezultira fibrozom tkiva.[23] Kod ljudi sa shistosomijazom u uzorcima urina otkriveni su viši nivoi N-nitrozo spojeva.[24] N-nitrozo spojevi uključeni su u patogenezu raka mokraćne bešike koji je povezan sa shistosomijazom. Uzrokuju oštećenje alkilacije DNK, posebno guanina u adenin tranzicijske mutacije u HRAS i p53 tumor-supresorskog gena.[25] Mutacije p53 otkrivene su u 73% tumora, BCL-2 mutacije čine 32%, a njihova kombinacija 13%.[26] Ostali uzroci karcinoma pločastih ćelija bešike uključuju hronične kateterizacije kod ljudi sa ozljedama kičmene moždine i istorijat liječenja ciklofosfamidom.[27][28]
Dokazano je da konzumacija aristolohijske kiseline prisutne u mnogim kineskim biljnim lijekovima uzrokuje urotelni karcinom i otkazivanje bubrega.[29] Aristolohijska kiselina aktivira peroksidazu u urotelu i uzrokuje transverzijsku mutaciju u TP53 genu tumorskog supresora.
Ljudi koji se podvrgnu vanjskoj radioterapiji (EBRT) zbog raka prostate imaju veći rizik od razvoja invazivnog karcinoma mokraćnog mjehura.[30]
Pored ovih glavnih faktora rizika, postoje i brojni drugi modificirani faktori koji su manje snažn (tj. povećavaju rizik od oko 10–20%) povezani s rakom mokraćne bešike, naprimjer, gojaznost.[31] Iako se ovi mogu smatrati manje uticajnim, smanjenje rizika u općoj populaciji i dalje se može postići smanjenjem prevalencije niza manjih faktora rizika.[32]
Genetika
Mutacije u genimA FGFR3, TP53, PIK3CA, KDM6A, ARID1A, KMT2D, HRAS, TERT, KRAS, CREBBP, RB1 I TSC1 mogu biti povezane sa nekim slučajevima karcinoma bešike.[33][34][35] Delecije dijelova ili cijelog hromosoma 9 su česte kod karcinoma mokraćne bešike.[36] Poznato je da rak niskog stepena sadrži mutacije u RAS-putu i genu receptora 3 faktora rasta fibroblasta (FGFR3), koji oba imaju ulogu u MAPK/ERK-putu. Mutacije gena p53 i RB implicirane su u visokorazredne mišićno invazivne tumore.[37] Oko 89 % mišićno invazivnih karcinoma ima mutacije u preradi hromatina i gena koji modificiraju histone.[38]Delecija obje kopije gena GSTM1 umjereno povećava rizik od raka mokraćne bešike. Genski proizvod GSTM1 glutation S-transferaza M1 (GSTM1) učestvuje u procesu detoksikacije karcinogena kao što su policiklični aromatski ugljikovodici pronađeni u cigaretnom dimu.[39] Slično tome, mutacije u NAT2 (N-acetiltransferaza) povezane su s povećanim rizikom od raka mokraćne bešike. N-acetiltransferaza pomaže u detoksikaciji karcinogena slično aromatskim aminima (također prisutnim u cigaretnom dimu).[40] Razni jednonukleotidni polimorfizmi gena PSCA na hromosomu 8 pokazali su da povećavaju rizik od karcinoma bešike. Regija promotora gena PSCA ima regiju odgovora na androgen. Gubitak reaktivnosti ove regije na androgene pretpostavlja se kao uzrok većeg broja agresivnih tumora u žena (za razliku od muškaraca koji imaju veću količinu androgena).[41]
Mišićno invazivni rak mokraćne bešike heterogene je prirode. Općenito se mogu genetički klasificirati u bazni i lumenski podtip. Izmjene baznog podtipa pokazuju promjene koje uključuju RB i NFE2L2, a lumenski imaju promjene u genima FGFR3 i KDM6A.[42] Bazni podtipovi podeljeni su na baznu i klaudinsku grupu niskog tipa i agresivni su i ispoljavaju metastaze, ali odgovaraju na hemoterapije zasnovane na platini. Lumenski podtip se može podijeliti na p53 i lumenski. Tumori slični p53 lumenskog podtipa, iako nisu toliko agresivni kao bazni, pokazuju rezistenciju na hemoterapiju.[43]
Dijagnoza
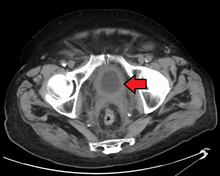
Do sada je najbolja dijagnoza stanja mokraćnog mjehura putem cistoskopije, što je postupak u kojim se uvodi fleksibilna ili kruta cijev (zvana cistoskop) koja nosi kameru i razne instrumente u mokraćni mjehur kroz mokraćovod. Fleksibilni postupak omogućava vizuelni pregled mokraćnog mjehura, poduzimanje manjih popravnih radnji i uzimanje uzoraka sumnjivih lezija za biopsiju. Kruti cistoskop koristi se u općoj anesteziji u operacijskoj sali i može podržati popravni rad i biopsije, kao i opsežnije uklanjanje tumora. Za razliku od papilarnih lezija, koje rastu u šupljinu bešike i lahko su vidljive, lezije karcinoma in situ l su ravne i nejasne. Otkrivanje karcinomskih lezija in situ zahtijeva više biopsija iz različitih područja unutrašnjeg zida mjehura.[44] U otkrivanju karcinoma in situ može pomoći fotodinamička detekcija (cistoskopija plavog svjetla). U fotodinamičkoj detekciji, boja se ukaplje u bešiku uz pomoć katetera. Ćelije raka preuzimaju ovu boju i vidljive su pod plavim svjetlom, pružajući vizualne tragove na područjima koja se biopsiraju ili reseciraju.[45]
Međutim, vizuelna detekcija u bilo kojem gore navedenom obliku nije dovoljna za utvrđivanje patološke klasifikacije, tipa ćelija ili stadija prisutnog tumora. Takozvana hladna čaša biopsija tokom uobičajene cistoskopije (krute ili fleksibilne) neće biti dovoljna ni za patološko stupnjevanje. Dakle, vizuelnu detekciju mora pratiti transuretralna operacija. Postupak se naziva transuretralna resekcija tumora mokraćne bešike (TURBT). Dalje, prije i poslije TURBT-a, treba provesti rektumski i vaginski bimanualni pregled, kako bi se procijenilo postoji li opipljiva masa ili je tumor fiksiran („vezan“) za zid karlice. Informacije o patološkoj klasifikaciji i određivanju stadija dobijene TURBT postupkom od suštinske su važnosti za donošenje odgovarajućeg izbora rutina koje slijede i/ili praćenja.[46]
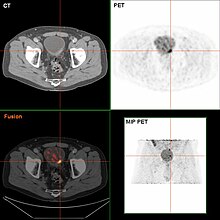
Ako se na TURBT-u otkrije invazivni ili visok stepen (uključujući karcinom in situ), rak, trebaju se izvoditi magnetska rezonanca (MRI) i/ili CT abdomena i karlice ili urogram i CT-grudi ili rendgen grudnog košsa radi stadiranja bolesti i zbog širenja raka (metastaze). Povećanje nivoa alkalne fosfataze bez dokaza o bolesti jetre treba procijeniti na metastaze u kostima, pomoću skeniranja kosti.[47] Although 18 F-fluorodeoksiglukoza (FDG) -pozitronska emisiona tomografija (PET) / CT je istražena kao održivi metod za inscenaciju, a ne postoji konsenzus koji bi podržao njegovu ulogu u rutinskim kliničkim procjenama.
Citologija urina može se dobiti u praznom urinu ili u vrijeme cistoskopije („pranje mokraćnog mjehura“). Citologija nije vrlo osjetljiva na tumore niskog ili prvog stupnja (negativni rezultat ne može pouzdano isključiti rak mokraćne bešike), ali ima visoku specifičnost (pozitivan rezultat pouzdano otkriva rak mokraćne bešike).[48] Postoje noviji neinvazivni markeri vezani za urin koji su dostupni kao pomoćna sredstva u dijagnozi raka mokraćne bešike, uključujući ljudski protein faktor komplementa H, protein visoke molekulske težine karcinoembrionski antigen i protein nuklearne matrice 22 (NMP22).[49] U Sjedinjenim Državama, Uprava za hranu i lijekove (FDA odobrila je NMP22, NMP22 BladderChek i UroVysion testove za otkrivanje i nadzor karcinoma mokraćne bešike, a testovi ImmunoCyt, BTA-TRAK i BTA-STAT odobreni su samo za nadzor. BTA-STAT i BladderChek mogu se izvoditi u klinici, a drugi se rade u laboratoriji.[50][51] Ostali neinvazivni testovi na bazi urina uključuju CertNDx test za rak mokraćnog mjehura, koji otkriva FGFR3 mutaciju i test za rak mokraćnog mjehura (UBC), koji je sendvič ELISA za Citokeratin 8 / 18 fragment . Slično tome, NMP22 je sendvič ELISA, a NMP22 BladderChek je štapić za mjerenje, imunski test, oba otkrivaju protein jedarnog mitotskog aparata (NuMA) tumorski marker (tip proteina jedarne matrice).[52] UroVysion je fluorescenna in situ hibridizacija koja otkriva aneuploidiju u hromosomima 3, 7, 17 i deleciju lokusa 9p21.[53][54] ImmunoCyt je imunofluorescentni test koji otkriva glikozilirane CEA i Mucinu slične antigene (M344, LDQ10, 19A11). BTA-STAT je šipka za mjerenje, imunski test za detekciju ljudskog faktoru komplementa H srodnog proteina. BTA-TRAK je sendvič ELISA koji takođe otkriva protein povezan sa ljudskim faktorom komplementa H.Osetljivost u biomarkerima je bila u rasponu od 0,57 do 0,82 i specifičnosti od 0,74 do 0,88. Biomarkeri su bolje prošli kada se koriste u kombinaciji s citologijom urina, nego kada se koriste samostalno. Međutim, preciznost otkrivanja je loša za karcinome niskog stupnja i još uvijek se propušta 10% karcinoma. Sadašnje smjernice ne preporučuju upotrebu mokraćnih biomarkera za otkrivanje i nadzor.[55]
Klasifikacija

| Tip | Relativna incidencija | Podtipovi |
|---|---|---|
| Karcinom tranzicijskih ćelija | 95%[56][57] | Papilarni (70%[56]) |
| Nepapilarni (30%[56]) | ||
| Karcinom netranzicijskih ćelija | 5% [56][57] | Karcinom pločastih ćelija, adenokarcinomi, sarkomi, maloćelijski karcinomi i sekundarne naslage od karcinoma na drugim mjestima u tijelu.[57] |
Nepapilarni karcinom uključuje karcinom in situ (CIS), mikroinvazivni karcinom i otvoreno invazivni karcinom.[58] Carcinoma in situ (CIS) invariably consists of cytologically high-grade tumour cells.[59]
Karcinom tranzicijskih ćelija može se diferencirati (25%) u svoje varijante.[58][60][61] Kada se gledaju pod mikroskopom, papilarni karcinomi tranzicijskih ćelija mogu se predstaviti u svom tipskom obliku ili kao jedna od njegovih varijacija (pločasta, diferencijacija žlijezde ili mikropapilarna varijanta). U nastavku su navedene različite varijacije nepapilarnog karcinoma tranzicijskih ćelija.
| Varijanta | Histologija | Nepapilarni slučajevi (%) | Implikacije[62] |
|---|---|---|---|
| Pločasta diferencijacija | Prisustvo međućelijskih mostova ili keratinizacija | 60% | Ishodi slični uobičajenok karcinomu tranzicijskih ćelija |
| Zrnasta diferencijacija | Prisustvo u pravom žjezdanom prostoru | 10% | |
| Sarkomatoidnna žarišta | Prisustvo i u epitelnoj i u mezenhimskoj diferencijaciji | 7% | Klinički agresivan[63] |
| Mikropapilarna varijanta | Podsjeća papilarni serozni karcinom jajnika ili na mikropapilarni karcinom dojke ili pluća [64] | 3,7% | Klinički agresivna, preporučuje se rana cistektomija |
| Urotelni karcinom s malim tubulima i mikrocistnom formom | Prisustvo cista u rasponu mikroskopske veličine do 1–2 mm | Rijedak | |
| Limfoepiteliomoliki karcinom | Podsjeća na limfoepiteliom nazofarinksa | ||
| Limfomolike i plazmacitoidne varijante | Maligne ćelije podsjećaju na ćelije malignog limfoma ili plazmacitoma | ||
| Ugniježđena varijanta | Histološki izgledaju slično von Brunnovim gnijezdastim | Može se pogrešno dijagnosticirati kao dobroćudna von Brunnov gnijezdsti ili neinvazivni papilarni urotelni karcinom niskog stupnja | |
| Urotelni karcinom gigantskih ćelij | Prisustvo gigantskih ćelija epitelnog tumora i izgleda slično Gigantskoćelijski karcinom pluća | ||
| Trofoblastna diferencijacija | Prisustvo sinciotrofoblastnih gigantskih ćelija ili izraženom horiokarcinomatoznom diferencijacijom HCG | ||
| Varijanta jasnih ćelija | Jasni uzorak ćelija glikogenom bogate citoplazme | ||
| Plazmacitoidni | Ćelije s obilnim sadržajem lipida, oponašaju adenokarcinom prstenastih ćelija prstenastog karcinoma želuca/režanjskog karcinoma dojke | Klinički agresivan, sklonost peritoneumskom širenju | |
| Neobične reakcije strome | Prisustvo: pseudosarkomatozna stroma, stromina koštana ili hrskavična metaplazija, gigantske ćelije tipa osteoklasta, limfoidni infiltrat |
Stepenovanje
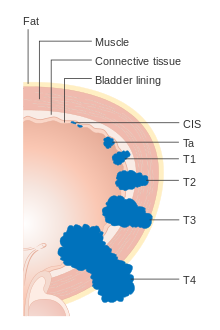

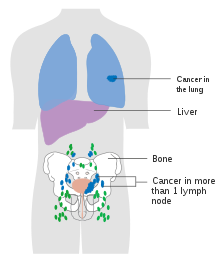

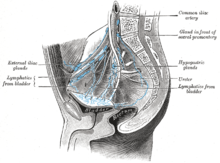
Rak mokraćne bešike se etapira (klasifikuje prema opsegu širenja karcinoma) i stupnjeve (koliko se želije nenormalno i agresivno pojavljuju pod mikroskopom), kako bi se odredili tretmani i procijenili ishodi. Stadiranje obično slijedi nakon prve transuretne resekcije tumora mjehura (TURBT). Papilarni tumori ograničeni na sluznicu ili koji napadaju lamina propria klasificirani su kao Ta ili T1. Ravne lezije klasificirane su kao Tis. Oboje su u terapijske svrhe grupirani kao nemišićno invazivna bolest.
U TNM-sistemu stepenovanja (8. izd. 2017.) za rak mokraćne bešike navodi se:[65][66]
T (primarni tumor)
- TX: Primarni tumor se ne može procijeniti
- T0: Nema dokaza o primarnom tumoru
- Ta: Neinvazivni papilarni karcinom
- Tis: Karcinom in situ ('ravni tumor')
- T1: Tumor napada invazivno subepitelno vezivno tkivo
- T2a: Tumor napada površinski mišić (unutrašnja polovina detrusorskog mišića)[67]
- T2b: Tumor napada duboki mišić (vanjska polovina mišića detruzora) [67]
- T3: Tumor napada perivezikulsko tkivo:
- T3a: Mikroskopski
- T3b: Makroskopski (ekstravezikulska masa)
- T4a : Tumor invazivno napada prostate, maternice ili vagine
- T4b: Tumor invazivno napada karlični ili trbušni zid
N (limfni čvorovi)
- NX: Regionalni limfni čvorovi se ne mogu procijeniti
- N0: Nema metastaza u limfnim čvorovima
- N1: Metastaze u jednom limfnom čvoru u istinskoj karlici (hipogastrični, obturator, vanjski ilijačni ili presakrumski čvorovi)
- N2: Metastaze u više limfnih čvorova u pravoj karlici (hipogastrični, obturatorni, vanjski ilijačni ili presakrumski čvorovi)
- N3: Metastaze u zajedničkim ilijačkom čvorovima
M (Udaljene metastaze)
- MX: Udaljene metastaze se ne mogu procijeniti
- M0: Nema udaljenih metastaza
- M1: Udaljene metastaze.
- M1a: Rak se proširio samo na limfne čvorove izvan karlice.
- M1b: Rak se proširio u druge dijelove tijela.
Najčešća mjesta za metastaze raka mokraćne bešike su limfni čvorovi, kosti, pluća, jetra i peritoneum.[68] Najčešći sentinelni limfni čvorovi drenirajući rak bešike su obturator i unutrašnji ilijačni limfni čvorovi. Lokacija širenja limfe ovisi o lokaciji tumora. Tumori na superolateralnom zidu bešike šire se na vanjeke ilijačne limfne čvorove. Tumori na vratu, prednjem zidu i fundusu često se šire na unutrašnje ilijačne limfne čvorove.[69] Iz regionalnih limfnih čvorova (tj. opturatora, unutrašnjih i vanjskih limfnih čvorova) rak se širi na udaljena mjesta kao što su zajednički ilijačni limfni čvorovi i paraaortni limfni čvorovi.[70] Preskočene lezije limfnog čvora se ne vide kod karcinoma bešike.[69]
Numeracija
Gornje faze mogu se integrirati u numeričku formu (sa rimskim brojevima) na sljedeći način:[71]
| Stadij | Tumor | Čvor | Metastaza | Petogodišnje preživljavanje (SAD)[72] |
|---|---|---|---|---|
| Stadij 0a | Ta | N0 | M0 | 98% |
| Stadij 0is | Tis | N0 | M0 | 95% |
| Stadij I | T1 | N0 | M0 | 63% |
| Stadij II | T2a | N0 | M0 | |
| T2b | ||||
| Stadij IIIA | T3a | N0 | M0 | 35% |
| T3b | ||||
| T4a | ||||
| T1-4a | N1 | |||
| Stadij IIIB | T1-4a | N2 | M0 | |
| N3 | ||||
| Stadij IVA | T4b | Any N | M0 | |
| Any T | M1a | |||
| Stadij IVB | Any T | ny N | M1b | 5% |
Stepenovanje
Prema klasifikaciji WHO-e (1973) karcinomi mokraćnog mjehura histološki se stepenuju u:[73]
- G1 – Dobro diferenciran,
- G2 – Umjereno diferenciran
- G3 – Slabo diferenciran
WHO klasifikacija (2004/2016)[74][75]
- Papilarne lezije
- Urotelijalni papilom
- Papilarna urotelna neoplazma niskog malignog potencijala (PUNLMP)
- Niska ocjena
- Visoka ocjena
- Ravne lezije
- Urotelska proliferacija nesigurnog malignog potencijala
- Reaktivna atipija
- Atipija nepoznatog značaja
- Urotelska displazija
- Urotelni CIS (uvijek visok stupanj)
- Primarno
- Sekundarno
- Istovremeno
Stratifikacija rizika
Osobe s nemišićnim invazivnim karcinomom mokraćne bešike (NMIBC) imaju stratifikaciju rizika na osnovu kliničkih i patoloških faktora, tako da se s njima postupa na odgovarajući način, ovisno o njihovoj vjerovatnoći napredovanja i/ili recidiva.[76] Osobe s nemišićnim invazivnim tumorima kategorizirane su u rizične, srednje i visoko rizične ili im je dodijeljena numerička ocjena rizika. Okvir za raslojavanje rizika pružaju Američko udruženje za urologiju/Društvo za urološku onkologiju (AUA / SUO stratifikacija), smjernice Evropskog udruženja za urologiju (EAU), Europska organizacija za istraživanje i liječenje karcinoma (EORTC) i Club Urológico Español de Tratamiento, Model bodovanja Oncológico (CUETO).[77][78][79]
| Nizak ririk | Umjeren rizik | Visok rizik |
|---|---|---|
| Solitarni Ta tumor niskog stupnja, manji od 3 cm | Ponavljanje u roku od jedne godine, Ta tumor niskog stepena | Visok stadij T1 |
| Papilarna urotelna neoplazma niskog malignog potencijala | Solitarni tumor niskog stupnja Ta, veći od 3 cm | Bilo koji ponavljajući tumor ili bilo koji visoki stepen Ta |
| Nizak stadi Ta, multižarišni tumori | Visok stadij Ta, veći od 3 cm (ili multižarišni) | |
| Visok stadij Ta, manji od 3 cm | Bez karcinoma in situ | |
| Niski stadij T1 | Bilo koje otkazivanje BCG kod tumora visokog stepena | |
| Bilo koja histološka varijanta | ||
| Bilo kojia limfovaskularna invazija | ||
| Bilo koja visokokvalitetna zahvaćenost ureterskog dijela prostate |
EORTC i CUETO model koriste kumulativni rezultat, dobijen od pojedinačnih prognostičkih faktora, koji se zatim pretvaraju u rizik od progresije i recidiva. Šest prognostičkih faktora uključenih u EORTC model su broj tumora, stopa recidiva, T-stadij, prisustvo karcinoma in-situ i stepen razvijenosti tumora. Bodovanje za ponavljanje u modelu CUETO uključuje šest varijabli; starost, spol, stepen, status tumora, broj tumora i njihovo prisustvo. Za bodovanje napredovanja koristi se prethodnih šest varijabli plus T faza.[80][81]
| Model | Cumulative score for recurrence | Recurrence at 1-year (%) | Recidiv nakon 5 godina (%) |
|---|---|---|---|
| EORTC | 0 | 15 | 31 |
| 1-4 | 24 | 46 | |
| 5-9 | 38 | 62 | |
| 10-17 | 61 | 78 | |
| CUETO | 0–4 | 8.2 | 21 |
| 5-6 | 12 | 36 | |
| 7-9 | 25 | 48 | |
| 10-16 | 42 | 68 |
| Model | Cumulative score for progression | Progression at 1-year (%) | Progression at 5-year (%) |
|---|---|---|---|
| EORTC | 0 | 0,2 | 0,8 |
| 2-6 | 1 | 6 | |
| 7–13 | 5 | 17 | |
| 12–23 | 17 | 45 | |
| CUETO | 0-4 | 1,2 | 3.7 |
| 5–6 | 3 | 12 | |
| 7–9 | 5.5 | 21 | |
| 10–16 | 14 | 34 |
Skrining
Od 2019. godine nema dovoljno dokaza da bi se utvrdilo da li je skrining za rak bešike kod ljudi bez simptoma efikasan ili ne.[84]
Liječenje
Liječenje raka mokraćne bešike ovisi o tome koliko duboko tumor invadira na zid mjehura.
Strategije liječenja raka mokraćne bešike uključuju:[85][86]
- Nemišićna invazivna: transuretumska resekcija tumora mokraćne bešike (TURBT) sa ili bez unutarvezikulske hemoterapije ili imunoterapije
- Mišićna nvazivna
- Stadij II/ IIIA: radikalno uklanjanje plus neoadjuvantna hemotherapija (multimodalna terapija, poželjno) ili transureterskna resekcija s hemoterapijom (trimodalna terapija, visoko odabrani ljudi) ili parcijalna cistektomija plus neoadjuvantna hemoterapija (kod visoko odabranih ljudi)
- Stadij IIIB / IVA: hemoterapija zasnovana na cisplatinu, praćena radikalnom cistektomijom ili hemoterapija ili promatranje, ovisno o odgovoru na liječenje
- Stadij IVB (lokalno uznapredovali; tumori koji se ne mogu ponovo uložiti): palijativna radioterapija
- Metastatska bolest: hemoterapija zasnovana na cisplatinu
- Metastatska bolest, neprikladna za hemoterapiju zasnovanu na cisplatinu: karboplatinska hemoterapija
- Metastatska bolest sa kontraindikacijom za hemoterapiju: inhibitori kontrolne tačke ako je pozitivan programirani ligand smrti 1 (PD L1)
- Pločasti karcinom ili adenokarcinom bešike' : radikalna cistektomija
Transureterska resekcija
Nemišićni invazivni rak mokraćne bešike (oni koji ne ulaze u mišićni sloj bešike) mogu se "obrijati" pomoću elektrokauterskog uređaja pričvršćenog na cistoskop, koji se u tom slučaju naziva resektoskop. Postupak se naziva transureterskaa resekcija tumora mokraćne bešike (TURBT) i služi prvenstveno za patološko stadiranje. U slučaju nemišićnog invazivnog karcinoma mokraćnog mjehura, TURBT je sam po sebi tretman, ali u slučaju mišićno invazivnog karcinoma, postupak je nedovoljan za konačno liječenje.[46] Pored toga, preporučuje se plavo svjetlo, cistoskopija sa optičkim slikovnim sredstvom heksaminolevulinatom (HAL) u početnom TURBT-u, kako bi se povećala detekcija lezija (posebno karcinoma in situ) i poboljšao kvalitet resekcije, smanjujući tako recidive.[87][88] Važno je procijeniti kvalitet resekcije, ako postoje dokazi o nepotpunoj resekciji ili ako u uzorku nema mišića (bez kojeg se ne može utvrditi invazivnost mišića), tada se preporučuje drugi TURBT. Šta više, gotovo polovina ljudi sa visokim stepenom neinvazivne bolesti ima rezidualni tumor nakon primarnog TURBT-a, u takvim slučajevima drugi TURBT je važan za izbjegavanje nedovoljnog stepenovanja.[89][90] Sada preporučuje se klasifikacija ljudi u rizične skupine. Lečenje i nadzor različitih rizičnih grupa naznačeni su u donjoj tabeli.
Drugi metod za smanjenje recidiva tumora su lijekovi nakon TURBT operacije. Dva najčešća lijeka koja se koriste u tu svrhu su Bacillus Calmette – Guérin-ova (BCG) i mitomicin.[91] Osobama koje su već imale postupak TURBT, BCG može dovesti do sličnog rizika od smrti i može smanjiti rizik od recidiva tumora. Međutim, ovaj lijek može povećati rizik od ozbiljnih neželjenih neželjenih efekata . Potrebna su dodatna istraživanja kako bi se potvrdili ovi rezultati.
Hemoterapija
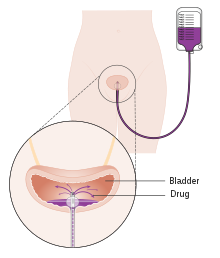
Jednokratno ubrizgavanje hemoterapije u mokraćni mjehur nakon primarnog TURBT-a pokazalo je korist u smanjenju recidiva za 35% kod nemišićne invazivne bolesti.[92] U tu svrhu mogu se koristiti lijekovi mitomicin C (MMC), epirubicin, pirarubicin i gemcitabin. Instilaciju postoperativne hemoterapije treba provesti u prvih nekoliko sati nakon TURBT-a. Kako vremenom napreduje, poznato je da se preostale tumorske ćelije čvrsto pripijaju i prekrivene su vanćelijskim matriksom koji smanjuje efikasnost instilacije. Najčešća nuspojave su hemijski cistitis i iritacija kože. Ako postoji sumnja na perforaciju mokraćnog mjehura tokom TURBT-a, hemoterapija se ne smije ukapati u mjehur, jer se zna da se ozbiljni neželjeni događaji mogu dogoditi zbog ekstravazacije lijeka. Studije su pokazale da se efikasnost hemoterapije povećava upotrebom pomoću uređaja.[93] Ove tehnologije koriste različite mehanizme za olakšavanje apsorpcije i djelovanja lijeka za hemoterapiju koji se ukapava direktno u mjehur. Druga tehnologija - primjenu elektromotornih lijekova (EMDA) – električnu struju za pojačavanje apsorpcije lijeka nakon hirurškog uklanjanja tumora.[94][95] Druga tehnologija, termoterapija, koristi radio-frekvencijsku energiju za direktno zagrijavanje zida mokraćnog mjehura, što zajedno s hemoterapijom (hemohipertermija) pokazuje sinergijski učinak, jačajući međusobnu sposobnost ubijanja tumorskih ćelija.[96]
Imunoterapija

Imunoterapija pomoću unošenje u bešiku vakcine marke Bacillus Calmette – Guérin (BCG) također se koristi za lečenje i sprečavanje recidiva NMIBC.[97] BCG je vakcina protiv tuberkuloze koja se priprema od oslabljenog/umrtvljenog živog goveđeg bacila tuberkuloze, Mycobacterium bovis, koja je izgubila virulenciju kod ljudi. BCG imunoterapija je efikasan u do 2/3 slučajeva u ovoj fazi, a u randomiziranom ispitivanju pokazalo se da su superiorniji od standardnih hemoterapija.[98] Tačan mehanizam kojim BCG sprečava recidiv nije poznat. Međutim, pokazalo se da ćelije raka preuzimaju bakterije.[99] Infekcija ovih ćelija u mokraćnom mjehuru može pokrenuti lokaliziranu imunsku reakciju koja čisti zaostale ćelije karcinoma.[100][101]
BCG se isporučuje kao indukcija i kurs održavanja. Indukcioni kurs sastoji se od 6-nedeljnog kursa intravezikulskog i perkutanog BCG-a.[102] Nakon toga slijedi program održavanja. Ne postoji konsenzus oko rasporeda održavanja, međutim najčešće se slijedi raspored Jugozapadne onkološke grupe (SWOG).[103] SWOG-ov raspored održavanja sastoji se od intravezikulskog i perkutanog BCG svake sedmice tokom tri sedmice u 3, 6, 12, 18, 24, 30 i 36 mjeseci. Trodnevni režim održavanja sa indukcijom pokazao je stopu potpunog odgovora od 84% u poređenju sa 69% kod ljudi koji su primili šestosedmičnu indukciju BCG tek sa šest meseci. Mnoge studije su istraživale alternativne sheme liječenja i režime BCG, ali nisu pokazala klinički značaj. Efikasnost različitih sojeva BCG (Connaught, TICE, Pasteur, Tokio-172) pokazalo se da se ne razlikuje, ali nema dokaza na visokom nivou.[104]
Neželjeni efekti BCG terapije uključuju cistitis, prostatitis, epididymo-orchitis, balanitis, opstrukciju mokraćovoda, kontrakciju bešike, mikobakterijski osteomijelitis, reaktivni artritis, mikobakterijsku upalu pluća, granulomatozni hepatitis,granulomatozni nefritis, intersticijski nefritis, zarazni vaskulitis i diseminiranu infekciju.[105][106]
Lokalnu infekciju (tj. prostatitis, epididymo-orchitis, balanitis) zbog BCG-a treba liječiti trostrukom tuberkuloznom terapijom, pri čemu bi jedan od lijekova bio fluorokinolon tokom tri do šest mjeseci. Kod osoba sa sistemskim infekcijama treba prekinuti terapiju BCG-om i započeti liječenje multi-lijekovima protiv tuberkuloze, najmanje šest mjeseci. Lijekovi koji se mogu koristiti za ovaj tretman su INH, rifampicin, etambutol, fluorokinoloni, klaritromicin, aminoglikozidi i doksiciklin. Sojevi BCG nisu osetljivi na pirazinamid, pa ne bi trebalo da bude dio antituberkuloznog tretmana.[107]
Neuspjeh u liječenju BCG-om
Neuspjeh liječenja BCG-om može se klasificirati u tri grupe: recidiv BCG-a, BCG-refraktorni i BCG-netolerantni. Kod recidiva BCG, tumor se ponavlja nakon perioda bez bolesti. BCG-refraktorni tumori su oni koji ne reagiraju na indukcije i doze održavanja BCG-a ili koji napreduju tokom terapije. Kod BCG-intolerantnih, tumor se ponavlja zbog nepotpunog liječenja, jer osoba koja ga prima nije u stanju tolerirati indukcijski tok BCG-a. Otprilike 50% ljudi ne uspije liječiti BCG i trebao bi mu daljnji tretman.
Teže je liječiti ljude čiji su se tumori ponovili nakon liječenja BCG-om ili koji nisu reagirali na liječenje.[108] Takvim ljudima je preporuka radikalna cistektomija.[109][110] Kod ljudi koji ne pokazuju odgovor na BCG terapiju i nisu sposobni ili ne žele da se podvrgnu radikalnoj cistektomiji, mogu se razmotriti terapije spašavanja. Terapija spašavanja uključuje intravezikulsku hemoterapiju sredstvima kao što su valrubicin, gemcitabin ili docetaksel, hemoterapija ili hemohipertermija.[111]
| Rizik | Ostali podaci | Hemoterapija | Imunoterapija (BCG) | Cistoskopja (nadzor) | Snimanje (nadzor) |
|---|---|---|---|---|---|
| Nizak | Nakon tri mjeseca, nakon čega slijedi cistoskopija na 12 mjeseci, zatim pet godina po jednom godišnje | CT / MR urografija i CT / MRI abdomena i karlice na početku | |||
| Srednji | Primarni tumor sa anamnezom hemoterapije | Intravesical chemotherapy for 1 year OR Intravesical BCG for 1 year (preferred) | at Nakon 3-mjsečja sa sa citologijom, nakon čega slijedi jednom u 3-6 mjeseci tokom pet godina, a zatim godišnje | CT / MR urografija i CT / MRI abdomena i karlice na početku | |
| Recidivni tumori sa anamnezom prethodne hemoterapije | Unutarvezikulski BCG , godišnje | ||||
| Visok | Unutarvezikulski BCG , trogodišnje (kako se tolerira) | Nakon 3-mjesečja sa citologijom, nakon čega slijedi jednom u svaka tri mjeseca tokom dvije godine, šest puta mjesečno tokom pet godina, zatim godišnje | CT / MR urografija i CT / MRI abdomena i karlice na početku, CT / MR urografija 1-2 godišnje tokom 10 godina | ||
| Visoki stupanj, limfovaskularna invazija, prisustvo varijantnih histoloških obilježja | Preporučljiva radikalna cistektomija | ||||
Invazivni mišićni

Multimodusna terapija (standardni tretman)
Neliječeni, nemišići invazivni tumori mogu postepeno početi infiltrirati u mišićni zid mokraćne bešike (mišićno invazivni rak bešike). Tumori koji se infiltriraju u zid mjehura zahtijevaju radikalniju operaciju, gdje se dio (djelimična cistektomija) ili cijeli (radikalnom cistektomijom) mjehur uklanja (cistektomija), a mokraćni tok preusmjerava u izoliranu petlju crijeva (zvanu ilealni vod ili urostomija). U nekim slučajevima, vješti hirurzi mogu kreirati zamjenski mjehur (neoblakturni mjehur) iz segmenta crijevnog tkiva, ali to uveliko ovisi o preferenciji osobe, dobi osobe, bubrežnoj funkciji i mjestu bolesti.
Bilateralna karlična limfadenektomija treba da prati radikalnu cistektomiju. Standardni obrazac limfadenektomija trebao bi biti praćen uklanjanjem vanjskih i unutrašnjih ilijačnih i obturatorskih limfnih čvorova.[112] Kada se izvodi limfadenektomiju, mogu se ukloniti limfni čvorovi sa manjeg (standardnog) ili sa većeg (proširenog) područja. U usporedbi sa standardnom disekcijom limfnih čvorova, prošireno seciranje može smanjiti vjerovatnoću smrti osobe iz bilo kojeg razloga, uključujući i umiranje od raka mokraćnog mjehura.[113] Prošireni postupak može dovesti do ozbiljnijih neželjenih efekata i može ali ne mora uticati na vjerovatnoću ponovnog pojave raka s vremenom. Stopa ne tako ozbiljnih nuspojava može biti slična za obje operacije.
Radikalna cistektomija povezana je sa značajnim morbiditetom. Otprilike 50-65% ljudi doživi komplikaciju u roku od 90 dana od operacije.[114][115] Stopa smrtnosti iznosila je 7% u roku od 90 dana od operacije. Centri velikih kapaciteta imaju bolje ishode od malih centara.[116] Do sada su dva najčešće korišćena režima hemoterapije za neoadjuvantnu hemoterapiju na bazi platine: metotreksat, vinblastin, doksorubicin, cisplatin (MVAC) i gemcitabin sa cisplatinom (GC).[117] Ostali režimi uključuju gusti dozni MVAC (DDMVC) i cisplatin, metotreksat i vinblastin (CMV).Iako optimalni režim nije uspostavljen, preferirani režim za neoadjuvantnu terapiju je MVAC.
Uloga adjuvantne hemoterapije (hemoterapija nakon glavnog tretmana) ograničena je na ljude sa tumorima visokog stepena (pT3 / T4 i / ili N+) i koji nisu liječeni neoadjuvantnom terapijom.[112] Pomoćna terapija zračenjem nije pokazala nikakvu prednost u liječenju raka mokraćne bešike.[118]
| MVAC | DDMVAC | Gemcitabin + cisplatin |
|---|---|---|
| Methotreksat (30 mg/m2 IV) – dan 1,15,22 Vinblastin (3 mg/m2 IV) – dan 2, 15, 22 Doksorubicin (30 mg/m2 IV) – dan 2 Cisplatin (70 mg/m2 IV) – dan 2 Ponavljanje svake četiri sedmice u trri ciklusa | Methotreksat (30 mg/m2 IV) – dan 1 Vinblastin (3 mg/m2 IV) – dan 2 Doksorubicin (30 mg/m2 IV) – dan 2 Cisplatin (70 mg/m2 IV) – dan 2 Faktor stimulacije kolonija granulocita (G-CSF) (240μg/m2 SC) – dana 4-10 Ponavljanje svake dvije sedmiceu 3-4 ciklusa||Gemcitabin (1,000 mg/m2 IV) – dan 1,8,15 Cisplatin (70 mg/m2) – dan 2 Ponavljajte svake četiri sedmice u četitri 4 ciklusa |
Trimodusna terapija (alternativni treatman)
Kod određenih ljudi, može se primijeniti kombinacija zračenja i hemoterapija u kombinaciji sa transureteraskom (endoskopskom) resekcijom tumora mokraćne bešike.[121] Pregled dostupnih velikih serija podataka o ovoj takozvanoj trimodusnoj terapiji ukazao je na slične dugoročne stope specifičnog preživljavanja od karcinoma, sa poboljšanom sveukupnom kvalitetom života kao kod ljudi koji su podvrgnuti radikalnoj cistektomiji s rekonstrukcijom bešike. Međutim, još nisu dostupna randomizirana kontrolna ispitivanja koja su uspoređivala trimodusnu terapiju s radikalnom cistektomijom. Ljudi koji se podvrgavaju trimodusnoj terapiji obično su visoko odabrani i uglavnom imaju T2 bolest bez hidronefroze i/ili karcinoma in situ.[122] Five year cancer specific survival and overall survival after trimodal therapy is between 50% to 82% and 36% to 74%.[121]
U trimodusnoj terapiji provodi se maksimalni TURBT praćen hemoterapijskim liječenjem. Koriste se režimi hemoterapije koji senzibiliziraju zračenje koji se sastoje od cisplatina ili 5-flurouracila i mitomicina C. Radiacijska terapija obavlja se putem vanjske radioterapije (EBRT) sa ciljanom kurativnom dozom od 64-66 Gy.[123] Nadzor napredovanja ili recidiva treba provoditi uz pomoć CT-snimanja, cistoskopije i citologije urina.[112] Nuspojave hemoterapije uključuju mučninu, povraćanje, gubitak apetita, gubitak kose, rane u ustima, proliv, zatvor, povećani rizik od infekcija i krvarenja i umora.[124]
Kod ljudi sa neuspješnom trimodusnom terapijom, radikalna cistektomija se uzima u obzir ako postoje mišićno invazivni ili rekurentni tumori. Oko 25-30% ne uspije se izliječiti i podvrgne se spasilačkoj radikalnoj cistektomiji. TURBT s intravezikalnom terapijom indiciran je nakon neuspjeha u liječenju nemišićne invazivne bolesti.
Djelimična cistektomija
Kod osoba s solitarnim tumorom bez istodobnog karcinoma in situ na području gdje se mogu postići čisti operativni rubovi, može se razmotriti djelomična cistektomija s limfadenektomijama. Plan upravljanja koji uključuje delimičnu cistektomiju treba da bude praćen neoadjuvantnom hemoterapijom.
Osobe s metastazama u kostima trebale bi primiti bisfosfonate ili denosumab, kako bi spriječile događaje povezane sa skeletom (npr. frakture, kompresija kičmene moždine, bolovi u kostima).[125]
| DDMVAC | Gemcitabin + Cisplatin |
|---|---|
| Methotreksate (30 mg/m2 IV) – dan 1 Vinblastin (3 mg/m2 IV) – dan 2 Doksorubicin (30 mg/m2 IV) – dan 2 Cisplatin (70 mg/m2 IV) – dan 2 Faktor stimulacije kolonija granulocita (G-CSF) (240μg/m2 SC) – dan 4-10 Ponavljanje svake dvije sedmice u 3–4 ciklusa | Gemcitabin (1,000 mg/m2 IV) – dan 1, 8, 15 Cisplatin (70 mg/m2) – dan 2 Ponavljanje svake četiri sedmice u četiri ciklusa |
| Atezolizumab (u PD-L1+) | Gemcitabin + Karboplatin | Pembrolizumab (u PD-L1+) |
|---|---|---|
| Atezolizumab (Atezolizumab 1200 mg IV) Svake tri sedmice | Gemcitabin (1,000 mg/m2 IV) – dan 1,8 Karboplatin (4.5 × [stopa glomerulske filtracije + 25]) – dan 1 i svake tri sedmice | Pembrolizumab 200 mgSvake tri sedmice |
U SAD-u, odobreno je pet imunoterapijskih sredstava za upotrebu kod metastatskog karcinoma bešike. Oni djeluju inhibirajući programirani protein ćelijske smrti 1 (PD-1) ili programirani ligand 1 ćelijske smrti (PD-L1). Pembrolizumab i nivolumab i inhibitori su programiranog liganda 1 ćelijske smrti (PD-1). Avelumab, atezolizumab i durvalumab su inhibitori PD-L1.[126][127]
Pembrolizumab vjerovatno malo poboljšava cjelokupno preživljavanje i može malo poboljšati kvalitet života ljudima s urotelnim karcinomom koji se pogoršao nakon početnog liječenja u usporedbi s nastavkom hemoterapije.[128] Međutim, pembrolizumab može imati samo minimalne učinke na stopu smrti koja je rezultat liječenja ili brzonapredujućeg karcinoma. Pembrolizumab može izazvati manje ozbiljne nuspojave od hemoterapije.
| Atezolizumab | Nivolumab | Pembrolizumab | Durvalumab | Avelumab |
|---|---|---|---|---|
| Atezolizumab 1200 mg IV Sbvake tri sedmice | Nivolumab 3 mg/kg IV Svake dvije sedmice | Pembrolizumab 200 mg Svake tri sedmice | Durvalumab 10 mg/kg Svake dvije sedmice tokom 12 mjeseci | Avelumab 10 mg/kg IV Svake dvije sedmice |
Prognoza
Ljudi sa nemišićnim invazivnim tumorima imaju povoljan ishod (petogodisnje preživljavanje je 95% naspram 69% mišićno invazivnog karcinoma bešike)).[129][130] However, 70% of them will have a recurrence after initial treatment with 30% of them presenting with muscle invasive disease.[131] Ponavljanje i napredovanje u viši stadij bolesti imaju nepovoljniji ishod.[132]
Preživljavanje nakon radikalne cistektomije i disekcije karličnih limfnog čvora ovisi o patološkoj fazi. Ako se bolest nije proširila na limfni čvor i ograničena je na mokraćni mjehur (T1 ili T2, N0), petogodišnje preživljavanje je 78%. Ako se proširio lokalno oko regije bešike bez uključenog limfnog čvora (T3, N0), tada petogodišnje preživljavanje pada na 47%. Kod bolesti sa širenjem limfnih čvorova (N +, bez obzira na stadij T), petogodišnje preživljavanje iznosi 31%. Lokalno uznapredovala i metastatska bolest drastično smanjuje preživljavanje, sa medijanom preživljavanja 3–6 mjeseci bez hemoterapije. Hemoterapija zasnovana na cisplatinu povećala je medijanu preživljavanja na 15 mjeseci. Međutim, petogodišnje preživljavanje je i dalje 15%.[133]
Postoji nekoliko prognostičkih faktora koji određuju preživljavanje specifično za rak nakon radikalne cistektomije. Oni sa štetnim učinkom na specifično preživljavanje raka su starost, viši stupanj tumora i patološki stadij, metastaze, limfnih čvorova, prisustvo limfovaskularnih invazija i pozitivni rubovi mehkog tkiva.[134] Gustina limfnih čvorova (pozitivni limfni čvorovi/ukupni limfni čvorovi uočeni u uzorku iz operacije) je prediktor preživljavanja u pozitivnoj bolesti limfnih čvorova. Što je gustoća manja, to je veća šansa za preživljavanje.[135]
Epidemiologija
| Rang | Zemlja | Ukupno | Muškarci | Žene |
|---|---|---|---|---|
| 1 |  Liban Liban | 25 | 40 | 9 |
| 2 |  Grčka Grčka | 21 | 40 | 4 |
| 3 |  Danska Danska | 18 | 29 | 8 |
| 4 |  Mađarska Mađarska | 17 | 27 | 9 |
| 5 |  Albanija Albanija | 16 | 27 | 6 |
| 5 |  Nizozemska Nizozemska | 16 | 26 | 8 |
| 7 |  Belgija Belgija | 16 | 27 | 6 |
| 8 |  Italija Italija | 15 | 27 | 6 |
| 9 |  Njemačka Njemačka | 15 | 26 | 6 |
| 10 |  Španija Španija | 15 | 27 | 6 |

Na globalnom nivou, 2017. godine, rak mokraćnog mjehura rezultirao je sa 196.000 smrtnih slučajeva, što je smanjenje za 5,4% (prilagođena starost) u odnosu na 2007.[139] U 2018., starosno prilagođena stopa novih slučajeva karcinoma mokraćnog mjehura iznosila je 6/100.000 ljudi, a stopa smrtnosti prilagođene dobi iznosila je 2/100.000 ljudi. Liban i Grčka imaju najveću stopu novih slučajeva. U Libanu se ovaj visoki rizik pripisuje velikom broju pušača i petrohemijskom zagađenju zraka.[140]
Rizik od pojave karcinoma mokraćne bešike četiri je puta veći kod muškaraca nego kod žena. Pušenje može samo djelimično objasniti ove veće stope kod muškaraca na Zapadnoj hemisferi.[141] Drugi uzrok je taj što androgeni receptor, koji je mnogo aktivniji kod muškaraca nego kod žena, može imati ulogu u razvoju karcinoma.[142] Ovoj hipotezi u prilog govori i činjenica da muškarci koji se podvrgavaju terapiji supresije androgena iz nepovezanih razloga imaju manji rizik od razvoja raka mokraćnog mjehura.[143] U Africi muškarci su skloniji obavljanju terenskog rada i izloženi su infekciji sa Schistosomama, to može u određenoj mjeri objasniti jaz u učestalosti karcinoma pločastih ćelija u područjima gdje je rak mokraćnog mjehura endemičan. Međutim, žene imaju agresivniju bolest i imaju lošije ishode od muškaraca. Ova razlika u ishodima pripisuje se brojnim faktorima kao što su, razlika u izloženosti kancerogenima, genetika, socijalni status i kvalitet njege.[41] Jedan od čestih znakova raka mokraćnog mjehura je hematurija i često se pogrešno dijagnosticira kao infekcija mokraćnog sistema kod žena, što dovodi do kašnjenja u dijagnozi. Šta više, kao što je ranije spomenuto, gen PSCA može igmati ulogu u agresivnim tumorima kod žena.
Reference
Vanjski linkovi
- Rak mokraćne bešike na Curlie
- Clinically reviewed bladder cancer information for patients, from Cancer Research UK
- Cancer.Net: Bladder Cancer
- EORTC calculator for non-muscle invasive bladder cancer risk stratification
Šablon:Urološka neoplazija