Fentanyl
Fentanyl (auch Fentanil) ist ein synthetisches Opioid, das zur Linderung starker akuter und chronischer Schmerzen in der Anästhesie und in der Intensivmedizin, notfallmedizinisch und zur ambulanten Schmerztherapie eingesetzt wird. Angewendet wird es als Injektion, Pflaster, Nasenspray und durch Aufnahme über die Mundschleimhaut. Es gilt als unentbehrliches Arzneimittel der WHO[11] und wirkt als Vollagonist am μ-Opioidrezeptor.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Fentanyl[1] | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C22H28N2O | |||||||||||||||||||||
| Kurzbeschreibung | Weißes bis fast weißes, polymorphes Pulver[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | μ-Opioidrezeptor-Agonist | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 336,47 g·mol−1 | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert | 8,43[5] | |||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Es ist aufgrund seines Suchtpotenzials unter anderem dem deutschen und Schweizer Betäubungsmittelgesetz sowie dem österreichischen Suchtmittelgesetz unterstellt und wird per Betäubungsmittelrezept verschrieben. In den Vereinigten Staaten prägen Fentanyl und seine Abkömmlinge seit den 2010er Jahren die dritte Welle der Opioid-Epidemie, indem sie zunehmend als Rauschmittel verwendet werden und für eine hohe und wachsende Anzahl von Todesfällen durch Überdosierung verantwortlich sind.[12][13]
Geschichte
Im Jahr 1937 war es Chemikern der Hoechster Farbwerke zum ersten Mal in der Geschichte gelungen, mit Pethidin und Methadon zwei vollsynthetische Opioidanalgetika zu erschaffen. Diese waren zu Beginn der 1950er Jahre international verfügbare Arzneistoffe. Dem Belgier Paul Janssen, der 1953 das Unternehmen Janssen Pharmaceutica gegründet hatte, dienten diese beiden Prototypen als Vorlage für eine Entwicklung, aus der in der zweiten Hälfte der 1950er Jahre Dextromoramid und Phenoperidin hervorgingen.Arnold Beckett und Alan Casy hatten im Jahr 1954 die Existenz von Opioidrezeptoren postuliert,[14] doch von der Kenntnis hochaufgelöster Rezeptorstrukturen, die heute die professionelle Wirkstoffgestaltung prägt, war man damals weit entfernt. Der Leitgedanke, durch Erhöhung der Wirkstoff-Lipophilie die Hirngängigkeit und einhergehend die Wirksamkeit zu steigern, gipfelte in der Entdeckung des Fentanyls. Von Janssen erstmals im Dezember 1960 synthetisiert, erwies es sich als das potenteste Opioidanalgetikum seiner Zeit, mit einer höheren therapeutischen Breite als Morphin.[15][16][17][18]Fentanyl wurde ab dem Jahr 1963 in mehreren westeuropäischen Ländern als Injektionsanalgetikum vermarktet.[16] Da die Food and Drug Administration anfangs Bedenken gegen die Anwendung wegen des Missbrauchsrisikos erhob, wurde es in den Vereinigten Staaten erst 1968 zugelassen,[19][20] und zwar zunächst als Kombipräparat, versetzt mit dem Neuroleptikum Droperidol, ab 1972 als Einzelstoff.Nach Ablauf des Patentschutzes wurde es ab dem Jahr 1981 generisch angeboten und die Verkaufszahlen verzehnfachten sich in den Vereinigten Staaten. Fentanyl wurde im Laufe der Zeit zu einem der weltweit am häufigsten verwendeten Opioidanalgetika. In der weiteren Entwicklungsgeschichte wurden aus Fentanyl durch Modifikation der Molekülstruktur zahlreiche Analoga entwickelt. Unter ihnen erreichten Sufentanil im Jahr 1984, Alfentanil 1986 und Remifentanil 1996 die Marktreife.[15][21]
Auch bei den Darreichungsformen gab es Entwicklungen. In den 1990er Jahren wurden Fentanylpflaster für die Zufuhr des Wirkstoffs durch die Haut entwickelt.[22] Im Jahr 1998 wurden Fentanyllutschtabletten zugelassen,[23] ab 2009 folgten wasserlösliche Fentanylschmelzfilme[24] als Formulierungen für die Resorption über die Mundschleimhaut. Jüngere Formulierungen solcher Rapid-Onset Opioids (ROOs) ermöglichen die Applikation von Fentanyl über die Nase (Nasenspray).[16]
Seit 2004 wird Fentanyl als Lutschtabletten vom US-Militär in der Versorgung von Verwundeten auf dem Gefechtsfeld als Alternative zu Morphin empfohlen. Es gibt Bestrebungen, dieses durch Sufentanil zu ersetzen, um ein geringeres Nebenwirkungsspektrum und Missbrauchspotenzial zu erzielen.[25]
Seit 1979 wird Fentanyl auch illegal hergestellt und als Rauschmittel verwendet.[26] Die Verbreitung als Rauschmittel nimmt seit den 2000er Jahren in Nordamerika, der EU und Großbritannien zu und hat ihren Schwerpunkt in den Vereinigten Staaten.[27] Das für den Schwarzmarkt bestimmte Fentanyl wurde ab 2013 größtenteils in China hergestellt. Da seit 2019 in China die Herstellung und Anwendung von Fentanyl kontrolliert wird, werden zunehmend die Vorläuferstoffe von China nach Mexiko geliefert, wo Labore dort ansässiger Drogenkartelle die Endproduktion übernehmen.[13][27]
Wirkung
Fentanyl wirkt stark schmerzlindernd (analgetisch) und sedierend, daneben auch atemdepressiv, antitussiv, pulsverlangsamend, blutdrucksenkend, verstopfend und teils euphorisierend.[28]Der Konsum von Fentanyl aktiviert das Belohnungssystem und wirkt verstärkend, was hauptursächlich zum Missbrauch und zu Todesfällen durch Überdosierung beiträgt.[29]Im Vergleich zu anderen Opioiden verursacht Fentanyl eine stärkere Muskelsteifheit.[29] Die Rauschwirkung wird von Opioiderfahrenen als vergleichsweise „langweilig“ charakterisiert.[30]
Medizinische Anwendung
Anwendungsgebiete
Fentanyl wird unter anderem in der Anästhesie,[31] Onkologie,[32][33] Militärmedizin,[34] Palliativmedizin[35] und Geburtsheilkunde[36][37] als Schmerzlinderungsmittel eingesetzt.
In der Anästhesie wird es zur Narkose,[31] zur Spinal-[38] und zur Epiduralanästhesie[37] verwendet. Fentanyl ist das meistverwendete Opioid-Anästhetikum für Analgesie während einer Operation, unter anderem weil es wenige kardiovaskuläre Effekte und wenig Histaminausschüttung hervorruft.[39] Haupteinsatzgebiet der intravenösen Form ist die Gabe als Schmerzmittel bei Operationen in Verbindung mit einem Schlafmittel und wahlweise einem muskelentspannenden Mittel (Muskelrelaxans).Je nach Wahl des Schlafmittels spricht man von „balancierter Anästhesie“ oder „totaler intravenöser Anästhesie“ (TIVA). Wegen der Gefahr der Atemdepression ist eine ständige Überwachung und das Bereithalten einer Beatmungsmöglichkeit erforderlich. Aufgrund der Lipophilie (guten Lösbarkeit in Fetten) wird Fentanyl teilweise schwer kontrollierbar im Fettgewebe eingelagert und wieder freigegeben. Deshalb werden heute anstelle von Fentanyl häufig die weniger lipophilen verwandten Stoffe Alfentanil und Remifentanil verwendet. Bei fentanylhaltigen Wirkstoffpflastern ist wegen der gleichmäßigen Wirkung und der im Vergleich zur Anästhesie meist deutlich geringeren Dosis nach einer Einstellungsphase keine ständige Überwachung der Vitalfunktionen nötig.
Anwendungsformen


Gebräuchlich ist Fentanyl als Base sowie als Dihydrogencitrat-Salz.[40] Es gibt vier Anwendungsformen:
- Injektionslösung, insbesondere für die Anästhesie oder Notfallmedizin;
- auf die Haut geklebtes Membranpflaster bzw. Matrixpflaster, das den Wirkstoff mit wahlweise 12,5, 25, 37,5, 50, 75, 100 oder 150 Mikrogramm pro Stunde zur Aufnahme über die Haut freisetzt; teilweise auch per Iontophorese.[41] Durch Wärmeeinwirkung kann die Freisetzungsgeschwindigkeit aus dem System, die Permeation durch das Stratum corneum, eine Schicht in der Oberhaut, und die kutane Durchblutung gesteigert werden. Die Erhöhung der Körpertemperatur von 37 °C auf 40 °C erhöht den Plasmaspiegel um 25 bis 33 %.[42]
- schnell freisetzende Formulierung für die Aufnahme über die Mundschleimhäute (oral-transmukosal), etwa als 200 bis 1600 µg Wirkstoff enthaltende Lutschtablette mit integriertem Applikator zur Anwendung an der Mundschleimhaut, als Buccaltablette mit 100 bis 800 µg Wirkstoff oder als Sublingualtablette mit 50 bis 800 µg Fentanyl;
- Nasenspray.
Diese schnell freisetzenden Formulierungen sind angezeigt für die Behandlung von Durchbruchschmerzen (sehr intensiver minutenlanger Schmerz, typisch bei fortgeschrittener Krebserkrankung) bei Erwachsenen, die bereits eine Opioid-Basistherapie gegen ihre Tumorschmerzen erhalten.[43]
Nebenwirkungen
Wie auch andere Opioide provoziert Fentanyl bei Überdosierung eine Störung des Zentralnervensystems mit Bewusstseinsstörungen, Somnolenz und Atemdepression.[44] Das akute Bild weist im Wesentlichen ausgeprägte Sedierung, Miosis (Verengung der Pupille) und Atemdepression auf, wobei diese bis hin zum Atemstillstand führen kann. Die Wirkung von Fentanyl kann mit Naloxon gehemmt werden.
Typische Nebenwirkungen umfassen Übelkeit, Erbrechen, Verstopfung, Jucken, Benommenheit, Verwirrtheit und Verletzungen durch mangelhafte Koordination.[45][46] Schwerwiegende Nebenwirkungen umfassen Atemdepression, Sinnestäuschungen, Serotoninsyndrom, niedriger Blutdruck und Opiatabhängigkeit.[45][46] Im Vergleich zu Morphin erzeugt Fentanyl weniger Juckreiz und weniger Übelkeit.[47] Die Muskelsteifheit in Brustkorb und Bauch ist bei Fentanyl relativ stark ausgeprägt, was als wooden chest syndrome (‚hölzerner-Brustkorb-Syndrom‘) bezeichnet[48] und vermutlich durch die Ausschüttung von Noradrenalin und Acetylcholin verursacht wird.[49] Die Muskelsteifheit in den Muskeln der Atemwege kann eine Beatmung mit Beatmungsbeutel erschweren.[44] Fentanyl erzeugt eine Bradykardie (Absenkung der Herzschlagfrequenz) durch eine Aktivierung des Parasympathikus in Folge einer Aktivierung des Vagusnervs.[44] Daneben wirkt Fentanyl gefäßerweiternd, wodurch der Blutdruck sinkt.[44] Die Gefäßweitung basiert zum überwiegenden Teil auf einer Wirkung im Gehirn, zum geringeren Teil durch direkte Einwirkung auf die Gefäße.[44] Der Effekt der Gefäßweitung ist besonders ausgeprägt bei Patienten mit Bluthochdruck oder Herz-Kreislauferkrankungen.[44]
Anwendungssicherheit
Seit 2005 berichtet die amerikanische Arzneimittelbehörde FDA wiederholt über schwere Nebenwirkungen und Todesfälle in Zusammenhang mit fentanylhaltigen Hautpflastern, allein 2009 über 397 Todesfälle.[50][51]Nachdem in den Vereinigten Staaten – allein bis 2012 über zehn[52] – Kinder nach Kontakt mit Fentanylpflastern an einer Überdosis verstarben, warnt die Food and Drug Administration (FDA) Eltern und Betreuer vor den tödlichen Gefahren eines versehentlichen Kontakts und betont die Notwendigkeit eines verantwortungsbewussten Umgangs mit den Pflastern. Sie veröffentlicht Tipps für Vorsichtsmaßnahmen und empfiehlt, mit dem Arzt das Vorhalten von Naloxon als Gegenmittel zu besprechen.[53]Im März 2023 erfolgte in den USA die Zulassung eines rezeptfreien Naloxon-Nasensprays als Gegenmittel bei Opioid-Überdosierungen;[54] zuvor schon hatte sich die FDA für eine Entlassung aus der Rezeptpflicht ausgesprochen.[55]
In Deutschland verwies die Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) 2012 darauf, dass die Indikation für transdermale, fentanylhaltige Pflaster streng zu stellen sei. So sollen sie nur bei chronischen Schmerzen verordnet werden, die nur mit Opioiden ausreichend gelindert werden und einer andauernden, kontinuierlichen Behandlung bedürfen. Während die FDA die Anwendung nur bei Patienten erlaubt, die über mindestens eine Woche 60 mg Morphin pro Tag oder mehr eingenommen haben (oder entsprechend ein anderes Opioid), rät die deutsche Fachinformation, bei Patienten ohne bisherige Opioideinnahme zunächst niedrig dosiert unretardierte Opioide zu geben, bis deren Dosis 12,5 μg/h Fentanyl (= 45 mg Morphin/Tag) entspricht, und erst dann auf ein Pflaster umzustellen.[56]
In einem Rote-Hand-Brief warnten Hersteller von Fentanylpflastern 2014 vor einer versehentlichen Übertragung des Fentanylpflasters auf die Haut einer anderen Person, z. B. während der gemeinsamen Nutzung eines Bettes oder beim engeren Körperkontakt. „Zum Schutz gegen versehentliches Verschlucken durch Kinder soll die Applikationsstelle sorgfältig ausgewählt und regelmäßig überwacht werden, ob sich das Pflaster noch dort befindet.“[57]Die Koordinierungsgruppe (CMDh) der nationalen Arzneimittelbehörden der EU beschloss im Dezember 2022, dass umfassende Maßnahmen getroffen werden sollen, um die Anwendungssicherheit von Fentanyl-Arzneimitteln weiter zu erhöhen. Unter anderem müssen Hersteller die Verpackungen von Fentanylpflastern mit dem Warnhinweis „Versehentliche Anwendung oder Einnahme kann tödlich sein“ beschriften. Vorangegangen waren schwerwiegende Zwischenfälle durch versehentlichen Kontakt und Überdosierung. Patienten und Pflegekräfte sind anzuweisen, die Präparate vor dem Zugriff durch andere zu schützen.[58]
Nachdem es in den USA Presseberichten zufolge bei Helfern vor Ort zu Vergiftungen durch unbeabsichtigten Kontakt mit Fentanyl gekommen sein soll, entkräftete eine 2020 publizierte Studie diese Möglichkeit der Intoxikation. Eine Aufnahme giftiger Mengen von Fentanylpulver über die Haut sei sehr unwahrscheinlich.[59]
Wechselwirkungen
Die sedierende Wirkung von Fentanyl kann durch Beruhigungsmittel und Alkohol verstärkt werden. In Verbindung mit Monoaminoxidase-Hemmern können schwere Kreislauf- und Atemstörungen auftreten. Zwischen der Anwendung von MAO-Hemmern und Fentanyl sollen mindestens 14 Tage liegen. Durch die Plasmaeiweißbindung von 90 % kann es bei Verwendung in Schmerzpflastern zu Wechselwirkungen mit Präparaten wie Furosemid, Glibenclamid oder Omeprazol kommen.Der Abbauweg von Fentanyl führt über die Cytochromoxidase 450,[60] so dass bei gleichzeitiger Einnahme von CYP 3A4-Induktoren (z. B. Johanniskraut-Präparate; beschleunigen den Abbau von Fentanyl) oder CYP 3A4-Inhibitoren (z. B. Ketoconazol, Erythromycin, Nefazodon, Diltiazem, Grapefruitsaft; verlangsamen den Abbau von Fentanyl und können zu erhöhten Plasmaspiegeln führen) Wechselwirkungen auftreten können.
Die Kombination von Fentanyl (und anderen Opioiden) mit Calciumantagonisten kann neben der Verminderung der Toleranzentwicklung auch zu einer Potenzierung der analgetischen Wirkung führen. 1985 wurde die potenzierende Wirkung von Nimodipin gegenüber der analgetischen Wirkung von Fentanyl beschrieben. So soll die kombinierte Gabe von 0,1 mg Fentanyl zusammen mit Nimodipin (1 µg/kg/min Infusion) die gleiche Wirksamkeit wie 2,45 mg Fentanyl besitzen, was einer Potenzierung um das 24,5-fache entspricht.[61] Weitere Humanversuche zeigten, dass Nifedipin im Gegensatz zu Nimodipin keine Potenzierung der Fentanyl-Wirkung verursacht, allerdings war auch der Effekt von Nimodipin in dieser Studie deutlich schwächer (3-fache Potenzierung) als in der ersten Studie.[62]
Durch die gleichzeitige Gabe von fentanylhaltigen Arzneimitteln mit serotonerg wirkenden Arzneimitteln (SSRI/SNRI) besteht ein Risiko für das Auftreten eines gefährlichen Serotoninsyndroms mit Symptomen wie Agitiertheit, Koma, Halluzinationen, Blutdruckkrisen, neuromuskulären Veränderungen und Herzrasen, wie im März 2013 durch das Bundesinstitut für Arzneimittel und Medizinprodukte gewarnt wurde.[63]
Veterinärmedizin
Fentanyl wird zur Sedierung und Schmerztherapie in Kleintieren verwendet. Im Vergleich zu anderen Opioiden erzeugt es in Kleintieren weniger Erbrechen, eine tiefere Sedierung und weniger kardiovaskuläre Effekte.[64][65][66] Wie andere Opioide wird Fentanyl in Hunden mit Dysphorie assoziiert.[67]
Zur Behandlung chronischer Schmerzzustände stehen aus der Humanmedizin transdermale Verabreichungssysteme zur Verfügung, die auch bei Kleintieren eingesetzt werden können[68] (off label). Die 2012 in der EU und den USA neu im Markt eingeführte transdermale Lösung für die einmalige Anwendung gegen postoperative Schmerzen bei Hunden (Recuvyra) vermarktet der Hersteller nicht mehr.[69][70]
Präparate
- Parenteral (intravenös, intramuskulär): Fentanyl B. Braun (D), Fentanyl Hameln (A), Fentanyl Mepha (CH), Sintenyl (CH), u. a.
- Transdermal (transdermales therapeutisches Pflaster): Durogesic (A), Durogesic SMAT (D), Durogesic Matrix (CH), Generika (Fentoron, Matrifen u. a.)
- Oral-transmukosal:
- Buccaltablette: Effentora (EU), Generika
- Buccalfilm: Breakyl (D)
- Lutsch-/Buccaltablette mit integriertem Applikator (Elan Pharma/Teva): Actiq (D, A, CH)
- Sublingualtablette: Abstral (D)
- Nasal-transmukosal (Nasenspray): PecFent (Archimedes Pharma), Instanyl (Takeda)
- Für Tiere (Hunde): Fentadon (D, A)
Wirtschaft
Der Großteil medizinisch verwendeten Fentanyls wird in Europa und den Vereinigten Staaten eingesetzt (insgesamt 75 % des Weltmarktes in 2020), darunter in den Vereinigten Staaten und Deutschland mit je etwa 18 % des Weltmarkts von 2018 bis 2020.[71]Die Herstellung von medizinisch verwendetem Fentanyl (Administrative Controlled Substances Code Number 9801) nahm von 2300 kg im Jahr 2016 auf 731 kg im Jahr 2021 ab.[72] Im Jahr 2020 wurden in Deutschland 229.573 definierte Tagesdosen verschrieben.[73]Im Jahr 2013 verurteilte die EU-Kommission Johnson & Johnson und Novartis zu einer Kartellstrafe, nachdem deren niederländische Tochtergesellschaften im Jahr 2005 in verbotener Absprache die Markteinführung eines preisgünstigen Generikums verzögert und damit den Verkaufspreis künstlich hoch gehalten hatten.[74]
Pharmakologie
| Affinitäten, Ki | Verhältnis | ||
|---|---|---|---|
| μ-Opioid- Rezeptor (MOR) | δ-Opioid- Rezeptor (DOR) | κ-Opioid- Rezeptor (KOR) | MOR:DOR:KOR |
| 0,39 nM | >1.000 nM | 255 nM | 1:>2564:654 |
Fentanyl erzeugt seine analgetische Wirkung wie auch viele seiner Nebenwirkungen durch Aktivierung des μ-Opioidrezeptors (MOR). In auf DAMGO referenzierten BRET-Assays zeigt es sich als Vollagonist bzw. Superagonist mit Emax-Werten bis zu 130 %.[76][77]Fentanyl ist etwa 50 bis 100 mal so potent wie Morphin, was bedeutet, dass Fentanyl mit einem Hundertstel der Masse von Morphin die gleiche Intensität der Schmerzlinderung erreicht. Im Vergleich zu vielen anderen Opioiden hat Fentanyl einen schnellen Wirkungseintritt[78] und eine relativ kurze Wirkungsdauer.[79]
Es hat aufgrund des hohen First-Pass-Effektes eine perorale Bioverfügbarkeit von circa 30 %. Die Bioverfügbarkeit aus oral-transmukosalen oder transdermalen Darreichungsformen erreicht 50–90 %.[80] Fentanyl wirkt bei einer intravenösen Gabe nach fünf bis 120 Sekunden analgetisch.[81] Die maximale Wirkung tritt nach vier bis fünf Minuten ein.Die biologische Halbwertszeit liegt bei ein bis zwei Stunden.[82] Allgemein ist die Wirkung deutlich abhängig von der Dosis sowie Art und Dauer der Zufuhr (i.v.-Bolus oder kontinuierliche Zuführung etwa per Infusion).[83] In der Anästhesiologie wurde der Begriff der kontextsensitiven Halbwertszeit (CSHT) eingeführt, die angibt, nach welcher Zeit ab dem Stopp einer kontinuierlichen Infusion der Plasmaspiegel auf die Hälfte abgesunken ist. Für Fentanyl nimmt die CSHT mit fortwährender Infusionsdauer stetig zu[84] und variiert mit der Größe des Eingriffs. Bei chirurgischen Patienten[85] wurde die Halbwertszeit mit 3 bis 12 Stunden[83] bestimmt.Bei transdermaler Zufuhr tritt die Wirkung erst nach 12 bis 24 Stunden ein, mit dem maximalen schmerzstillenden Effekt ist erst nach 24 Stunden zu rechnen. Nach dem Entfernen des Pflasters wird der Wirkstoff aus dem Hautdepot weiter freigesetzt, wobei die Plasmakonzentration mit einer Halbwertszeit von 12 bis 24 Stunden abnimmt.[42][86] Die Berechnung von Dosierungsschemata für in der Anästhesie intravenös verabreichte Opioide erfordert eine komplexere Berücksichtigung ihres pharmakokinetischen Verhaltens, welches in der Literatur mit Multikompartimentmodellen beschrieben wird.[87] Demnach fällt nach intravenöser Injektion die Fentanyl-Plasmakonzentration in drei Phasen unterschiedlich rasch ab, deren Halbwertszeiten rund 1 Minute, 19 Minuten und 7,9 Stunden betragen.[87] Die zur Behandlung effektive Dosis (ED50) liegt bei 2 bis 20 µg/kg Körpergewicht bei laufender Überwachung der Atmung. Die schmerzstillende Wirkdauer von Fentanyl ist abhängig von der angewendeten Arzneiform: 48 bis 72 Stunden bei einem transdermalen Pflaster, bei transmukosaler Applikation 0,5 bis 2 Stunden, bei Buccaltabletten und Sublingualtabletten 4 bis 6 Stunden.[88] Die analgetische Wirkdauer bei intravenöser Gabe von 0,6 bis 2,5 µg/kg beim spontan atmenden Patienten beträgt 20 bis 30 Minuten.[89]
Fentanyl wird hauptsächlich in der Leber verstoffwechselt und nur zu weniger als zehn Prozent unverändert über die Nieren ausgeschieden.[90] Der Hauptmetabolit Norfentanyl ist pharmakologisch inaktiv.[91] Weitere Metaboliten ergeben sich durch N-Deacylierung, N-Oxidierung und Hydroxylierung an aromatischen und aliphatischen Molekülpositionen.[92] Chronische Leber- oder Nierenerkrankungen haben nur einen geringen Einfluss auf den Abbau bzw. die Ausscheidung.[93]

Fentanyl hat eine polare Oberfläche von 23,6 Å2 und ist mit einem Octanol-Wasser-Verteilungskoeffizienten von 717 sehr lipophil,[80] d. h. gut fettlöslich, und verteilt sich schnell in die Muskulatur und in fetthaltiges Gewebe. Dadurch kommt es zu einer Depotwirkung, die in einem Narkoseüberhang resultieren kann.[79] Kelly et al. erklären die Potenz des Fentanyls mit einem die Zellmembran betreffenden Depot-Effekt. Sie zitieren Studien, die für Fentanyl Affinitäten am MOR1 angeben, die etwas höher als die von Morphin sind, aber in derselben Größenordnung rangieren.Die hohe Lipophilie des Moleküls führt zur Anreicherung des Stoffs in der Zellmembran und damit zur hohen Konzentration in der nahen Umgebung der Zielrezeptoren. Molekulardynamische Simulation legt nahe, dass der Wirkstoff mit seiner relativen Schlankheit und inneren Beweglichkeit aus der Ebene der Lipidschicht seitlich ins Rezeptorinnere vordringt und umgekehrt auch wieder rückdiffundiert. Ein derartiger Membran-Depot-Effekt erhöht die Ligandverfügbarkeit am Wirkort und kommt bei hydrophileren und starreren Morphinan-Opioiden wie Morphin (cLogP = 0,8) nicht zur Geltung.[78]
Fentanyl bindet aktivierend an Serotonin-Rezeptoren (Ki an 5HT1A 2,1 μM und an 5HT2A 1,3 μM).[39] Es ist ein schwacher Inhibitor des Serotonintransporters (SERT) mit einer IC50 von 154 μM.[39]Möglicherweise trägt die Aktivierung im Atemzentrum befindlicher Serotoninrezeptoren zur Letalität einer Überdosis bei.[94] Fentanyl hemmt hERG1a/1b-Kanäle und fördert damit Herzrhythmusstörungen.[95]
Die Struktur des MOR1 mit gebundenem Fentanyl wurde elektronenmikroskopisch bestimmt und im Jahr 2022 veröffentlicht.[96] Molekulardynamische Simulation legt nahe, dass Fentanyl an der orthosterischen MOR1-Bindungsstelle mindestens zwei Lagen sowie mehrere Konformationen einnehmen kann.[78]
Es gibt Hinweise, dass Fentanyl eine geringe Kreuztoleranz hat gegenüber Morphinan-Opioiden wie etwa Heroin. Es besteht aber Bedarf an einer systematischeren Prüfung.[78]
Physikalische und sensorische Eigenschaften
Fentanyl hat bei Normaldruck einen Siedepunkt von 466 °C und einen Flammpunkt von 186 °C.[97] Fentanylcitrat wird als geruch- und geschmackloses, weißes, kristallines Pulver beschrieben.[98]
Synthese
Janssen-Methode
Gemäß der von Paul Janssen ursprünglich entwickelten und aus heutiger Sicht als umständlich geltenden Synthese wird 4-Piperidinon zunächst per N-Benzylierung geschützt. Das anschließend durch Kondensation des N-Benzyl-4-piperidinons mit Anilin entstehende Imin wird mit Lithiumaluminiumhydrid reduziert.Das so erhaltene 4-Anilino-N-benzylpiperidin wird mit Propionsäureanhydrid zum Benzylfentanyl N-acycliert. Das durch hydrogenolytische Debenzylierung entstehende Norfentanyl wird mit Phenethylchlorid N-alkyliert, so dass sich Fentanyl als Endprodukt ergibt.[99]
Siegfried-Methode und Valdez-Variante

Die „Siegfried“-Methode, die ihren Ursprung in einer privaten, von Erowid archivierten Internet-Veröffentlichung hat, verzichtet auf das aufwändige Schutzgruppenkonzept, indem sie die N-Phenethylierung in den ersten Syntheseschritt verlegt. Das resultierende N-Phenethyl-4-piperidinon (NPP) wird mit Anilin zum Imin kondensiert, welches zu 4-Anilino-N-phenethylpiperidin (4-ANPP) reduziert wird. Die herkömmliche Propionylierung ergibt das Endprodukt in einer Gesamtausbeute von 50 bis 80 %.[100]In verschiedenen Ländern machten Fentanyl produzierende illegale Labore in den frühen 2000er Jahren Gebrauch von der Siegfried-Methode.[101] Eine ausbeutenoptimierte Variante, die einen reduktiven Aminierungsschritt enthält, stellten Valdez et al. im Jahr 2014 vor.[102]
Gupta-Methode

Ein Eintopfverfahren aus dem Jahr 2005 folgt einer reduktiven Tandem-Aminierung, die Natriumtriacetoxyborhydrid als Reagenz verwendet. Dabei reagiert Phenylacetaldehyd mit 4-Piperidinon zu NPP, und zwar chemoselektiv, da der Aldehyd die reaktivere Carbonylkomponente ist. Das Keton reagiert anschließend mit Anilin in situ zum 4-ANPP. Die abschließende N-Propionylierung erfordert ebenfalls keine Isolation des Ansatzes, da das überschüssige Reduktionsmittel als Abfangreagenz genügt.[103] Ausbeuten bis zu 81 %[104] und leichte Durchführbarkeit machen dieses Verfahren für eine ökonomische Massenproduktion attraktiv. Entsprechend ist das Gupta-Verfahren in der illegalen Fentanyl-Produktion der Gegenwart vorherrschend, wie sich im Jahr 2021 auf Grundlage einer Profiling-Analyse herausstellte, welche 318 in den Vereinigten Staaten beschlagnahmte fentanylhaltige Drogenpräparate untersuchte.Der durchschnittliche Fentanylanteil der Proben betrug 13,6 %, die Spanne reichte von 0,2 % bis 36,4 %. Ein hoher Anteil herkömmlicher Streckstoffe wurde dabei identifiziert.[105]
Analytik
Zur sicheren qualitativen und quantitativen Bestimmung von Fentanyl in Blut-/Blutplasmaproben und Urin wird nach angemessener Probevorbereitung die Kopplung der Gaschromatographie oder HPLC mit der Massenspektrometrie eingesetzt.[106][107][108][109] Zu Dopingtests werden diese Methoden ebenfalls angewandt.[110] Auch Immunassays[111][112] und elektrochemische Analysen (Voltammetrie, Potentiometrie und Elektrochemilumineszenz)[113] finden Verwendung. Typische Blut- oder Plasmakonzentrationen von Fentanyl im Menschen sind 0,3–3,0 μg/L bei medizinischem Gebrauch, 1–10 μg/L in Drogenkonsumenten und 3–300 μg/L bei akuter Überdosierung.[114] Ein qualitativer Schnelltest kann mit dem Marquis-Reagenz durchgeführt werden.
Auch für forensische Untersuchungen kommen diese Verfahren zum Einsatz.[115][116] In der Forensik gibt es nur eine geringe Korrelation zwischen der ante-mortem-Blutkonzentration von Fentanyl und der post-mortem-Blutkonzentration.[117] Daneben erfolgt nach dem Tod eine Umverteilung des Fentanyls.[118]
Abkömmlinge
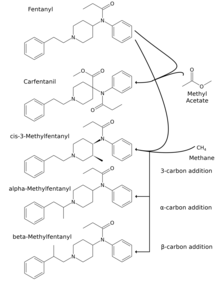
In immenser Vielfalt wurde die Stammverbindung Fentanyl molekularstrukturell modifiziert.[21][119][12] Illegale Varianten erschienen zuerst in den 1980er Jahren; ihre Verbreitung erhöhte sich in den 2010er Jahren. Viele dieser neu gestalteten Opioide sind ohne oder mit geringem präparativen Mehraufwand herstellbar. Gekennzeichnet sind sie durch Substitution wie z. B. formale Fluorierung an den Phenylringen oder formale Methylierung im Piperidinring bzw. im Ethylenbindeglied, sowie durch neue Struktureinheiten am N-Acyl wie gesättigte oder ungesättigte Ringe in der Größe C3 bis C6, olefinische Doppelbindung, Methoxyl und verzweigte Alkyle.
Struktur-Wirkungsbeziehungen
Austausch des Piperidins gegen einen β-Tropanring in Sesselkonformation (Tropafentanyl) verringert die analgetische Wirksamkeit geringfügig. Geringfügig verstärkt wird sie durch Einbindung des Phenethylanteils in eine 1,2,3,4-Tetrahydro-2-naphthylstruktur. Cis-konfigurierter Ringschluss zwischen dem N-Phenyl in ortho-Position und Position 3 des Piperidins in Form eines 1,5-Benzoxazepins ist ohne Aktivitätsverlust möglich; das trans-Isomer ist geringfügig aktivitätsgemindert.[120] Remifentanilsäure-tert-butylester ist eines der potentesten Opioide. Furanylfentanyl zeichnet sich aus durch G-Protein-Agonismus und β-Arrestin2-Antagonismus.[121] Demgegenüber ist Carfentanyl ein β-Arrestin2-bevorzugender Agonist.[122] Mit dem Austausch des N-Phenyls gegen ein Guanidinyl-gebundenes C5- oder C6-Alkyl gelang es, MOR-Agonisten zu erhalten, die bitopisch an die orthosterische sowie die Natriumbindungsdomäne des Rezeptors binden und die, bezogen auf das Spektrum der koppelnden Proteine, d. h. G-Protein-Subtypen und beta-Arrestin2, eine gewisse funktionelle Selektivität aufweisen. Das C5-Derivat bewirkt neben der Analgesie eine Atemstimulation über einen unbekannten, MOR-unabhängigen Mechanismus und zeichnet sich durch ein erheblich günstigeres Nebenwirkungsprofil aus.[76]
pH-Wert-sensitive β-Fluorfentanyle
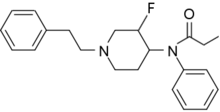
Zu den Konzepten zur Erhöhung der therapeutischen Breite von Opioiden gehört die pH-Wert-abhängige MOR-Agonistenbindung. Die Basizität einer Aminfunktionalität, die sich im pKS-Wert ausdrückt, ist abhängig von ihrer molekularen Umgebung. Proximaler Elektronenzug mindert die Basizität. Erreicht wird dies durch Substitution mit dem elektronegativen Element Fluor in beta-Position. Die Begrenzung der Protonierbarkeit eines Wirkstoffs auf einen im Sauren liegenden pH-Wert-Bereich, der für verletztes, insbesondere entzündetes Gewebe kennzeichnend sein kann, soll eine supramolekulare Bindungsselektivität zugunsten von Rezeptoren im peripheren Nervengewebe gewährleisten.Auf Grundlage dieses im Jahr 2017 vorgestellten Konzepts wurden die fluorierten Derivate NFEPP, FF3 und RR-49 entwickelt. In vivo wurde damit noch kein durchschlagender Erfolg erzielt (2023).[123]
Rechtslage
Fentanyl ist als Arznei- und Rauschmittel unter anderem dem deutschen und Schweizer Betäubungsmittelgesetz sowie dem österreichischen Suchtmittelgesetz unterstellt. In den Niederlanden ist Fentanyl eine Substanz der Liste I des Opium-Gesetzes.[124] In Estland wird Fentanyl seit den frühen 2000ern am längsten zum nichtmedizinischen Gebrauch verwendet, und zwar seit die Taliban den Anbau von Schlafmohn in Afghanistan verboten haben.[125] In Großbritannien zählt Fentanyl als controlled Class A drug nach dem Misuse of Drugs Act 1971.[126]
In den Vereinigten Staaten ist Fentanyl eine Schedule II controlled substance nach dem Controlled Substances Act. Vertreiber von Abstral sind verpflichtet, am FDA-genehmigten Risk-Evaluation-and-Mitigation-Strategy-Programm teilzunehmen (REMS).[127][128]Zur Vermeidung von Missbrauch verlangen in den Vereinigten Staaten einige Versicherer Vorzertifizierung und/oder Mengenbegrenzung für Verschreibungen von Actiq.[129][130][131]In Kanada ist Fentanyl eine Droge der Liste I nach dem Controlled Drugs and Substances Act.[132] Laut einem Bericht in The Guardian von 2018 haben viele große Drogenhändler im Darknet selbsttätig den Handel mit Fentanyl eingestellt.[133]
Drogenmissbrauch


Spätestens seit 2006 nimmt der Missbrauch von Fentanyl in den Vereinigten Staaten zu. In einem Bericht sprach das CDC von 1000 Toten zwischen 2005 und 2007; die meisten Fälle wurden in Chicago, Philadelphia und Detroit registriert.[136] Ab 2013 waren Fentanyl und seine Analoga vermehrt in den Vereinigten Staaten auf dem Schwarzmarkt erhältlich.[90]Mitursächlich für den zugenommenen Missbrauch in den USA war die Legalisierung von Marihuana in mehreren amerikanischen Gliedstaaten. Damit ist eine Einnahmequelle des organisierten Verbrechens versiegt.[137]Die daraus folgende Zunahme an Überdosis-Toten durch Fentanyl wird in den Vereinigten Staaten als dritte Welle der Drogentoten-Epidemie bezeichnet.[138] Im Jahr 2014 waren es 4200 Tote.[139]Vorläufige Daten zeigen, dass Fentanyl für einen großen Teil der geschätzt 59.000 bis 65.000 Drogentoten des Jahres 2016 in den Vereinigten Staaten ursächlich war. Im Bezirk Montgomery County wurde im Januar und Februar 2017 bei 99 von 100 Drogentoten Fentanyl oder ein Analogon nachgewiesen.[140]Laut New York Times starben allein auf Long Island 2016 mindestens 220 Menschen durch den Missbrauch von Fentanyl.[141]Von den über 90.000 Personen, die im Jahr 2020 in den Vereinigten Staaten an einer Überdosis starben, nahm jede zweite Fentanyl.[142] Im Jahr 2021 starben in den USA 70.000 Menschen an Fentanyl. Es ist für Amerikaner in der Altersgruppe zwischen 18 und 45 Jahren die häufigste Todesursache.[143]Die Drug Enforcement Administration (DEA) beschlagnahmte 2022 mehr als 4500 kg Fentanyl und über 50 Millionen Fentanyltabletten – mehr als doppelt so viel wie 2021 und genug, um die gesamte Bevölkerung der Vereinigten Staaten zu töten.[144]
Ein Grund für die hohen Todesraten bei Fentanylanwendungen ist die geringe therapeutische Breite.[145] Während eine therapeutische Dosis injizierten Fentanyls über 0,02 mg/kg Körpergewicht nur bei Anwendung der Herz-Lungen-Maschine möglich ist, liegt die letale injizierte Dosis für (Rhesus-)Affen bereits bei 0,03 mg/kg Körpergewicht.[146] Fentanyl kann so schon in einer Menge ab 2 mg für einen erwachsenen, normalgewichtigen Menschen tödlich sein.[147][148]
Eine besondere Gefahr geht auch von Fentanyl in Pulverform aus, so wie es als Ausgangsstoff zwecks Verarbeitung zu Fertigarzneimitteln erworben, aber auch auf dem Schwarzmarkt gehandelt wird, um dann z. B. als Injektion oder transnasal (über die Nasenöffnung) eingenommen zu werden. Es sind Zwischenfälle bekannt, in denen unbeabsichtigt das Pulver in der Luft verwirbelt wurde – beispielsweise beim Fallenlassen eines Behälters mit dem Stoff. So kann ungewollt Fentanyl-Aerosol in Nasen- und/oder Mundschleimhaut gelangen. Eine ungewollte Aufnahme über die Haut ist ebenso möglich, hängt jedoch sehr von der Kontaminationsdichte und den Expositionsbedingungen ab. Die chemisch-physikalische Form des Fentanyls (Base oder Salz, Pulver oder Lösung) und die Durchfeuchtung der Haut (etwa durch Schwitzen) beeinflussen die Penetrationsrate.Einer Studie zufolge sind pharmakologische bzw. toxische Wirkungen nur bei sehr hoher Exposition und verschwitzter Haut zu erwarten.[149][150][151]
Fentanyl wird oft mit verschiedenen Zuckern (wie Lactose) oder dem Zuckeralkohol Mannitol verschnitten.[152] Fentanyl wird auch zum Strecken zahlreicher auf dem Schwarzmarkt erhältlicher Drogenzubereitungen eingesetzt; wie u. a. Heroin, Kokain, Amphetaminen oder ferner auch gepresster Tabletten (wie den berüchtigten „M30“-Fälschungen).[153][154][155] Die Beimischung von Fentanyl zu den vorgenannten Substanzen ist auf die gewinnorientierte Induzierung einer Fentanylabhängigkeit ausgerichtet.[156]Durch zu hohe Dosierung oder falsche Verteilung des Fentanyls kommt es so regelmäßig zu unwillkürlicher Überdosierung auf Seiten der Konsumenten, was nicht selten zu lebensgefährlichen Atemdepressionen und zum Tode führt, was die Gesamtzahl Drogentoter weltweit nach oben treibt.[157] Fentanyl, das so verwendet oder direkt auf dem Schwarzmarkt verkauft wird, stammt teils aus legaler pharmazeutischer und teils aus illegaler Produktion.[158] Die Verwendung von Fentanyl als Strecksubstanz ist besonders populär, da es – in bereits sehr geringer Dosierung eingesetzt – eine deutliche psychotrope Wirkung erreicht, wodurch die starke Streckung damit oft viel weniger augenscheinlich ist als die Beimengung von nicht psychotropen Substanzen, wie z. B. Lactose, Glukose oder Ascorbinsäure. In einigen US-Bundesstaaten ist die Ausrüstung von Rettungs- und Polizeikräften mit lebensrettender Naloxonzubereitung (z. B. zur nasalen Applikation – wie Narcan) Standard.
Überdosierungen werden durch Injektion mit Naloxon behandelt. Zur langfristigen Behandlung der Fentanylabhängigkeit werden experimentelle Impfstoffe untersucht, die Antikörper gegen Fentanyl hervorrufen.[29] Dadurch wird Fentanyl durch die Antikörper gebunden aus dem Blutkreislauf entfernt.[29]
Verwendung als Gift
Hinrichtungsmittel
Fentanyl wurde am 14. August 2018 erstmals als Bestandteil einer Wirkstoffmischung zur Hinrichtung des Doppelmörders Carey Dean Moore im Staatsgefängnis von Nebraska verwendet.[159][160]Der Grund für den Einsatz bei letalen Injektionen in den USA ist die schwieriger werdende Beschaffung der zuvor verwendeten Giftstoffe (u. a. Thiopental) aufgrund eines Liefer- bzw. Produktionsstopps seitens der Hersteller. Auch der US-Bundesstaat Nevada plante den Einsatz von Fentanyl für Hinrichtungen.[161] Nachdem der Hersteller gegen die seiner Meinung nach illegale Anwendung seines Präparats im Juli 2018 geklagt hatte, wurde die Hinrichtung von Scott Dozier ausgesetzt.[162]
Giftmord
Der Brite Mark D'Wit wurde 2024 zu einer lebenslänglichen Haftstrafe von mindestens 37 Jahren für den Mord an Stephen und Carol Baxter in Essex verurteilt. Er hatte deren Getränke mit Fentanyl versetzt.[163]
Literatur
- Eberhard Klaschik: Schmerztherapie und Symptomkontrolle in der Palliativmedizin. In: Stein Husebø, Eberhard Klaschik (Hrsg.): Palliativmedizin. 5. Auflage. Springer, Heidelberg 2009, ISBN 3-642-01548-4, S. 207–313, hier: S. 233 f., 251 f. und 466 f.
- Sam Quinones: The Least of Us: True Tales of America and Hope in the Time of Fentanyl and Meth. Bloomsbury, New York 2021, ISBN 978-1-63557-435-7.
- Michael A. Überall: Transmukosale Applikation von Fentanyl: sublingual, buccal, nasal – egal? In: MMW – Fortschritte der Medizin. Band 159, S6, 2017, S. 15–22, doi:10.1007/s15006-017-0081-1.
Weblinks
- Fentanyl. In: Erowid. (englisch)
- Fentanyl-Arzneimittel auf der Website der Europäischen Arzneimittelagentur (Europäischer Öffentlicher Beurteilungsbericht, EPAR)
